水稻秸秆制备微生物絮凝剂及改善污泥脱水性能的研究
2016-12-20郭俊元成都信息工程大学资源环境学院四川成都610225
郭俊元,赵 净,付 琳 (成都信息工程大学资源环境学院,四川 成都 610225)
水稻秸秆制备微生物絮凝剂及改善污泥脱水性能的研究
郭俊元∗,赵 净,付 琳 (成都信息工程大学资源环境学院,四川 成都 610225)
采用水稻秸秆制备微生物絮凝剂,研究了微生物絮凝剂对污泥脱水性能的影响,并通过响应面分析法优化了微生物絮凝剂与聚合氯化铝(Polyaluminum chloride, PAC)复配改善污泥脱水性能的过程.结果表明,制备微生物絮凝剂的最佳条件为:800mL蒸馏水、200mL水稻秸秆酸解液、4g K2HPO4、2g KH2PO4、0.2g MgSO4、0.1g NaCl、2g尿素,在此条件下,微生物絮凝剂产量达0.96g/L.保持原污泥pH值,当微生物絮凝剂投加量为12mg/L,干污泥量(DS)较原污泥提高了59.5%,污泥比阻(SRF)降低了53.6%,表明经微生物絮凝剂絮凝处理,污泥脱水性能显著改善.保持原污泥pH值,当PAC投加量为3g/L,干污泥量(DS)为16.4%,高于原污泥的13.2%,污泥比阻为(SRF) 5.4×1012m/kg,低于原污泥的 11.3×1012m/kg,说明 PAC对污泥脱水性能有着明显的改善作用.响应面分析结果显示,污泥脱水最佳条件为微生物絮凝剂8.1mg/L、PAC 1.9g/L、pH值8.0,相应DS和SRF分别为24.1%和3.0×1012m/kg.实际污泥脱水工程中,污泥pH往往不进行调节,保持原污泥pH=6.4条件下,DS和SRF分别为23.6%和3.2×1012m/kg,均优于单独采用微生物絮凝剂和PAC时的污泥脱水效果.
微生物絮凝剂;聚合氯化铝;污泥脱水;响应面分析
污水处理厂常用的污泥脱水调理剂聚合氯化铝(Polyaluminum chloride, PAC)和聚丙烯酰胺(Polyacrylamide, PAM),具有污泥处理效果好、成本较低等优点,但其长期使用不仅会导致污泥中重金属富集,而且易在污泥中引入剧毒的丙烯酰胺单体,对污泥后续处置造成很大的压力[1].微生
物絮凝剂,是微生物在代谢过程分泌的聚合物,具有高效絮凝作用,能够破碎污泥细胞使束缚水和固体颗粒分离,促进污泥减量化[2].然而,制备成本高制约着微生物絮凝剂的广泛使用[3],利用富含有机质的废弃物制备微生物絮凝剂,是降低制备成本的可行途径[4].本文作者曾利用猪场粪污制备微生物絮凝剂,并初步探索了微生物絮凝剂应用于污泥脱水中的可行性[5].Yang等[6]报道称,采用微生物絮凝剂与无机或有机高分子絮凝剂复配,能够提高废水的处理效率,降低可能产生的二次污染.本文作者曾研究了微生物絮凝剂与改性沸石复配处理猪场废水的性能,结果表明,在最优化条件下,废水中 COD和氨氮去除率大幅提高至 87.9%和 86.9%[7].由此可见,采用微生物絮凝剂与PAC复配,能够预期实现提高污泥脱水效率的研究目的,并减少单独使用PAC所造成的二次环境污染.
本研究首先探索了水稻秸秆制备微生物絮凝剂的可行性,然后通过检测污泥脱水过程中干污泥含量(DS)和污泥比阻(SRF)的变化规律,考察微生物絮凝剂与PAC分别在污泥脱水中的优越性与互补性,在此基础上,采用微生物絮凝剂与PAC复配的方法改善污泥脱水,运用响应面优化法优化污泥脱水过程及条件参数,考察微生物絮凝剂与PAC复配改善污泥脱水性能的效果.
1 材料与方法
1.1 菌种来源及微生物絮凝剂制备
试验用菌株为红平红球菌,保藏于中国典型微生物保藏中心(No.10543).以水稻秸秆的酸解产物制备微生物絮凝剂,水稻秸秆采自四川省三台县近郊,将秸秆与硫酸(1.7%,W/W)按照 1:8(W/ V)混合酸解2h,在6000r/min条件下离心30min,收集上清液,作为制备微生物絮凝剂的底物[8-9].发酵培养基:800mL蒸馏水、200mL酸解液、4g K2HPO4、2g KH2PO4、0.2g MgSO4、0.1g NaCl、2g尿素.挑取少许菌至发酵培养基,于发酵温度35℃、摇床速度 150r/min的条件下发酵培养得到发酵液,从中提取微生物絮凝剂.发酵培养基优化和微生物絮凝剂提取均采用本文作者前期的研究方法[10].
1.2 絮凝活性的测定
实验通过检测微生物絮凝剂对4g/L高岭土悬液的絮凝率表征其絮凝性能,在100mL高岭土悬液中,加入5mg CaCl2作为助凝剂,再加入2mL离心去菌体的发酵液,常温条件下,快速搅拌1min (180r/min),慢速搅拌 4min (80r/min),静沉10min,取上清液,使用分光光度计测定波长550nm处的吸光度 OD550,以未接种的培养基代替上清液作为对照.絮凝率计算公式:

式中:FR为絮凝率;A为絮凝后高岭土悬液的OD550;B为高岭土原液的OD550.
1.3 污泥脱水实验
实验污泥取自四川省某污水处理厂,干污泥含量(DS)、污泥比阻(SRF)、污泥pH值分别为13.2%、11.3×1012m/kg、6.4.污泥中分别投加微生物絮凝剂或 PAC,200r/min条件下搅拌10min,静置30min,采用抽滤装置抽真空,真空压力为0.04MPa,每隔15s记录滤液量.SRF与DS计算公式:

式中:t为时间,s;V为滤液量,m3;μ为滤液黏度, Ns/m2;A为过滤面积,m2;P为压降,N/m;c为浓度, kg/m3;α为污泥比阻(即SRF);Rm为过滤介质阻力(忽略);W1和W2分别为干燥前后泥饼的重量,g.
1.4 微生物絮凝剂与PAC复配的响应面优化
采用中心复合设计的二阶模型对变量的响应行为进行表征,3个变量为微生物絮凝剂(x1)、PAC(x2)、污泥pH值(x3),响应值(y)设置为DS和SRF.CCD的二阶模型为:

式中:xi与 xj为相互独立的影响因子;β0是偏移项;βi表示xi的线性效应;βii表示xi的二次效应;βij表示xi与xj之间的交互作用效应.表1为Design-
expert 8.0.5软件所设计实验.

表1 中心复合设计Table 1 Coded levels for three variables framed by the Central Composite Design
2 结果与讨论
2.1 微生物絮凝剂的制备
2.1.1 发酵培养基 pH对制备微生物絮凝剂的影响 不同微生物在发酵过程中,对培养基的初始pH要求不同.例如:Paenibacillus polymyxa在弱酸弱碱性环境中均体现出了较好的代谢能力[10],而 Streptomyces只有在弱酸性环境中才能积累代谢产物[11].由图1(a)可知,本实验菌株发酵制备微生物絮凝剂的初始 pH范围比较广(5.5~8.5),囊括了发酵培养基本身的 pH(6.7),因此,本实验制备微生物絮凝剂过程中无需调节 pH.在此 pH范围内,菌株的代谢产物均有较高的絮凝活性(高于 60%),絮凝剂产量显示出与絮凝活性随pH变化相一致的规律,尤其当pH=7.5时,絮凝剂产量及其对高岭土悬液的絮凝率均达到最大值(0.46g/L、75.2%).当不调节发酵培养基pH时,絮凝剂产量及絮凝率分别为 0.42g/L、71.8%.酸度过高(pH<5)或碱度过高(pH>10)时,微生物絮凝剂的生成及其絮凝活性的表达均受到抑制,相应的产量和絮凝率分别低于 0.18g/L和 43.5%,这是因为酸度过高或碱度过高引起菌体细胞表面电荷的变化,菌体细胞表面电荷的变化导致有机物离子化,不利于其渗入细胞体内,从而抑制菌株的生长和絮凝产物的生成[10].
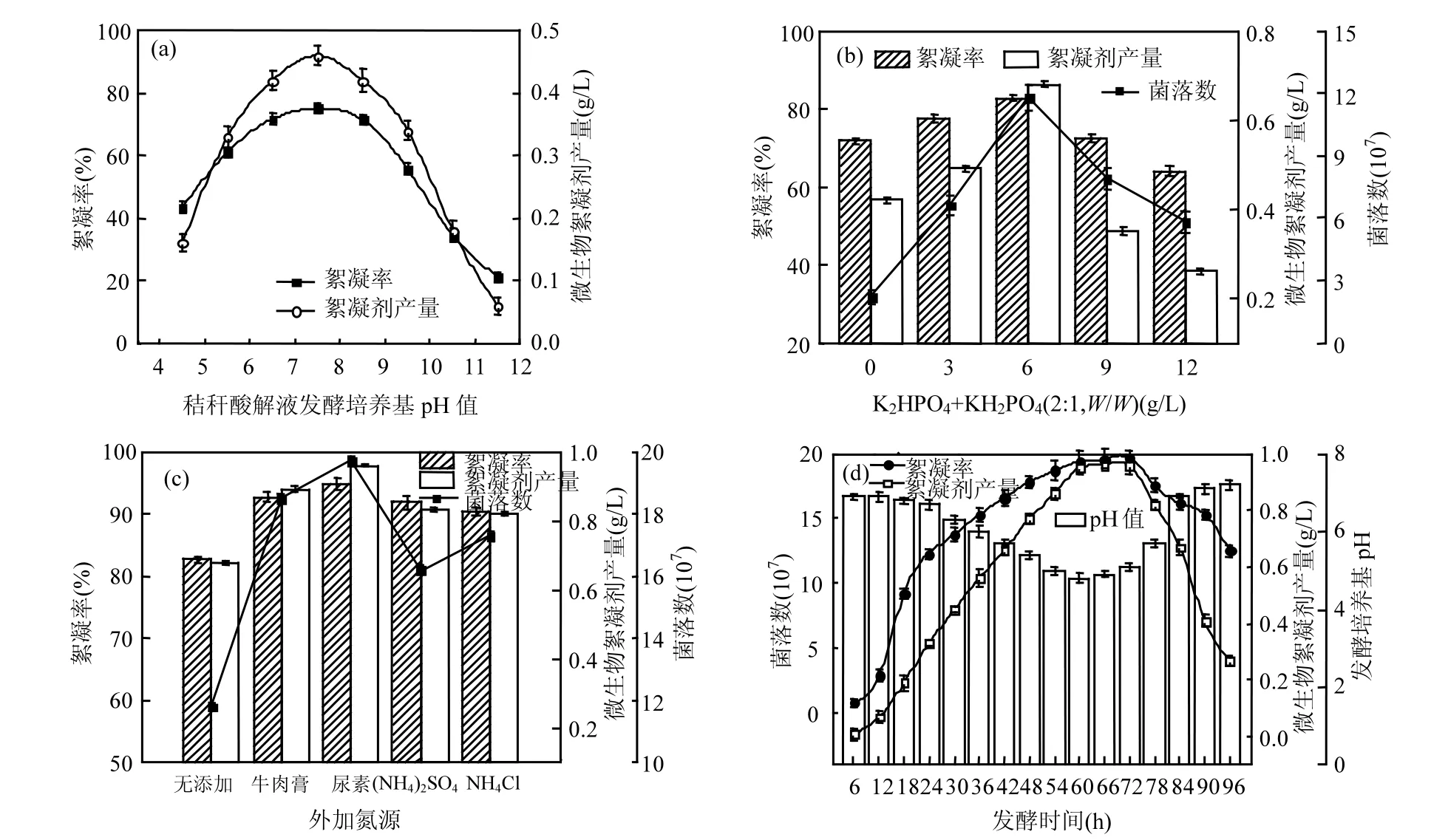
图1 发酵培养基pH (a)、外加磷酸盐(b)、外加氮源(c)对微生物絮凝剂制备的影响及生长曲线(d)Fig.1 Effects of media pH (a), extra phosphate (b), and extra carbon (c) on bioflocculant production. Cell growth curve (d)
2.1.2 外加磷酸盐、碳源、氮源对制备微生物絮凝剂的影响 由图 1(b)可知,水稻秸秆酸解液发酵培养基中分别添加不同浓度的磷酸盐(K2HPO4+KH2PO4, W/W=2:1),发酵培养微生物菌
株72h后,菌落数、絮凝剂产量、及对高岭土悬液的絮凝率均有所提高,尤其当磷酸盐浓度为6g/L时,分别达到最大值(11.8×107/mL、0.68g/L、82.7%),远高于不添加磷酸盐时的2.2×107/mL 、0.42g/L、71.8%,说明适量的磷酸盐可以促进微生物增殖、代谢产物的积累、及其活性的表达,这与Guo等[10]利用淀粉废水制备微生物絮凝剂的研究结论相似.然而,磷酸盐浓度较低时,不足以提供微生物细胞合成核酸、磷脂等含磷化合物的重要元素;过高的磷酸盐含量则会抑制微生物细胞外多糖的分泌,从而降低发酵液的黏度、活性、产量[12].
通常情况下,葡萄糖、蔗糖等水溶性糖类作为碳源,微生物生长迅速、絮凝产物活性高,Bacillus licheniformis和Bacillus subtilis即是如此[13-14].本实验制备微生物絮凝剂的过程中,培养基中分别添加2g/L葡萄糖、蔗糖、淀粉、2mL/L甲醇、乙醇,发酵培养微生物菌株72h后,菌落数、絮凝剂产量、及对高岭土悬液的絮凝率无明显提高,增加幅度分别为 1.3%~2.9%、1.8%~3.3%、 1.5%~2.7%,说明无需外加碳源,水稻秸秆酸解释放的有机质足以满足菌株代谢和发酵.由图 1(c)可知,培养基中分别添加 2g/L(NH4)2Cl、(NH4)2SO4、牛肉膏、尿素等氮源,发酵培养微生物菌株72h后,菌落数、絮凝剂产量、及对高岭土悬液的絮凝率,均大幅提高,说明上述氮源均有助于微生物的发酵及絮凝剂的积累,尤其外加2g/L尿素后,菌落数增加至19.7×107/mL,絮凝剂产量及其絮凝活性分别提升至 94.8%和0.96g/L.Li[13]、Subudhi等[15]的研究也显示出氮源对于微生物絮凝剂制备的不可或缺.
2.1.3 微生物菌株的生长曲线 由图 1(d)可知,6~60h是菌株对数生长期,菌株能充分利用发酵培养基中丰富的有机质及外加的氮磷生长繁殖,菌落数和絮凝剂产量迅速增加至 19.4× 107/mL和 0.95g/L,絮凝剂对高岭土悬液的絮凝率也达到了最大的 94.5%;菌株在稳定期内(60~72h),菌落数与絮凝剂产量均维持在一个稳定的状态,说明代谢产物的生成和积累基本上是伴随着菌株生长过程,Wang等[8]发酵培养Ochrobactrum ciceri制备微生物絮凝剂时显示了相同的结论.菌株进入衰退期(72h)后,菌落数、发酵液黏度、活性逐渐降低,90h时,絮凝剂产量降低至约 0.27g/L.在衰退期絮凝剂产量的减少,可能与菌体细胞自溶和酶活性的降低有关.图 1(d)还可得知,发酵培养基的pH值在6~24h内维持在相对稳定的水平,然后出现下降趋势(由24h时的6.7下降至60h时的4.8),这是由于菌株代谢过程中产生有机酸等物质造成的,进入衰退期后,培养基的pH值逐渐回升至7.2时,原因是细胞裂解和胞内物质的释放[10].
2.2 微生物絮凝剂的成分和特征
2.2.1 生化测试 苯酚–硫酸法和考马斯亮蓝法检测结果显示,该微生物絮凝剂的主要絮凝成分是多糖类物质,其中含有中性糖 41.2%、糖醛酸4.3%、氨基糖2.9%;凝胶渗透色谱显示絮凝剂分子量为 3.88×105Da. 实验继而采用红外光谱分析手段检测了微生物絮凝剂的特征功能基团,结果显示,3300cm-1处的吸收峰是–OH[16]; 2375cm-1处的吸收峰为 C—H;1632cm-1处的吸收峰为–COO-的反对称伸缩振动;1400cm-1处的吸收峰是–COO-的对称伸缩振动[3];1080-545cm-1处的吸收峰为C—O的伸缩振动[17].该微生物絮凝剂具有较高的分子量和羟基、羧基等极性基团,可以提供更多的“结合位点”、更高的絮凝活性、以及更强的范德华力,因此,能够通过吸附或范德华力或桥接机制,促进高岭土悬液的絮凝,并具备促进污泥脱水的潜质[18].
2.2.2 微生物絮凝剂的热稳定性和酶稳定性分析 研究表明,蛋白质类微生物絮凝剂热稳定性较差,而多糖类微生物絮凝剂热稳定性较好[5].本实验分别将7份相同发酵液置于4、30、40、50、80、100和120℃的温度环境下30min后,检测对4g/L高岭土悬液的絮凝率,结果如表2所示,变化幅度较小的絮凝率再次说明本实验制备的微生物絮凝剂其主要有效成分为多糖类物质.本文作者曾采用相同的菌株以剩余污泥为基质制备微生物絮凝剂,发现其主要成分为蛋白质类物质,这可能是由于不同的营养成分和生物-物理环境所导致的[19].

表2 微生物絮凝剂的热稳定性Table 2 Thermal stability of the bioflocculant
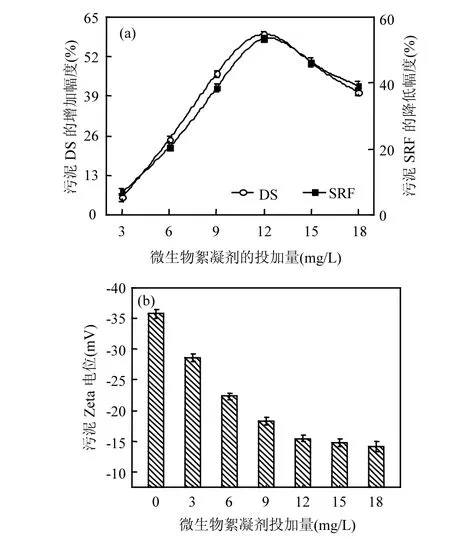
图2 微生物絮凝剂对污泥脱水的影响(a)、以及污泥Zeta电位与微生物絮凝剂投加量的关系(b)Fig.2 Bioflocculant dose on sludge dewatering (a), and relationship between bioflocculant and sludge’s Zeta potential (b)
实验分别采用3种糖原磷酸化酶(淀粉酶、纤维素酶、葡糖淀粉酶)、糖苷酶、两种蛋白酶(胃蛋白酶、胰蛋白酶)水解6份相同的发酵液样品,检测水解后样品对4g/L高岭土悬液的絮凝率,结果表明,分别采用三种糖原磷酸化酶水解后的微生物絮凝剂对高岭土悬液的絮凝率显著降低至29.5%、32.3%、18.7%;采用糖苷酶和两种蛋白酶催化水解后的微生物絮凝剂对高岭土悬液的絮凝率则能够保持在原絮凝率的97.4%、98.1%、98.4%,而上述酶本身均不具有絮凝活性,表明该絮凝剂的有效成分是多糖类物质,而非蛋白质, Salehizadeh和Yan得出了类似的研究结论[20].
2.3 微生物絮凝剂对污泥脱水性能的影响
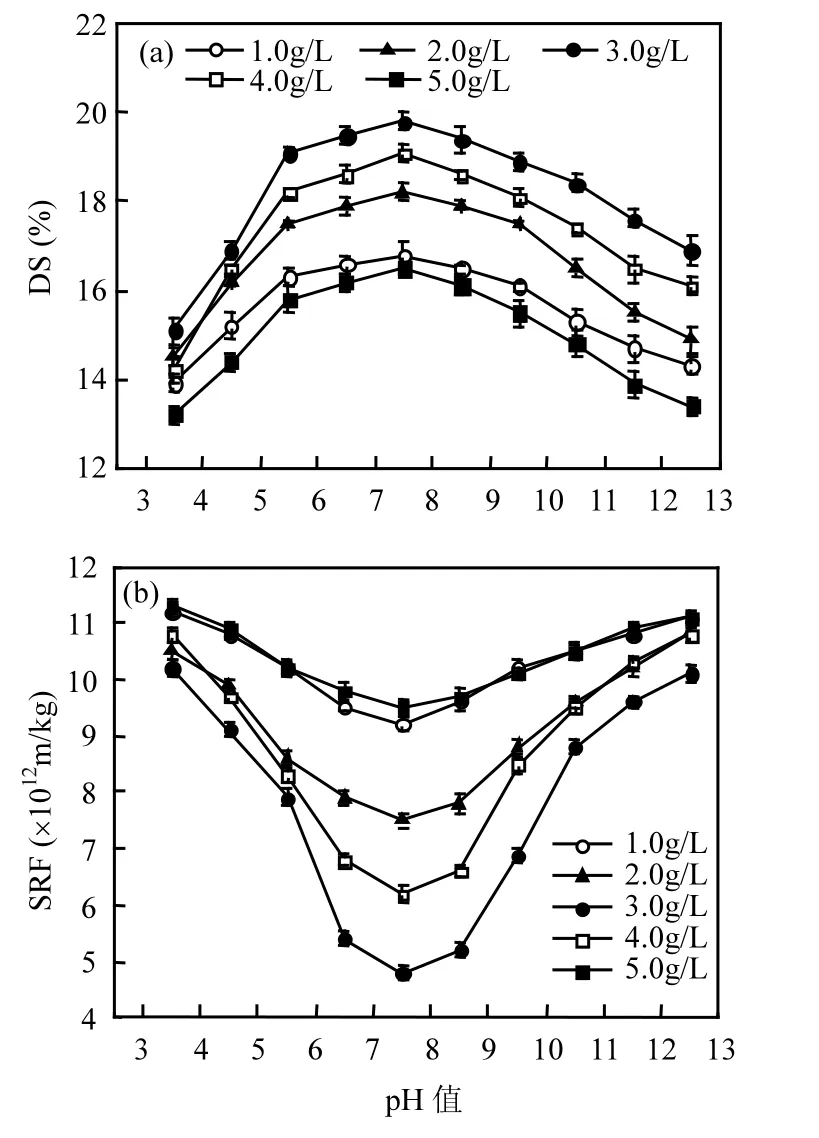
图3 不同pH条件下PAC投加量对污泥DS(a)和SRF(b)的影响Fig.3 Optimization studies performed for DS (a) and SRF (b) by PAC dose under different pH values
在实际工程中,从经济节约角度考虑,污泥脱水过程通常不进行pH的调节.由图2(a)可知,保持原污泥pH值,随着微生物絮凝剂投加量增加至12mg/L的过程中,污泥中DS含量增加到18% (较原污泥提高了59.5%),污泥比阻SRF相应降低到6.1×1012m/kg(较原污泥降低了53.6%),表明经过微生物絮凝剂絮凝处理,污泥的脱水性能得到显著改善.微生物絮凝剂本身具有吸附和降解的性能,且分子链上含有羟基、羧基等基团,这为污泥颗粒及污泥细胞中的有机物质提供了必要的“结合位点”和较强的范德华力,从而在污泥中形成紧凑的絮凝物质,更容易沉降,提高污泥的脱水效率[21].然而,过量的微生物絮凝剂反而会降低污泥的脱水效率,这是因为:围绕在絮凝剂周围的污泥颗粒被快速絮凝沉降,当絮凝剂与污泥颗粒的作用位点达到饱和后,
过量絮凝剂高分子会使得部分已形成絮体的颗粒变得松散,进而达到一种新的相互排斥的电荷平衡,污泥脱水效果明显下降[22].由图 2(b)可知,投加0~12mg/L絮凝剂时,污泥Zeta电位绝对值迅速减小;继续投加微生物絮凝剂至 18mg/L, Zeta电位绝对值继续减小,但减小趋势变缓,也没有出现电位相反的现象.Zeta电位绝对值的减小,是由于微生物絮凝剂降低了污泥颗粒之间的静电排斥力,压缩了絮体颗粒的双电层,促进原本松散的污泥颗粒形成更大更稳定的絮团,从而改善了沉降效果[23].
2.4 PAC对污泥脱水性能的影响
由图 3可知,pH=5.5~9.5范围内,经过投加PAC调理后,DS值均高于原污泥的 13.2%,SRF值均低于原污泥的11.3×1012m/kg,说明PAC对污泥脱水有着明显的改善.以pH=7.5为例,当PAC投加量为 3g/L时,污泥 DS和 SRF分别达到18.4%和4.8×1012m/kg;保持原污泥pH值,当PAC投加量为 3g/L时,污泥 DS和 SRF分别达到16.4%和 5.4×1012m/kg.随着 PAC的投加量继续增加,DS值反而有降低趋势,SRF值也出现升高趋势,体现为污泥脱水性能变差.由此可见,适量的PAC能够通过网捕作用聚集悬浮污泥颗粒,或通过改变污泥颗粒表面的电荷,从而促进污泥的沉降.由图3还可以得知,弱酸弱碱条件下,PAC对污泥的脱水效果最好,具体原因是:PAC在酸性条件下解离度较大,分子链更容易舒展,有利于污泥颗粒的絮凝沉降,但是若酸度较强,尤其是 pH<4时,污泥的胞外聚合物易溶解,不利于沉降.强碱性环境中(pH>10),PAC分子链卷曲,不利于污泥颗粒的絮凝沉降[9,22].
2.5 微生物絮凝剂与PAC复配对污泥脱水性能的影响
2.5.1 DS和 SRF为响应值的二次回归模型 以DS和SRF为响应值建立的二次回归模型分别如式(5)和(6)所示.
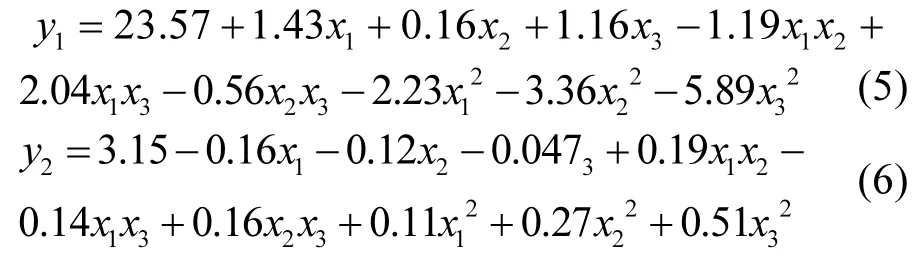
方差分析显示:F模型均大于 F0.01(20,29)= 2.57,Prob>F均小于 0.05,表明模型显著.决定系数R2分别为0.9545和0.9776,说明预测模型和实验数据之间形成良好的一致性.失拟项F-试验结果显示:失拟项概率(p)分别为0.0010、0.0057,说明模型能很好地与数据拟合,且分别仅有 0.10%和 0.57%的变量没有被模型所考虑到.精确度AP>4,表示所有的预测模型均在由中心复合设计所设定的空间范围内(表3)[24-25].
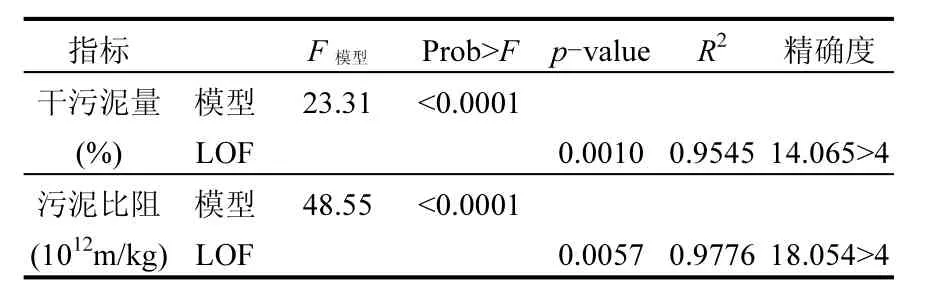
表3 方差分析Table 3 ANOVA results for the four responses
将以编码值为变量的DS和SRF二次模型系数进行显著性检验(P<0.05为显著)(表4),结果显示,一次项中显著因素均为pH值,这是由于pH值对污泥颗粒表面电荷和微生物絮凝剂的形态结构的影响,pH值在絮凝过程中的决定性作用已被本文作者以前的研究所证实[26].二次项中显著因素均为微生物絮凝剂和PAC量,过量的PAC会破坏稳定的胶体体系,从而降低污泥的沉降性能和脱水效率;适量的微生物絮凝剂能够通过吸附作用聚集悬浮污泥颗粒,或通过改变污泥颗粒表面的电荷,从而促进污泥的沉降[26].交互项中,对于DS,微生物絮凝剂与pH值具有显著性;对于SRF,微生物絮凝剂与PAC量、微生物絮凝剂与pH值具有显著性.
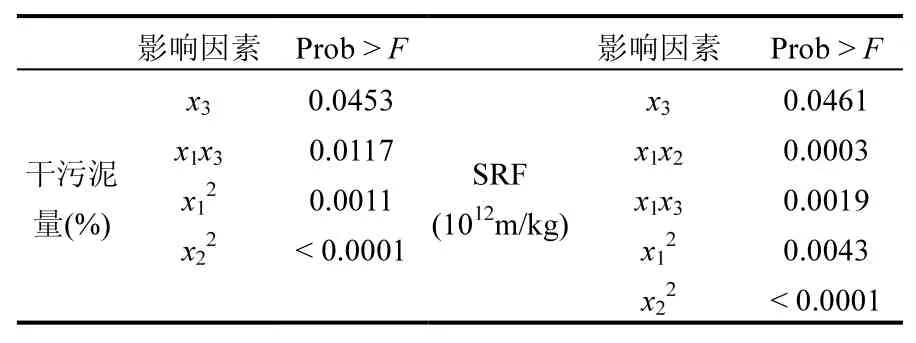
表4 显著性分析Table 4 Significance of quadratic model coefficient of for the four responses
图4(a)反映了PAC处于中心水平时,微生物絮凝剂与pH值交互作用对DS的影响,图像明显反应出絮凝作用的实现对于偏中性环境的依赖.图4(b)反映了PAC用量处于中心水平时,微生物絮凝剂与pH值交互作用对SRF的影响,图像表明在偏中性环境中,悬浮污泥更容易被微生物絮凝剂聚合成为大颗粒絮凝物,有助于污泥脱水.图4(c)曲面的变化趋势和底部等高线的密集程度可以看出,pH处于中心水平且微生物絮凝剂为较低水平时,随着PAC用量的增加,SRF先明显减小后稍稍增大,说明PAC过高或者过低都不利于污泥含水率降低;PAC水平较低时,SRF随微生物絮凝剂的增加而减小的速率,比高PAC用量情况下更大;微生物絮凝剂较高水平时,随着 PAC的增加,SRF的变化幅度较小,即对污泥脱水性能的影响甚微.由此可见,PAC存在条件下,适量的微生物絮凝剂能够大幅提高污泥的脱水效率.究其原因,一方面,微生物絮凝剂的絮凝作用提高了污泥颗粒密度,明显促进了污泥沉降;另一方面,PAC用量的增加扩大了粒径相对较小的絮体在整个絮体粒径分布的宽度,从而导致SRF减小,即污泥脱水性能提高[26].
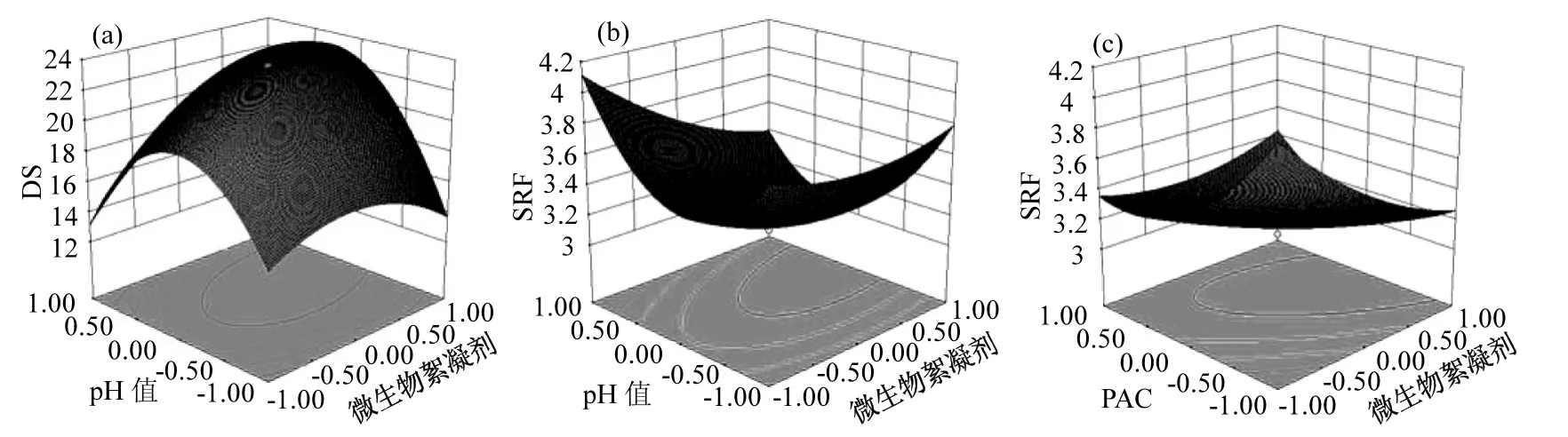
图4 微生物絮凝剂与pH对DS(a)和SRF(b)交互影响的响应面、微生物絮凝剂与PAC对SRF交互影响的响应面(c)Fig.4 Surface graphs of DS (a) and (b) showing variable effect of bioflocculant dose and solution pH, and surface graphs of SRF showing variable effect of bioflocculant and PAC doses (c)
2.5.2 微生物絮凝剂与PAC复配的最佳絮凝条件 本实验采用微生物絮凝剂与PAC复配的方法改善污泥脱水,并采用响应面分析法分析数据,对污泥脱水的过程进行优化,最优化条件是基于最理想的目标进行确定的.对本实验中的污泥沉降来说,最理想的目标是污泥脱水率为 100%,也就是说,经过微生物絮凝剂和 PAC复配处理后,污泥DS和SRF分别为100%和0,以此为目标,在设计空间中构造待测量的全局逼近,从而得到最佳絮凝条件的最优解.因此,设定DS和SRF的目标值分别为100%和0,借助Design-expert8.0.5软件,响应面分析法在设计空间(表1)中构造SRF和 DS的全局逼近,确定污泥脱水的最佳条件为微生物絮凝剂8.1mg/L、PAC 1.9g/L、pH值8.0.最佳絮凝条件下,相应DS和SRF分别为24.1%和 3.0×1012m/kg.污泥脱水的实际工程中,其 pH值一般不进行酸碱调节,因此,上述最佳条件中保持污泥pH=6.4时,相应DS和SRF分别为23.6%和 3.2×1012m/kg,均优于单独使用微生物絮凝剂或 PAC时的脱水效果(DS分别为 18.0%和16.4%,SRF分别为6.1×1012m/kg和5.4×1012m/kg).实验过程中发现,经过 PAC调理后的污泥,加入微生物絮凝剂所产生的絮体更加密实,具有更好的沉降性能不易再次泛起.
3 结论
3.1 本实验制备微生物絮凝剂的最佳发酵培养基的成分为:800mL蒸馏水、200mL酸解液、4g K2HPO4、2g KH2PO4、0.2g MgSO4、0.1g NaCl、2g尿素.所制备的微生物絮凝剂其产量和絮凝活性分别为0.96g/L和94.8%.
3.2 本实验制备的微生物絮凝剂能够明显改善污泥脱水性能,保持污泥原pH值,经12mg/L微生物絮凝剂处理后,干污泥含量较原污泥提高了
59.5%,污泥比阻较原污泥降低了53.6%.
3.3 微生物絮凝剂与 PAC复配处理污泥,对于污泥DS和SRF,具有显著影响的一次项为pH值,二次项为微生物絮凝剂和PAC量.
3.4 微生物絮凝剂与PAC复配处理污泥的最佳絮凝条件为:微生物絮凝剂 8.1mg/L、PAC 1.9g/ L、pH值8.0,最佳絮凝条件下,相应DS和SRF分别为24.1%和3.0×1012m/kg.保持原污泥pH值为 6.4时,相应 DS和 SRF分别为 23.6%和3.2×1012m/kg,均优于单独使用微生物絮凝剂或PAC时的脱水效果.
[1] 张 娜,尹 华,秦华明,等.微生物絮凝剂改善城市污水厂浓缩污泥脱水性能的研究 [J]. 环境工程学报, 2009,3:525-528.
[2] Liu W, Yuan H, Yang J, et al. Characterization of bioflocculants from biologically aerated filter backwashed sludge and its application in dying wastewater treatment [J]. Bioresour. Technol., 2009,100:2629-2632.
[3] Ahmad H, Rajab A, Azni I, et al. Production and characterization of a bioflocculant produced by Aspergillus flavus [J]. Bioresour. Technol., 2013,127:489-493.
[4] Pu S Y, Qin L L, Che J P, et al. Preparation and application of a novel bioflocculant by two strains of Rhizopus sp. using potato starch wastewater as nutrilite [J]. Bioresour. Technol., 2014,162:184-191.
[5] Guo J Y, Yang C P, Peng L Y. Preparation and characteristics of bacterial polymer using pre-treated sludge from swine wastewater treatment plant [J]. Bioresour. Technol., 2014,152:490-498.
[6] Yang Z H, Huang J, Zeng G M, et al. Optimization of flocculation conditions for kaolin suspension using the composite flocculant of MBFGA1and PAC by response surface methodology [J]. Bioresour. Technol., 2009,100:4233-4239.
[7] Guo J Y, Yang C P, Zeng G M. Treatment of swine wastewater using chemically modified zeolite and bioflocculant from activated sludge [J]. Bioresour. Technol., 2013,143:289-297.
[8] Wang L, Ma F, Lee D J, et al. Bioflocculants from hydrolysates of corn stover using isolated strain Ochrobactiumciceri W2 [J]. Bioresour. Technol., 2013,145:259-263.
[9] Guo J Y, Yu J, Xin X, et al. Characterization and flocculation mechanism of a bioflocculant from hydrolyzate of rice stover [J]. Bioresour. Technol., 2015,177:393-397.
[10] Guo J Y, Lau A K, Zhang Y Z, et al. Characterization and flocculation mechanism of a bioflocculant from potato starch wastewater [J]. Appl. Microbiol. Biotechnol., 2015,99:5855-5861.
[11] Nwodo U U, Agunbiade M O, Ezekiel G, et al. A freshwater Streptomyces, isolated from Tyume river, produces a predominantly extracellular glycoprotein bioflocculant [J]. Int. J. Mol. Sci., 2012,13:8679-8695.
[12] Zouboulis A I, Chai X L, Katsoyiannis I A. The application of bioflocculant for the removal of humic acids from stabilized landfill leachates [J]. J. Environ. Mana., 2004,70:35-41.
[13] Li Z, Zhong S, Lei H Y, et al. Production of a novel bioflocculant by Bacillus licheniformis X14and its application to low temperature drinking water treatment [J]. Bioresour. Technol., 2009,100:3650-3656.
[14] Giri S S, Harshiny M, Sen S S, et al. Production and characterization of a thermostable bioflocculant from Bacillus subtilis F9, isolated from wastewater sludge [J]. Ecotox. Environ. Safe., 2015,121:45-50.
[15] Subudhi S, Batta N, Pathak M, et al. Bioflocculant production and biosorption of zinc and lead by a novel bacterial species, Achromobacter sp. TERI-IASST N, isolated from oil refinery waste [J]. Chemosphere, 2014,113:116-124.
[16] Kavita K, Mishra A, Jha B. Extracellular polymeric substances from two biofilm forming Vibrio species: Characterization and applications [J]. Carbohydr Polym., 2013,94:882-888.
[17] Nie M, Yin X, Jia J, et al. Production of a novel bioflocculant MNXY1by Klebsiella pneumoniae strain NY1and application in precipitation of cyanobacteria and municipal wastewater treatment [J]. J. Appl. Microbiol., 2011,111:547-558.
[18] You Y, Ren N, Wang A, et al. Use waste fermenting liquor to produce bioflocculants with isolated strains [J]. Int. J. Hydrogen. Energy., 2008,33:3295-3301.
[19] Peng L Y, Yang C P, Zeng G M, et al. Characterization and application of bioflocculant prepared by Rhodococcus erythropolis using sludge and livestock wastewater as cheap culture media [J]. Appl. Microbiol. Biotechnol., 2014,98:6847-6858.
[20] Salehizadeh H, Yan N. Recent advances in extracellular biopolymer flocculants [J]. Biotechnol. Adv., 2014,32:1506-1522.
[21] Zhang Z Q, Xia S Q, Zhang J. Enhanced dewatering of waste sludge with microbial flocculant TJ-F1as a novel conditioner [J]. Water Res., 2010,44:3087-3092.
[22] Guo J Y, Nengzi L C, Zhao J, et al. Enhanced dewatering of sludge with the composite of bioflocculant MBFGA1and P(AM-DMC) as a conditioner [J]. App. Microbiol. Biotechnol., 2015,99:2989-2998.
[23] Gomes M P, Costa M. Determination of the critical concentration of partially hydrolyzed polyacrylamide by potentiometry in an acidic medium [J]. J. Appl. Polym. Sci., 2013,128:2167-2172.
[24] Liu X, Li X M, Yang Q, et al. Landfill leachate pretreatment by coagulation-flocculation process using iron-based coagulants:Optimization by response surface methodology [J]. Chem. Eng. J., 2012,200:39-51.
[25] Yang Q, Luo K, Liao D X, et al. A novel bioflocculant produced by Klebsiella sp. and its application to sludge dewatering [J]. Water Environ. J., 2012,26:560-566.
[26] Guo J Y, Zhang Y Z, Zhao J, et al. Characterization of a bioflocculant from potato starch wastewater and its application in sludge dewatering [J]. App. Microbiol. Biotechnol., 2015,99:5429-5437.
Production of a bioflocculant by using rice stover and its performance in the improvement of sludge dewatering.
GUO Jun-yuan∗, ZHAO Jing, FU Lin (College of Resources and Environment, Chengdu University of Information Technology, Chengdu, Chengdu 610225, China). China Environmental Science, 2016,36(11):3360~3367
A bioflocculant was produced by using rice stover, and its performance in the improvement of sludge dewatering was investigated, further, response surface methodology (RSM) was employed to optimize the treatment of sludge dewatering by the composite of the bioflocculant and Polyaluminum chloride (PAC). Optimal culture conditions for bioflocculant production were determined as 4g K2HPO4, 2g KH2PO4, 0.2g MgSO4, 0.1g NaCl, and 2g urea dissolved in a mixture of 800mL distilled water and 200mL rice stover acid hydrolyzate, and the corresponding bioflocculant yield reached 0.96g/L. Keep original pH value of the sludge, when bioflocculant dose was adjusted at 12mg/L, DS improved 59.5%, and SRF reduced 53.6%, which indicated that the sludge dewatering has been significantly improved after treated by the bioflocculant. In the same manner, when the sludge was treated by 3g/L PAC, DS increased to 16.4% and SRF decreased to 5.4×1012m/kg, compared to that of 13.2% and 11.3×1012m/kg of the original sludge, the sludge dewatering was significantly improved. Optimal conditions for sludge dewatering by the composite of the bioflocculant and PAC were bioflocculant dose of 8mg/L, PAC dose of 1.9g/L, and pH=8.0, under this optimal condition, DS and SRF appeared as 24.1% and 3.0×1012m/kg, respectively. From a practical standpoint, without pH adjustment, under the optimal condition of bioflocculant dose of 8.1mg/L, PAC dose of 1.9g/L, and natural pH value of 6.4, DS and SRF were 23.6% and 3.2×1012m/kg, respectively. The above results were better than the alone using of bioflocculant or PAC in sludge dewatering.
bioflocculant;polyaluminum chloride (PAC);sludge dewatering;response surface methodology (RSM)
X703.1
A
1000-6923(2016)11-3360-08
郭俊元(1985-),男,山西忻州人,讲师,主要从事环境微生物技术与废水资源化处理技术研究.发表论文10余篇.
2016-03-11
国家自然科学基金(51508043);四川省科技计划项目(2016JY0015);成都市科技局科技惠民技术研发项目(2015-HM01-00149-SF);成都信息工程大学中青年学术带头人科研人才基金资助(J201515)
* 责任作者, 讲师, gjy@cuit.edu.cn
