Li+在高岭土上的吸附行为研究
2018-07-10李彦岗赵仲鹤
赵 静, 李彦岗, 赵仲鹤
(1. 山西职业技术学院 材料工程系, 山西 太原 030006; 2. 中国日用化学工业研究院, 山西 太原 030001)
盐湖生产钾肥的过程中, 成分以高岭土为主的矿泥[1]是造成锂离子等有价元素在氯化钾提取过程中流失的主要因素, 因此, 研究Li+在高岭土上的吸附行为对提高盐湖卤水提锂的实际生产具有一定的指导意义. 高岭土是天然环境中普遍存在的一种黏土矿物, 目前, 金属离子如Th(Ⅳ), U(Ⅵ), Cd(Ⅱ), Cu(Ⅱ), Ni(Ⅱ), Pb(Ⅱ), Zn(Ⅱ), Ca(Ⅱ)等在高岭土上吸附行为的研究较多[2-5], 而关于Li+在高岭土上的吸附行为却鲜有报道. 李霞[6]等人研究了酸改高岭土吸附盐湖卤水中锂的最佳高岭土用量、 pH、 吸附温度和吸附时间, 发现高岭土应用于卤水提锂的效果良好. 因此, 本文在分析了高岭土结构的基础上, 研究吸附时间、 吸附温度、 高岭土添加量、 锂离子初始浓度对Li+在高岭土上吸附行为的影响, 并分析吸附动力学和热力学, 以期减少氯化钾生产过程中高岭土对锂的吸附.
1 材料和方法
1.1 化学试剂
无水氯化锂(LiCl), 分析纯; 高岭土 (Al2O3·2SiO2·2H2O), 分析纯.
1.2 实验仪器
SHB-III型循环水式多用真空泵, 上海华岩仪器设备有限公司; BSA124S-CW电子分析天平, 赛多利斯公司; WG/H-71B 鼓风恒温两用干燥箱, 成都一科仪器设备有限公司; HJ-M6磁力搅拌恒温水浴锅, 金坛市城西春兰实验仪器厂; AZEEnit 700P原子吸收光谱仪, 德国耶拿分析仪器股份公司; SU8010冷场发射扫描电子显微镜, 日本Hitachi.
1.3 Li+含量的测定
1.3.1标准锂离子浓度(g·L-1)~吸光度曲线
配制一系列不同浓度的含锂离子水溶液 100 mL, 使锂离子浓度为0.10~10 mg/L, 用原子吸收光谱仪在482 nm的波长下测定锂离子溶液的吸光度, 做出标准Li+浓度(mg·L-1)~吸光度曲线, 如图 1 所示.
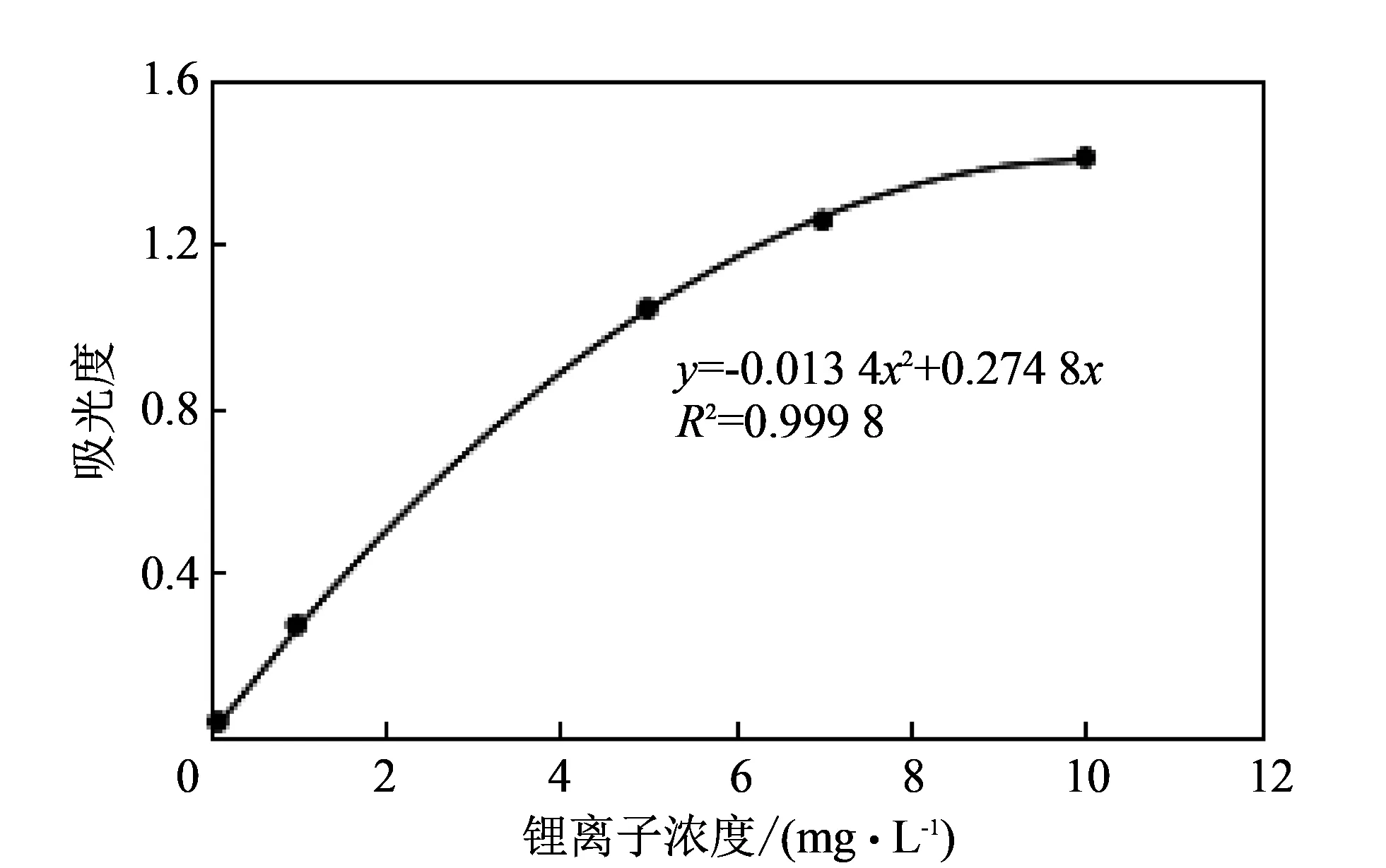
图 1 标准锂离子浓度(g·L-1)~吸光度曲线Fig.1 Standard lithium ion concentration(g·L-1)~absorbance curve
1.3.2溶液中Li+浓度的测定
将待测定的Li+溶液用去离子水稀释10倍后, 用原子吸收光谱仪测定其中Li+的吸光度, 根据标准曲线的拟合
y=-0.0134x2+0.274 8x,
(1)
可计算出溶液中Li+的浓度. 吸附量的计算
(2)
平衡吸附量的计算
(3)
式中:qt为t时刻时每克高岭土吸附Li+(以mg计)的量, 单位mg/g;qe为吸附达到平衡时的吸附量, 即平衡吸附量, 单位mg/g;c0为溶液中Li+的初始浓度, 单位mg/L;ce为溶液中Li+的平衡浓度, 单位mg/L;ct为t时刻时溶液中Li+的浓度, 单位mg/L;V为溶液的体积, 单位L;m为高岭土添加的量, 单位g/L.
1.4 Li+在高岭土上的吸附实验
用去离子水配制一定Li+浓度的LiCl溶液, 置于锥形瓶中, 加入一定量的高岭土, 在指定的恒温下, 以200 r/min匀速搅拌, 使高岭土在一定时间内吸附溶液中的Li+. 吸附完成后, 将混合液常压分离, 用原子吸收光谱仪测量溶液中Li+的吸光度, 根据式(1)~式(3)计算qt,qe.
2 实验结果及讨论
2.1 高岭土的SEM表征
用扫描电子显微镜(SEM)分析高岭土的微观结构, 结果如图 2 所示. 从图2中可以观察到, 高岭土的结构比较粗大, 为不规则的层片状集合, 有比较大的间隙.

图 2 高岭土的SEM表征图Fig.2 SEM representation of kaolin
2.2 高岭土添加量对Li+在高岭土上吸附的影响
取6份Li+浓度为8.186 mg/L的LiCl溶液250 mL, 分别加入0.250, 0.500, 0.750, 1.000, 1.250, 1.500 g的高岭土, 使高岭土的添加量分别为1, 2, 3, 4, 5, 6 g/L. 293 K下恒温搅拌 30 min 后, 测定Li+在高岭土上的吸附量qt, 结果如图 3 所示.
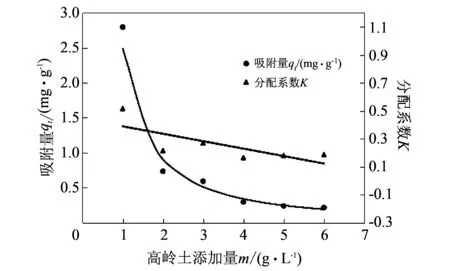
图 3 高岭土添加量对Li+在高岭土上吸附的影响Fig.3 Effect of the addition of kaolin on Li+ adsorption onto kaolin
由图 3 可知, 当高岭土添加量m由1 g/L增大至3 g/L时, Li+在高岭土上的吸附量qt由 2.795 mg/g 降低至0.593 mg/g; 当m由4 mg/L增大至6 mg/g时,qt由0.295 mg/g降低至0.217 mg/g, 降低量很小. 这可能是由于高岭土浓度越大, 越容易发生团聚, 接触Li+的表面积减小, 从而使qt降低[7]. 分配系数K(无单位)在一定程度上代表吸附剂吸附能力的大小, 从图 3 可知, 吸附剂高岭土用量m的增大, 使得高岭土对Li+的吸附能力降低[8].
2.3 接触时间对Li+在高岭土上吸附的影响
取8份Li+浓度为8.186 mg/L的LiCl溶液250 mL, 加入1 g高岭土, 在恒定温度293 K下, 分别测定吸附时间为10, 20, 30, 40, 50, 60, 90, 120 min时, Li+在高岭土上的吸附量qt, 结果如
图 4 所示.
由图 4 可知, 吸附时间t为10 min时,qt达到0.714 mg/g, 为过饱和状态; 当t由10 min增大至30 min时,qt降低至0.599 mg/g, 说明此时间段内发生解吸; 当t由30 min增大至120 min时,qt在很小的范围内上下波动. 由于吸附行为是一个动态平衡过程, 所以本研究认为吸附时间为 30 min 时, Li+在高岭土上的吸附达到平衡.
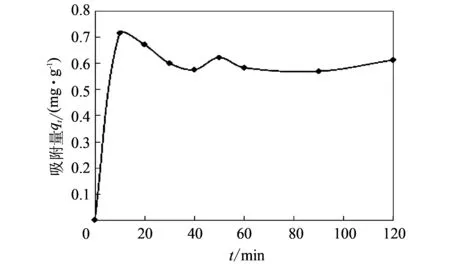
图 4 吸附时间对Li+在高岭土上吸附的影响Fig.4 Effect of contact time on Li+ adsorption onto kaolin
2.4 Li+在高岭土上的吸附动力学模型
Li+在高岭土上的吸附可采用准一级和准二级动力学模型来描述[9], 以动力学理论为基础来讨论Li+在高岭土上的吸附行为.
准一级动力学线性模型
ln(qe-qt)-lnqe-k1t.
(4)
准二级动力学线性模型
(5)
式中:k1为准一级动力学的吸附速率常数, 单位h-1;k2为准二级动力学的吸附速率常数, 单位g/(mg·h).
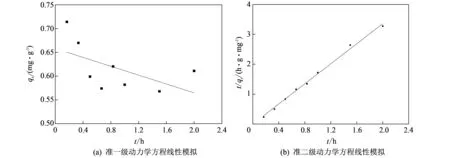
图 5 Li+在高岭土上吸附的准一级动力学和准二级动力学Fig.5 The quasi-first-order kinetics and quasi-second-order kinetics of Li+ adsorption onto kaolin
从图 5拟合结果可知, 准二级动力学方程比准一级动力学方程能更好地描述Li+在高岭土上的吸附行为. 根据模拟直线可得: 平衡吸附量qe=0.5954 mg/g, 准二级动力学的吸附速率常数k2=7.8912 g/(mg·h), 相关系数R2=99.47%. 这说明该吸附过程中层片状的高岭土表面均匀, 为单分子层吸附, 可利用Li+在高岭土上的化学反应作为吸附控制步骤[10].
2.5 Li+初始浓度对Li+在高岭土上吸附的影响
分别配制Li+浓度为1.672, 3.270, 5.271, 6.550, 8.186, 11.618, 16.65 mg/L的LiCl溶液250 mL各3份, 置于500 mL的烧杯中, 各加入 1 g 高岭土, 分别在293, 303, 323 K的恒温下搅拌吸附30 min后, 测定Li+在高岭土上的qt, 结果如图 6 所示.
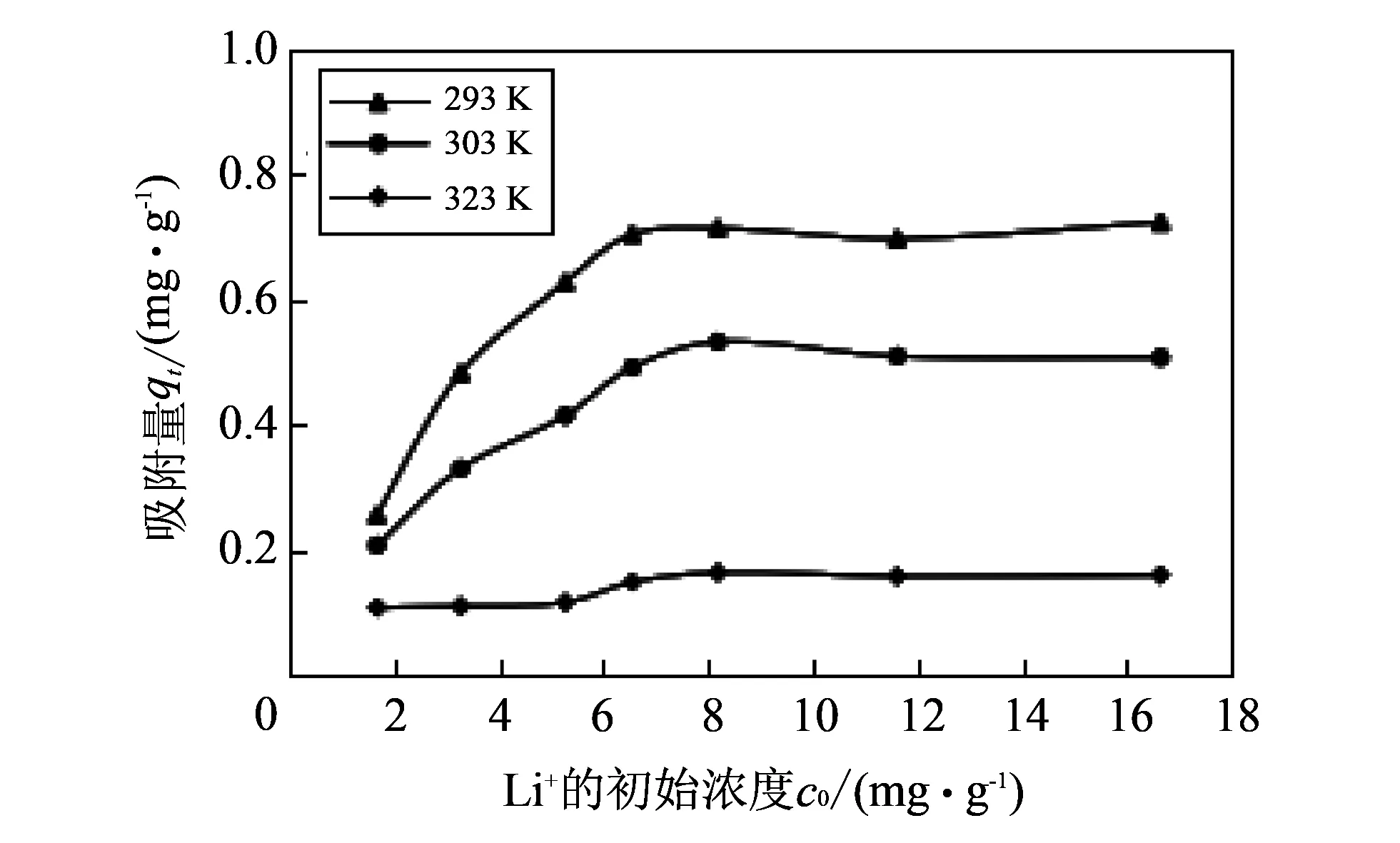
图 6 初始浓度对Li+在高岭土上吸附的影响Fig.6 Effect of initial concentration on Li+ adsorption onto kaolin
从图 6 中可知, 在293, 303, 323 K三个温度下, 当c0由1.672 mg/L增大至6.550 mg/L时, Li+在高岭土上的qt都随着c0的增大而增大, 当
c0由8.186 mg/L增大至16.65 mg/L时,qt变化很小, 达到吸附平衡状态. 这是因为随着初始浓度的增加, Li+对高岭土吸附位点的竞争增强, 吸附量增大直至吸附饱和, 即达到吸附平衡. 在c0相同时, Li+在高岭土上吸附的qt随着温度的增加反而下降, 可推导出高温不利于Li+在高岭土上的吸附行为.
2.6 Li+在高岭土上吸附的等温吸附线
用吸附等温线可以判断Li+在高岭土上吸附的本质. 本文采用Langmuir和Freundlich等温吸附模型来进一步研究Li+在高岭土上的吸附行为[11-13].
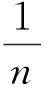
从图 7 可知, Li+在高岭土上的吸附行为用Freundlich等温吸附方程线性拟合较差,R2值均在0.9以下, 而Langmuir等温吸附方程线性拟合较好,R2均达到0.98以上. 从图7(a)可知, 随着温度的升高, 吸附等温线的高度不断升高, 即ce/qe值增大, 进而可推测出高温不利于吸附反应的进行; 三个温度下,ce/qe值均随ce的增大而增大, 说明Li+在固相中的分布增速没有液相中快[14].
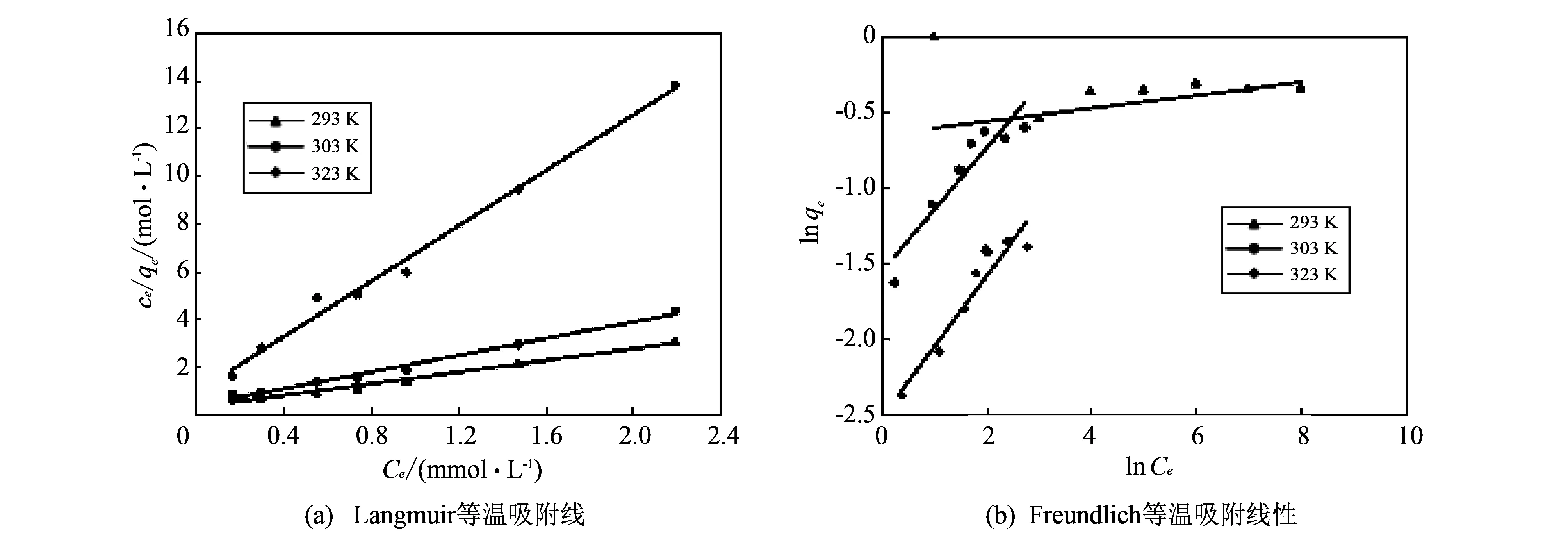
图 7 Li+在高岭土上吸附的等温吸附线Fig.7 Isothermal adsorption line of Li+ adsorption onto kaolin
为了进一步了解Li+在高岭土上吸附的热力学性质, 需要确定其焓变ΔH0, 熵变ΔS0, Gibbs自由能ΔG0等热力学参数. Li+在高岭土上吸附的热力学函数由式(6)和(7)计算[14].
ΔG0=-RTlnK, ΔG0=ΔH0-TΔS0,
(6)
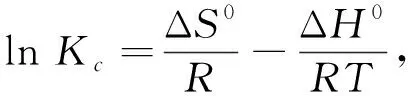
(7)
式中:R为理想气体常数;T为吸附反应温度. 计算结果如表 1 所示.

表 1 Li+在高岭土上吸附的热力学参数Tab.1 Thermodynamic parameter of Li+ adsorption onto kaolin
由表 1 中数据可以看出, 在293, 303, 323 K三个温度下, Li+在高岭土上吸附的ΔG0均为正值, 可推测出此反应条件下吸附不是自发进行的; ΔS0小于零, 说明此反应为熵减反应; ΔH0值均小于零, 说明该吸附反应均为放热反应[15-16], 与吸附等温模型拟合结果一致.
3 结 论
1) Li+在高岭土上吸附的吸附量随着高岭土用量的增大而降低, 当高岭土用量增大到一定程度时, 吸附量下降幅度变小.
2) 吸附时间为30 min时, Li+在高岭土上的吸附量达到平衡. 用准一级和准二级动力学模型模拟后发现, Li+在高岭土上的吸附行为符合准二级动力学模型, 以Li+在高岭土上的化学反应为吸附控制步骤.
3) 在273, 303, 323 K三个温度下, 当Li+浓度增大时, Li+在高岭土上的qt先增大, 然后变化很小; 在相同Li+初始浓度下, Li+在高岭土上的qt随着温度的增加反而下降. 用Freundlich和Langmuir等温吸附模型拟合后发现, Li+在高岭土上的吸附行为更符合Langmuir等温吸附模型. 热力学函数计算结果可推测出, Li+在高岭土上的吸附行为不是自发进行的, 且均为放热反应.
