盐酸头孢吡肟与胃蛋白酶相互作用的光谱研究
2016-12-19李晓玲王红艳朱盖山
李晓玲,王红艳,瞿 伟,朱盖山,刘 超
宿州学院化学化工学院,安徽宿州,234000
盐酸头孢吡肟与胃蛋白酶相互作用的光谱研究
李晓玲,王红艳,瞿 伟,朱盖山,刘 超
宿州学院化学化工学院,安徽宿州,234000
采用荧光光谱法、紫外吸收光谱法研究了生理酸度条件下盐酸头孢吡肟(cefepime hydrochloride )与胃蛋白酶(pepsin)之间的相互作用,结果表明盐酸头孢吡肟对胃蛋白酶具有强烈的猝灭作用。用Stern-Volmer方程处理实验数据,发现盐酸头孢吡肟对胃蛋白酶的荧光猝灭过程主要由荧光猝灭体系完成的,且为静态猝灭。并计算出了不同温度下的猝灭常数、结合常数、结合位点数和相关的热力学参数,结果表明盐酸头孢吡肟与胃蛋白酶之间的作用力主要是氢键和范德华力,且ΔG<0,同时证实它们之间的作用是自发进行的。按照Forster非辐射能量转移机理,盐酸头孢吡肟与胃蛋白酶结合时给体-受体之间的距离r=1.380 nm。
盐酸头孢吡肟;胃蛋白酶;荧光猝灭;自发
蛋白质在生命中充当着非常重要的角色[1],它不仅是人体主要的营养物质,可以促进人体组织的生长、更新和修复,而且可以承担着各种重要的生理功能等[2]。盐酸头孢吡肟属于头孢类抗生素[3],它的工人合成已取得重大的进展[4],目前已用于多种细菌感染疾病的治疗[5-7]。盐酸头孢吡肟属于电中性的两性离子,具有良好的水溶性,对β-内酰胺酶亲和力较低[8],抗菌稳定性较强[9]。 同时病人用药后,不影响心电图、心率和血压以及肠蠕动,也不改变红细胞脆性和凝血参数[10]。
胃蛋白酶被定义为消化性蛋白酶[11],由胃粘膜主细胞分泌,主要作用是分解蛋白质为小的肽片段让机体更容易吸收。盐酸头孢吡肟具有激活胃蛋白质酶原[12],为胃蛋白酶提供酸性环境,帮助人体消化等功能。本文采用荧光光谱、紫外吸收光谱研究胃蛋白酶和盐酸头孢吡肟之间的相互作用,旨为盐酸头孢吡肟的药理学研究提供参考依据。
1 实验部分
1.1 实验仪器与药品
仪器:U-3310紫外可见分光光度计(日本日立公司);F-4500荧光分光光度计(日立高新技术公司);HH-1恒温水浴锅(上海启前电子科技有限公司);pHS-23型精密PH计(上海尚阔有限公司);分析天平(常州市天之平仪器设备有限公司)。
药品:盐酸头孢吡肟(齐鲁制药有限公司),使用时配制成浓度为2.0×10-4mol·L-1的溶液;胃蛋白酶(郑州奇华顿化工产品有限公司),使用时配制成浓度为2.0×10-4mol·L-1的溶液;BR缓冲溶液(pH=2.0)。
1.2 实验方法
取10支10 mL比色管,分别加入1.0 mL 2.0×10-4mol·L-1胃蛋白酶溶液和2.0 mL pH=2.0的BR缓冲液,再依次加入0、0.50、1.00、1.50、2.00、2.50、3.00、3.50、4.00、4.50 mL 2.0×10-4mol·L-1的盐酸头孢吡肟溶液,然后加水定容至10 mL,摇匀后放置20 min。分别记录293 K、298 K、310 K条件时,波长为300~450 nm范围内的荧光发射光谱(设定激发和发射狭缝均为5 nm,激发波长285 nm)。
2 实验结果与讨论
2.1 胃蛋白酶的荧光猝灭光谱
图1为胃蛋白酶和盐酸头孢吡肟发生荧光猝灭的光谱图。由图1(a)可知,在温度为293 K时,胃蛋白酶在350 nm处有荧光最大发射峰,荧光强度达到283.3;由图1(b)可知,在温度为298 K时,胃蛋白酶在350 nm处有荧光最大发射峰,荧光强度达到311.9;由图1(c)可知,在温度为310 K时,胃蛋白酶在350 nm处有荧光最大发射峰,荧光强度达到308.3。综合图1(a)、1(b)和1(c)可知,在同一温度下,当胃蛋白酶保持一定浓度时,随着盐酸头孢吡肟浓度的增加,荧光强度逐渐减弱,说明盐酸头孢吡肟与胃蛋白酶之间发生猝灭作用而发出内源荧光,生成一种新型的复合物。

图1 胃蛋白酶和盐酸头孢吡肟发生荧光猝灭光谱图
2.2 荧光猝灭机理
动态猝灭与静态猝灭均属于荧光猝灭[13]。在动态猝灭过程中,猝灭常数随着温度的升高而增大。在静态猝灭过程中,猝灭常数随着温度的升高而减小。为了研究盐酸头孢吡肟和胃蛋白酶的猝灭类型,运用Stern-Volmer方程[14]处理实验数据,以便作出准确判断
F0/F=1+Kq0[Q]=1+KSV[Q]
(1)
式中,F0为不加盐酸头孢吡肟情况下系统中荧光强度的值,F为加入盐酸头孢吡肟情况下系统中荧光强度的值,KSV为猝灭常数,[Q]为盐酸头孢吡肟浓度,Kq为动态猝灭常数,τ0(10-8s-1)为胃蛋白酶的平均荧光寿命。实验中,分别在293、298和310 K条件,用F0/F对[Q]作图,如图2所示。

图2 盐酸头孢吡肟-胃蛋白酶体系中F0/F对[Q]所作的线性关系图
由图2可知,固定浓度梯度的盐酸头孢吡肟与胃蛋白酶相互反应的Stern-Volmer曲线在一定温度下表现出一定的线性关系。Stern-Volmer为猝灭常数,Ksv是直线斜率。由猝灭常数公式Ksv=Kqτ0可以得到Kq=Κsv/τ0,从而求出猝灭过程中速率常数Kq的值。实验数据列于表1中,由表1可知,猝灭常数Ksv的大小随温度的升高而逐渐降低,因为速率常数Kq值要远远大于最大扩散碰撞速率常数的值(2.0×1010L·mol-1·s-1),由此可以推出盐酸头孢吡肟对胃蛋白酶的猝灭类型为静态猝灭。

表1 不同温度下盐酸头孢吡肟与胃蛋白酶相互作用的猝灭常数
2.3 盐酸头孢吡肟与胃蛋白酶结合常数与结合位点数的测定
运用(2)式可以计算出静态猝灭过程中盐酸头孢吡肟与胃蛋白酶之间作用的结合常数Ka。
(2)
式中,n是结合位点数,Ka为盐酸头孢吡肟与胃蛋白酶的结合常数[15]。以log[(F0-F/F)]为Y轴,以log[Q]为X轴作log[(F0-F/F)]对log[Q]的直线图,如图3所示。由图3可知,结合常数n和结合位点数Ka的值,即运用(2)式可求出盐酸头孢吡肟与胃蛋白酶系统在不同温度下的Ka与n值。
根据图3并结合常数公式可以看出,通过直线截距可以得到盐酸头孢吡肟与胃蛋白酶之间的结合常数Ka,由直线的斜率可得出盐酸头孢吡肟与胃蛋白酶的结合位点数n。在293、298、310K三个温度下所得的结合常数、结合位点数和热力学参数见表2。由表2可以看出,温度逐渐升高,Ka的值逐渐减小,即温度提高,盐酸头孢吡肟与胃蛋白酶结合的作用力减弱;盐酸头孢吡肟与胃蛋白酶作用时,结合位点数为1个。同时还可以看出,盐酸头孢吡肟与胃蛋白酶间结合位点数n是下降的,这也说明随着温度的提高,盐酸头孢吡肟与胃蛋白酶间的结合能力减弱。由此可以证明盐酸头孢吡肟与胃蛋白酶之间的猝灭类型是静态猝灭。

图3 log[(F0-F/F)]对log[Q]所作的线性图
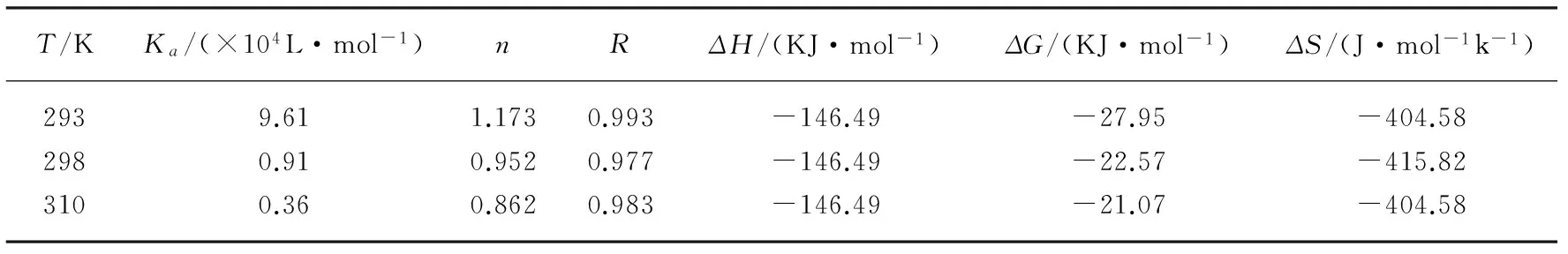
表2 盐酸头孢吡肟和胃蛋白酶在不同温度下的结合常数、结合位点数和热力学参数
2.4 反应热力学参数计算与作用力类型的判定
在一定的温度条件下,一个化学反应的焓变ΔH可以看作是一个常数,并由下式(3)算出它的值,吉布斯自由能变(ΔG)和熵变(ΔS)可由式(4)和(5)求得。
ln(K2/K1)=-ΔH/R(1/T2-1/T1)
(3)
lnK=-ΔH/(KT)+ΔS/R
(4)
ΔG=ΔH-TΔS
(5)
式中,R是摩尔气体常数,K是结合常数,求得的熵变ΔS、吉布斯自由能变ΔG、焓变ΔH见表2。结合作用力[16]和热力学参数之间关系(表3),根据热力学规律,ΔH<0、ΔS<0时,反应结合力类型为氢键和范德华力;ΔH≤0、ΔS>0 时,反应结合力类型是静电引力;ΔH>0、ΔS>0时,反应结合力类型是疏水作用力;根据表2,ΔG<0,表明盐酸头孢吡肟与胃蛋白酶的反应是一系列自发过程。在温度293、298与310 K时,盐酸头孢吡肟与胃蛋白酶反应中的ΔH<0,ΔS<0,故其间的作用力是氢键与范德华力。

表3 结合作用力和热力学参数之间的关系
2.5 结合位置计算
根据Forster转移理论[17],当供体的荧光光谱与受体的紫外光谱部分重叠时,说明受体和供体间产生了非辐射能量的转移[18],盐酸头孢吡肟与胃蛋白酶间的距离非常小,当最大距离R≤7nm时,说明盐酸头孢吡肟与胃蛋白酶之间产生了非辐射能量转移。
在温度为298K,pH=2.0时,盐酸头孢吡肟与胃蛋白酶的浓度均为2.0×10-5mol·L-1,在浓度比为1∶1的条件下,胃蛋白酶的荧光光谱和盐酸头孢吡肟的紫外-可见吸收光谱有一部分发生重叠,如图4所示。
2016-08-26
安徽省教育厅自然科学研究重点项目“含氮/氧芳香杂环后过渡金属配合物的组装及催化C-C、C-N键形成反应研究”(KJ2016A772);宿州学院一般科研项目“头孢类药物及纳米材料与蛋白质相互作用的研究”(2014yyb09)。
李晓玲(1980-),女,安徽宿州人,硕士,助教,主要研究方向:药物分析与化学分析。
10.3969/j.issn.1673-2006.2016.11.033
R285.0
A
1673-2006(2016)11-0124-04
