“建模思想”在解决化学问题中的应用
——以硝酸与金属反应的计算问题为例
2016-12-19安徽省灵璧中学张茹英
安徽省灵璧中学 汤 伟 张茹英
“建模思想”在解决化学问题中的应用
——以硝酸与金属反应的计算问题为例
安徽省灵璧中学 汤 伟 张茹英
硝酸属于化工生产中常见的三大强酸之一,也是中学化学中重点学习的强酸之一。其中硝酸与金属反应的计算问题,一直是许多同学学习化学过程中遇到的一个难点。下面我们借助建模思想,构建具体的思维模型,帮助大家巧解硝酸与金属反应的计算问题。
一、思维模型
一般情况下,对于硝酸与金属发生的氧化还原反应,我们要具体分析在该反应过程中硝酸所体现的具体性质,其具体模型如下:

二、模型详解
1.原子守恒
硝酸与金属反应时,一部分HNO3起酸的作用,以的形式存在于溶液中;一部分作为氧化剂转化为还原产物。这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量。
2.电子守恒
硝酸与金属的反应属于氧化还原反应,HNO3中氮原子得电子的物质的量等于金属失电子的物质的量。
3.电荷守恒
当硝酸过量时,对于反应后的溶液(不考虑OH-),有下列关系:
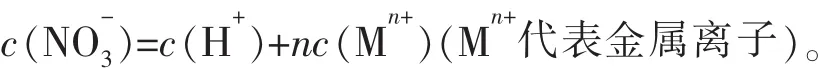
4.离子方程式计算
金属与H2SO4、HNO3的混合酸反应时,由于硝酸盐中在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应该用离子方程式来计算。我们可以先判断过量的物质是什么,然后根据完全反应的金属、H+或进行相关计算。
三、模型运用
例1 1.52 g铜镁合金完全溶解于50 mL密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况下),向反应后的溶液中加入1.0 mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )。
A.该合金中铜与镁的物质的量之比是2∶1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
解析 根据模型,硝酸与铜和镁反应时,一部分体现氧化性,生成还原产物NO2和N2O4;一部分体现酸性,生成Cu(NO3)2和Mg(NO3)2。反应后的溶液加入NaOH,又生成Mg(OH)2和Cu(OH)2沉淀。本题看似复杂,但利用守恒法能够轻松解题。
A项:向反应后的溶液中加入NaOH,生成Mg(OH)2和Cu(OH)2沉淀,比较前后的固体质量就可以发现,增加的质量来自OH-,且硝酸与金属反应时转移电子的物质的量n(e-)=n(OH-)。


例2 一定量的CuS和Cu2S的混合物投入足量的硝酸中,收集到的气体体积为V(标准状况下),向反应后的溶液中加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且二者的体积比为1∶1,则V可能为( )。
A.9.0 L B.13.5 L C.15.7 L D.16.8 L
解析 根据模型,还原产物有NO和NO2,而CuS和Cu2S被硝酸氧化成Cu2+和。反应过程复杂,很难写出反应方程式。为了简便计算,我们可以采用极端假设法。
转移电子数0.15×(6+2)=1.2(mol)。
由于混合气体中NO与NO2的体积相等,可设其中NO的物质的量为x,则NO2的物质的量也为x,
根据得失电子守恒,可得3x+x=1.2,解得x=0.3(mol),
所以混合气体的体积V=0.6 mol×22.4 L·mol-1=13.44 L。
假设投入的物质全是Cu2S,其物质的量为0.075 mol,
转移电子数0.075×10=0.75(mol)。
由于混合气体中NO与NO2的体积相等,设其中NO的物质的量为y,则NO2的物质的量也为y,
根据得失电子守恒,可得3y+y=0.75,解得y=0.1875(mol),
所以混合气体的体积V=0.375 mol×22.4 L·mol-1=8.4 L。
由于投入的物质是CuS和Cu2S的混合物,因此8.4 L<V<13.44 L,故A项正确。
故选A。
例3 有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4 mol·L-1和2 mol·L-1,取10 mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体体积为(设反应中HNO3被还原成NO)( )。
A.0.448 L B.0.672 L C.0.896 L D.0.224 L
解析 本题我们可以通过离子方程式计算。

反应中Fe和H+过量,生成NO的量以为准来计算,共得NO的体积为2 mol·L-1×10×10-3L× 22.4 L·mol-1=0.448 L。
我们若只考虑到这一步反应,得答案选A,则掉入了命题者设置的陷阱,因为过量的铁还可以和溶液中过量的H+反应产生H2。

这一步反应生成的H2为0.224 L,所以气体体积共计0.672 L。
故选B。
跟踪训练
在标准状况下将1.92 g铜粉投入一定量的浓硝酸中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混合气体1.12 L,则反应消耗HNO3的物质的量为( )。
A.0.8 mol B.0.6 mol C.0.11 mol D.无法计算
答案与提示 C ①被还原的硝酸的物质的量即为气体NO2与NO物质的量的总和,根据N原子守恒,②未被还原的HNO3的物质的量等于Cu(NO3)2中NO-3的物质的量,,③消耗的HNO3的物质的量为0.03 mol×2+0.05 mol=0.11 mol,故C项正确。
