高温胁迫对仿刺参抗氧化酶等指标的影响
2016-12-19谢兆文王寿昆陈美珍陈林柳卢海滨
谢兆文,王寿昆,林 旋,陈美珍,陈林柳,林 枫,卢海滨
( 1.福建农林大学 动物科学学院,福建省动物药物工程实验室,福建 福州 350002;2.福建省连江县官坞海洋开发有限公司,福建 连江 350511 )
高温胁迫对仿刺参抗氧化酶等指标的影响
谢兆文1,王寿昆1,林 旋1,陈美珍1,陈林柳1,林 枫2,卢海滨2
( 1.福建农林大学 动物科学学院,福建省动物药物工程实验室,福建 福州 350002;2.福建省连江县官坞海洋开发有限公司,福建 连江 350511 )
在15、18、21、24、27、30 ℃水温下,分别制备仿刺参福建连江群体和辽宁大连群体的体腔和内脏团提取液,测定超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶、乳酸脱氢酶、碱性磷酸酶活力及丙二醛含量。试验结果显示,仿刺参连江群体内脏团提取液超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶和乳酸脱氢酶活力最大时的水温比大连群体分别提高了3~9 ℃;高温(24、27、30 ℃)胁迫下,连江群体体腔和内脏团提取液超氧化物歧化酶、过氧化氢酶、乳酸脱氢酶活力均极显著高于大连群体 (P<0.01),其内脏团提取液谷胱甘肽过氧化物酶活力亦极显著高于大连群体(P<0.01),其体腔液谷胱甘肽过氧化物酶活力在24 ℃和30 ℃时极显著高于大连群体(P<0.01);仿刺参连江群体和大连群体体腔液碱性磷酸酶活性均在15 ℃时最大,内脏团提取液的碱性磷酸酶活性则均在18 ℃时最大;连江群体仿刺参体腔和内脏团提取液丙二醛含量在18~30 ℃下均显著低于大连群体(P<0.05,P<0.01)。研究表明,福建连江夏季高温驯化的仿刺参子二代群体,在高温胁迫试验中,其体腔和内脏团提取液中超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶、乳酸脱氢酶、碱性磷酸酶活力显著高于大连群体,丙二醛含量则显著低于大连群体,这些酶耐热性的提高,有利于仿刺参机体清除因高温胁迫产生多余的自由基,减少机体因高温胁迫造成的损害。
仿刺参;高温胁迫;超氧化物歧化酶;过氧化氢酶;谷胱甘肽过氧化物酶;乳酸脱氢酶;碱性磷酸酶;丙二醛
仿刺参(Apostichopusjaponicus)主要分布于西太平洋北部沿岸浅海,北起俄罗斯的符拉迪沃斯托克,经日本海、朝鲜半岛至我国渤海和黄海,江苏连云港外的平山岛是该物种在我国分布的南界[1-2]。
仿刺参作为一种珍贵的海味被列为“八珍”之一,具有高蛋白、低脂肪、低胆固醇的特质,是具有较高营养价值与保健功能的食物,深受广大消费者的青睐。随着人们生活水平的不断提高与消费观念的转变,对仿刺参的需求也不断攀升。
水温是仿刺参分布和养殖的最重要限制性生态因子。近年来,随着养殖规模的不断增大,海参养殖南移福建,安全度夏成为严重问题,高温胁迫等环境因子对仿刺参生理生态学的影响日益受到人们的关注[3]。仿刺参生存的水温为0~28 ℃[4],最适生长温度为15~18 ℃[5]。过高的水温会造成仿刺参体内自由基代谢紊乱与大量累积,从而使机体细胞和组织正常的生理机能及免疫防御能力受到损害,同时导致体内其他生理生化指标发生变化,进一步表明机体的受损程度[7]。温度过高或过低均会使仿刺参生长受到抑制,当温度超过仿刺参耐热上限时,仿刺参机体会出现复杂的生理反应从而导致热致死现象[5-8]。同时温度也影响仿刺参的摄食量及代谢率。Yang 等[9]研究发现,仿刺参在最适温度下摄食量最大,高温使仿刺参的摄食量显著下降。An 等[10]的研究表明,温度高于16 ℃时,仿刺参食物吸收率、转化率及特定生长率均会随温度升高而降低。
高温胁迫引起机体热应激,体内氧化代谢增加,过氧化物增加,膜系统损伤,甚至死亡。抗氧化酶系则可以起到清除过量超氧阴离子自由基,减少高温胁迫对机体造成的损伤。超氧化物歧化酶是一种重要的抗氧化蛋白酶,能够增强吞噬细胞的防御能力和机体的免疫功能[11],是生物体防御氧毒性的关键[12]。过氧化氢酶是无脊椎动物的一种重要抗氧化酶,它可以分解过氧化氢,防止氧代谢产物对机体的损伤,是测定机体免疫能力的常用指标。Dong 等[13]研究了在不同幅度的日变温处理下,仿刺参体内过氧化氢酶和超氧化物歧化酶活性变化情况。谷胱甘肽过氧化物酶在机体内普遍存在,其作用是催化机体内物质代谢或药物代谢过程中生成的过氧化物。乳酸脱氢酶作为与能量代谢相关的一种酶,它广泛存在于动物各组织细胞中,其活性变化也直接影响着能量的代谢[14]。碱性磷酸酶是巨噬细胞溶酶体酶的重要组成部分,在体内直接参与磷酸基团的转移和代谢,作为代谢调控酶在免疫反应中发挥重要作用[15]。丙二醛是氧自由基攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化反应产生的脂质过氧化物。因此,丙二醛的含量不仅可以反映生物机体内脂质过氧化反应的程度,还可以间接反映细胞损伤程度[16]。刘伟等[17]初步探讨了温度骤降和缓降对仿刺参体腔液中主要免疫酶的影响,另外也有青蛤(Cyclinasinensis)[18-19]、虾夷扇贝(Patinopectenyessoensis)[20]、贻贝(Mytilusgalloprovincialis)[21]等水生动物体内相关免疫酶活性与温度之间关系的研究。
本试验在高温胁迫下进行连江群体与大连群体仿刺参抗氧化酶及其他若干酶活性及丙二醛含量研究,通过抗氧化酶活力变化规律和丙二醛含量变化,为仿刺参机体在高温胁迫下的调节适应机制研究提供参考。
1 材料与方法
1.1 试验材料
仿刺参连江群体为福建省连江县经高温驯化的仿刺参子二代幼参,体质量(13.67±1.45) g,大连群体为大连的仿刺参幼参,体质量为(13.55±1.82) g。
1.2 试验设计
仿刺参连江群体和大连群体均分为6组;水温梯度为15、18、21、24、27、30 ℃,设3个平行组,其中15 ℃为对照组。所有仿刺参在相应温度海水中浸置2 h,取出,置于15 ℃海水中恢复1 h后提取仿刺参体腔液,制备内脏团提取液样本。
1.3 样本制备
1.3.1 样品采集
将经过温度胁迫恢复后的仿刺参取出后,用滤纸吸干仿刺参体表水分,置灭菌玻璃培养皿中,用解剖刀在仿刺参腹部切口1 cm ,立即用无菌注射器收集仿刺参体腔液(0.5~1 mL), 然后置于1.5 mL离心管中;用解剖剪沿腹面剪开,取其内脏团置于灭菌Eppendorf管中,迅速将采集样品放入液氮罐内而后转入冰箱-80 ℃保存,待制备样品。
1.3.2 样品处理
取仿刺参内脏团样品,称量质量,剪碎,冰浴研磨,加入预冷生理盐水制备10%组织匀浆,收集内脏团组织研磨液,4 ℃,2000 r/min离心20 min,取上清液分装待测。体腔液样品则先置于冰箱中4 ℃解冻,然后于4 ℃ 下500 r/min 离心10 min ,取上清液置于 Eppendorf管中,分装待测。
1.4 碱性磷酸酶等酶活性及丙二醛含量测定
以羟胺法测定总超氧化物歧化酶活性,以可见光比色法测定碱性磷酸酶和过氧化氢酶活性,以比色法测定乳酸脱氢酶和谷胱甘肽过氧化物酶活性,用硫代巴比妥酸法测定丙二醛含量。测定试剂盒均购自南京建成生物工程研究所。
各酶活力按下式计算:
总超氧化物歧化酶活力(U/mg)=总超氧化物歧化酶抑制率(%)/50%×反应体系稀释倍数(0.24 mL/0.02 mL)/待测样本蛋白质量浓度(mg/mL)
体腔液中过氧化氢酶活力(U/mL)=(ODCom-ODTem)×[(271×1)/(60s×取样量)]×样本测试前稀释倍数
组织中过氧化氢酶活力(U/mg)=(ODCom-ODTem)×[(271×1)/(60s×取样量)]/待测样本蛋白质量浓度(mg/mL)
体腔液中谷胱甘肽过氧化物酶活力(U/L)=( ODCom-ODTem)/(ODSta-ODNot)×标准管浓度×稀释倍数×样本测试前稀释倍数
组织中谷胱甘肽过氧化物酶活力(U/mg)=( ODCom-ODTem)/(ODSta-ODNot)×标准管质量浓度×稀释倍数/反应时间/(取样量×样本蛋白含量)
体腔液中丙二醛含量(nmol/mL)=(ODTem-ODCom)/(ODSta-ODNot)×标准品浓度(10 nmol/mL)×样本稀释倍数
组织中丙二醛含量(nmol/mg)= (ODTem-ODCom)/(ODSta-ODNot)×标准品浓度(10 nmol/mL)/待测样本蛋白质量浓度
体腔液中乳酸脱氢酶活性(U/L)=(ODTem-ODCom)/( ODSta-ODNot)×标准浓度×样本测试前稀释倍数×1000
组织中乳酸脱氢酶活性(U/g)=(ODTem-ODCom)/( ODSta-ODNot)×标准浓度/匀浆蛋白浓度
体腔液中碱性磷酸酶活力(U/L)=(ODTem/ODSta)×标准管含酚的量
组织中碱性磷酸酶活力(U/mg)=(ODTem/ODSta)×标准管含酚的量(0.003 mg)/[待测样本蛋白质量浓度(mg/mL)×取样量(0.03 mL)]
式中,ODTem为样本组吸光度,ODCom为对照组吸光度,ODSta为标准液吸光度,ODNot为空白组吸光度。
1.5 数据处理
将计算得到原始数据每个平行组3个数据求平均值和标准差,并用t检测分析相同水温下连江群体和大连群体各指标间的差异显著性。均用SPSS 17.0软件进行统计分析。
2 结果与分析
2.1 高温胁迫对仿刺参超氧化物歧化酶活力的影响
仿刺参连江群体和大连群体体腔液超氧化物歧化酶活力分别在24 ℃和15 ℃最大,分别为219.03 U/mg和184.21 U/mg;内脏团提取液的超氧化物歧化酶活力均在24 ℃最大,分别为328.94 U/mg和289.01 U/mg。在15~30 ℃每个试验水温下,仿刺参连江群体体腔液超氧化物歧化酶活力极显著高于大连群体 (P<0.01);其内脏团超氧化物歧化酶活力在15~27 ℃均极显著高于体腔液(P<0.01)。结果显示在正常水温和高温胁迫下,连江群体体腔和内脏团提取液超氧化物歧化酶活力普遍高于大连群体(图1)。
2.2 高温胁迫对仿刺参过氧化氢酶活力的影响
两群体体腔液和内脏团提取液过氧化氢酶活力均随水温呈先升后降趋势,高温胁迫时过氧化氢酶活力均比适温时极显著降低(P<0.01)。仿刺参连江群体和大连群体体腔液过氧化氢酶活力均在21 ℃时最大,分别达55.77 U/mL和44.66 U/mL;内脏团提取液的过氧化氢酶活力分别在24 ℃和21 ℃时最大,为85.57 U/mg和47.06 U/mg。仿刺参连江群体内脏团过氧化氢酶活力在15~30 ℃时,体腔液过氧化氢酶活力在15~27 ℃时均显著高于大连群体(P<0.05,P<0.01) (图2)。

图1 仿刺参体腔液与内脏团提取液超氧化物歧化酶活力

图2 仿刺参体腔液与内脏团提取液过氧化氢酶活力
2.3 高温胁迫对仿刺参谷胱甘肽过氧化物酶活性的影响
仿刺参连江群体和大连群体体腔液谷胱甘肽过氧化物酶活力分别在24 ℃和21 ℃时最大,活力单位分别为80.31 U/L和52.30 U/L;内脏团提取液的谷胱甘肽过氧化物酶活力分别在27 ℃和18 ℃时最大,活力单位分别为37.81 U/mg和18.40 U/mg。连江群体体腔液和内脏团提取液谷胱甘肽过氧化物酶活力最大时的温度均高于大连群体。仿刺参连江群体体腔液谷胱甘肽过氧化物酶活力在24 ℃和30 ℃时、内脏团提取液谷胱甘肽过氧化物酶活力在21~30 ℃时,均极显著高于大连群体(P<0.01)。在高温胁迫时,仿刺参连江群体内脏团提取液的谷胱甘肽过氧化物酶活力均显著高于大连群体(图3)。
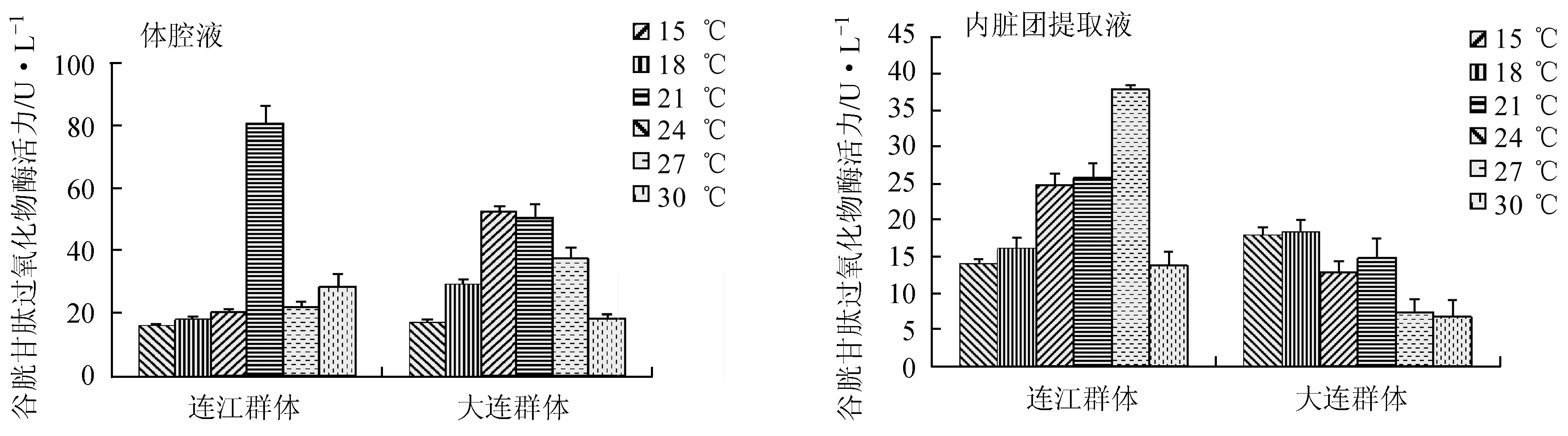
图3 仿刺参体腔液与内脏团提取液谷胱甘肽过氧化物酶活力
2.4 高温胁迫对仿刺参丙二醛含量的影响
仿刺参连江群体和大连群体体腔液丙二醛含量均在21 ℃时最大,分别为27.46 nmol/mL和39.90 nmol/mL;内脏团提取液丙二醛含量分别在15 ℃和27 ℃时最大,为44.49 nmol/mL和48.92 nmol/mL。在15 ℃时仿刺参连江群体与大连群体体腔液丙二醛含量差异不显著(P>0.05);在18~30 ℃时,仿刺参连江群体体腔液和内脏团提取液丙二醛含量均显著低于大连群体(P<0.01,P<0.05),在高温胁迫时,仿刺参连江群体的体腔液和内脏团提取液中丙二醛含量降低幅度更为显著(图4)。

图4 仿刺参体腔液与内脏团提取液丙二醛含量
2.5 高温胁迫对仿刺参乳酸脱氢酶活性的影响
仿刺参连江群体和大连群体体腔液乳酸脱氢酶活性分别在27 ℃和24 ℃时最大,为58.72 U/L和42.81 U/L;内脏团提取液的乳酸脱氢酶活性分别在24 ℃和18 ℃时最大,为0.0415 U/g和0.0424 U/g。在15、18、24、27 ℃时,仿刺参连江群体体腔液乳酸脱氢酶活性显著高于大连群体(P<0.05,P<0.01);连江群体内脏团提取液乳酸脱氢酶活性在24、27、30 ℃高温胁迫时,极显著高于大连群体(P<0.01);在15、18、21 ℃较低温度时,则极显著低于大连群体(P<0.01)(图5)。
2.6 高温胁迫对仿刺参碱性磷酸酶活力的影响
仿刺参连江和大连群体的体腔和内脏团提取液碱性磷酸酶活力在试验水温范围内,水温较低时碱性磷酸酶活力较高。仿刺参连江群体和大连群体的体腔液碱性磷酸酶活力均在15 ℃时最大,分别为21.06 U/L和13.49 U/L;内脏团提取液的碱性磷酸酶活力均在18 ℃时最大,分别为4.92 U/mg和4.14 U/mg。连江群体体腔液碱性磷酸酶活力在15、18 ℃和24 ℃下显著高于大连群体(P<0.05、P<0.01),在21 ℃和27 ℃时,与大连群体差异不显著(P>0.05) ,在30 ℃下则显著低于大连群体(P<0.05);连江群体内脏团提取液碱性磷酸酶活力在15、18 ℃和30 ℃下显著高于大连群体(P<0.05、P<0.01),在21、24 ℃和27 ℃时与大连群体差异不显著(P>0.05)。

图5 仿刺参体腔液与内脏团提取液乳酸脱氢酶活性

图6 仿刺参体腔液与内脏团提取液碱性磷酸酶活力
3 讨 论
在仿刺参抗氧化系统中,超氧化物歧化酶和过氧化氢酶是最早和最为重要的防御机制[21]。超氧化物歧化酶是第一个对抗氧自由基的抗氧化酶,参与清除体内超氧阴离子自由基,可以预防机体损伤和衰老;过氧化氢酶是生物体内过氧化物酶体系的标志酶,能够催化过氧化氢分解,防止膜脂过氧化[22]。本研究结果显示,两群体仿刺参的内脏团提取液中超氧化物歧化酶、过氧化氢酶活力均随水温的升高先升后降,高温胁迫时超氧化物歧化酶和过氧化氢酶活力均显著降低,这与Dong 等[13,23]的研究结果一致。说明在升温过程中,仿刺参能够通过提高超氧化物歧化酶和过氧化氢酶活力来清除多余的活性氧,与其他无脊椎动物中超氧化物歧化酶和过氧化氢酶活力随水温升高变化趋势具有一致性[22]。高温胁迫时,连江群体体腔液和内脏团提取液中超氧化物歧化酶和过氧化氢酶活力显著高于大连群体,在正常水温下,也多有此现象;连江群体体腔液的超氧化物歧化酶活力最大时的水温比大连群体高9 ℃,其内脏团提取液过氧化氢酶活力最大时的水温比大连群体高3 ℃。说明仿刺参在福建连江经高温驯化的子二代群体超氧化物歧化酶、过氧化氢酶活力和耐热性比北方的大连群体有显著提高。
谷胱甘肽过氧化物酶其功能为与超氧化物歧化酶、过氧化氢酶共同在细胞内对超氧离子及H2O2起还原作用[24]。它能催化谷胱甘肽转化为氧化型谷胱甘肽,使有毒的过氧化物还原成无毒的羟基化合物,从而保护细胞膜的结构及功能不受过氧化物的干扰及损害。因此谷胱甘肽过氧化物酶可作为细胞内抗脂质过氧化作用的酶保护系统的主要成分之一。在试验中,仿刺参连江群体的体腔液和内脏团提取液中谷胱甘肽过氧化物酶活力的最大值水温比大连群体分别高3 ℃和9 ℃;其内脏团提取液谷胱甘肽过氧化物酶活力不论在高温胁迫还是适温下均显著高于大连群体;说明仿刺参经过高温驯化的连江群体该酶活力指标的对高温耐受性亦高于大连群体。
丙二醛是细胞膜脂过氧化反应的重要产物,其含量体现了细胞膜被破坏的程度[16]。试验结果显示,连江群体内脏团提取液丙二醛含量约在15 ℃时达到最大值,高温胁迫时显著降低;大连群体约在27 ℃时达到最大值,与刘伟等[17]研究结果相似。连江群体体腔液和内脏团提取液丙二醛含量在18~30 ℃时,均显著低于大连群体,表明在升温过程中连江群体仿刺参的机体细胞受损程度小于大连群体仿刺参。
乳酸脱氢酶是一种糖酵解酶,能催化乳酸和丙酮相互转化生成乳酸[25]。乳酸脱氢酶作为与能量代谢相关的一种酶,它广泛存在于动物各组织细胞中,其活性变化也直接影响着能量的代谢[26]。在本试验中,仿刺参连江群体体腔液与内脏团提取液中乳酸脱氢酶活性最大值分别出现在27 ℃和24 ℃,大连仿刺参群体分别出现在24 ℃和18 ℃;连江群体体腔液和内脏团提取液的乳酸脱氢酶活性最大时的水温比大连群体高3 ℃和6 ℃,高温胁迫下连江群体体腔液和内脏团提取液乳酸脱氢酶活性显著高于大连群体。说明连江群体在这一生理指标的耐热性优于大连群体。
碱性磷酸酶作为动物代谢过程中重要的调控酶,广泛分布于人体及动物组织内,对动物的生存具有重要的意义[27-29]。试验显示,仿刺参连江和大连群体体腔液与内脏团提取液在水温较低时,碱性磷酸酶活力较高,随着水温升高,碱性磷酸酶活力快速下降。说明在仿刺参上该酶是适应较低水温的,高温胁迫则显著降低碱性磷酸酶活力。高温胁迫会影响机体的应激反应,降低仿刺参水解系统的活性,降低仿刺参的机体代谢水平,使仿刺参进入夏眠状态,减少高温胁迫对机体的损害。在30 ℃时,仿刺参连江群体体腔液及内脏团提取液中碱性磷酸酶活力显著低于大连群体(P<0.05),表明连江群体调节能力强于大连群体。
[1] 常亚青,隋锡林,李俊. 刺参增养殖业现状、存在问题与展望[J]. 水产科学, 2006,25(4):198-201.
[2] 廖玉麟.中国动物志,棘皮动物门,海参纲[M].北京:科学出版社,1997.
[3] 董晓亮,李成林,赵斌,等.低盐胁迫对刺参非特异性免疫酶活性及抗菌活力的影响[J].渔业科学进展,2013,34(3):82-87.
[4] 王国利.生态因子对刺参Apostichopusjaponicus生长与行为的影响[D].济南:山东师范大学,2007.
[5] 于东祥, 宋本祥. 池塘养殖刺参幼参的成活率变化和生长特点[J]. 中国水产科学, 1999,6(3):109-110.
[6] 林承刚. 四种物理环境因素对刺参运动和摄食行为的影响[D].青岛:中国科学院研究生院海洋研究所,2014.
[7] 于明志,常亚青. 低温对不同群体仿刺参幼参某些生理现象的影响[J]. 大连水产学院学报,2008,23(1):31-36.
[8] Hochachka P W, Somero G N. Biochemical Adaptation: Mechanism and Process in Physiological Evolution [M]. New York:Oxford University Press,2002.
[9] Yang H S, Yuan X T, Zhou Y, et al. Effects of body size and water temperature on food consumption and growth in the sea cucumberApostichopusjaponicus(Selenka) with special reference to aestivation[J].Aquaculture Research, 2005,36(11):1085-1092.
[10] An Z H, Dong Y W, Dong S L. A high-performance temperature control scheme: growth of sea cucumberApostichopusjaponicusat different modes of diel temperature fluctuation [J]. Aquaculture International, 2009,17(4):459-467.
[11] 牟海津,江晓路,刘树青,等.免疫多糖对栉孔扇贝酸性磷酸酶、碱性磷酸酶和超氧化物歧化酶活性的影响[J].青岛海洋大学学报,1999,29(3):463-468.
[12] 田春美,钟秋平.超氧化物歧化酶的研究现状进展[J].中国热带医学,2005, 5(8):1730-1732.
[13] Dong Y W,Dong S L,Meng X L.Effects of thermal and osmotic stress on growth, osmoregulation and Hsp70 in sea cucumber(ApostichopusjaponicusSelenka)[J].Aquaculture,2008,276(1):179-186.
[14] 唐晓龙. 青藏高原两种沙蜥的代谢特征及其对环境的适应[D]. 兰州:兰州大学,2013.
[15] 郑萍萍, 王春琳, 宋微微, 等.盐度胁迫对三疣梭子蟹血清非特异性免疫因子的影响[J]. 水产科学, 2010, 29(11):634-638.
[16] 沙飞,常亚青,丁君. 两种降温模式的低温胁迫对刺参抗氧化酶活性及丙二醛含量的影响[J]. 大连海洋大学学报, 2015, 30(1):25-29.
[17] 刘伟,常亚青,丁君. 温度缓降和骤降对刺参“水院1号”和大连养殖群体非特异性免疫影响的初步研究[J]. 水产学报,2013,27(9):1342-1348.
[18] 李晓英, 董志国, 薛洋, 等. 温度骤升和窒息条件对青蛤酸性磷酸酶和溶菌酶的影响[J]. 水产科学,2009,28(6):321-324.
[19] 李晓英,沈睿杰,董志国,等. 温度骤升和窒息胁迫对青蛤抗氧化酶活性的影响[J]. 中国饲料,2009(1):39-42.
[20] 贲月, 郝振林, 丁君, 等. 高温对虾夷扇贝体腔液免疫酶活力的影响[J]. 水产学报, 2013,37(6):858-862.
[21] Borkovic S S, Saponjic J S, Pavlovic S Z, et al. The activity of antioxidant defence enzymes in the musselMytilusgalloprovincialisfrom the Adriatic Sea[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2005, 141(4):366-374.
[22] 王吉桥,田相利.刺参养殖生物学新进展[M].北京:海洋出版社,2012.
[23] Song L S,Ji Y B,Cai Z H,et al. The immunochemical variation of Chinese mitten hand crabEriocheirsinensisafter the increment of temperature[J]. Oceanologia Et Limnologia Sinica, 2004, 35(1):74-77.
[24] Ji T T, Dong Y W, Dong S L.Growth and physiological responses in the sea cucumber,Apostichopusjaponicus(Selenka): aestivation and temperature[J]. Aquaculture, 2008, 283(1):180-187.
[25] 何伟. 温度对几种鲤科鱼类低氧耐受及生化反应的影响[D]. 重庆:重庆师范大学,2014.
[26] 任峰. 滑液支原体乳酸脱氢酶生物学功能的研究[D]. 晋中:山西农业大学,2014.
[27] Moss A K,Hamarneh S R,Mohamed M M,et al.Intestinal alkaline pbosphatase inhibits the proinflammatory nucleotide uridine diphosphate[J].Am J Physiol Gastrointest Liver Physiol, 2013,304 (6):597-604.
[28] Garnero P,Delmas P D.Assessment of the serum levels of bone alkaline phosphatase with a new immunoradiometric assay in patients with metabolic bone disease[J].J Clin Endocrinol Metab,1993,77(4):1046-1053.
[29] 马金虎,薛福来,王一帆,等. 草鱼肝胰脏碱性磷酸酶的分离纯化及性质的研究[J]. 水产科学,2014,33(8):498-502.
EffectsofHighTemperatureStressonAntioxidantEnzymeActivitiesinSeaCucumberApostichopusjaponicus
XIE Zhaowen1, WANG Shoukun1,LIN Xuan1,CHEN Meizhen1,CHEN Linliu1,LIN Feng2,LU Haibin2
( 1. Fujian Provincial Animal Medicine Engineering Laboratory, College of Animal Science, Fujian Agriculture and Forestry University,Fuzhou 350002,China; 2. Fujian Provincial Lianjiang Guanwu Ocean Development Limited Company, Lianjiang 350511,China )
The activities of superoxide dismutase(SOD), catalase(CAT), glutathione peroxidase(GSH-PX), lactate dehydrogenase(LDH), and alkaline phosphatase(AKP) and the content of malondialdehyde(MDA) in the coelomic fluid and extracting fluid of visceral mass were determined from Lianjiang and Dalian populations of sea cucumber,Apostichopusjaponicus, exposed to different sea water temperature(15, 18, 21, 24, 27 ℃ and 30 ℃). The results showed that the maximal activities of SOD,CAT,GSH-PX and LDH of extracting fluid of visceral mass were observde at 3—9 ℃ higher in Lianjiang population than in Daliang population; under high temperature (24, 27, 30 ℃) stress, the activities of SOD,CAT and LDH of coelomic fluid and extracting fluid of visceral mass population were very significantly higher in Lianjiang than in Daliang population(P<0.01). The activity of GSH-PX of extracting fluid of visceral mass was very significantly higher in Lianjiang population than in Daliang population(P<0.01), and under 24 ℃ and 30 ℃,the activities of GSH-PX of coelomic fluid population were also significantly higher in Lianjiang population than Daliang population(P<0.01); the temperature of highest activity of AKP of coelomic fluid and extracting fluid of visceral mass from the two populations were all at 15 ℃ and 18 ℃; the content of MDA of the coelomic fluid and extracting fluid of visceral mass was significantly lower in Lianjiang population than in Dalian population at 18—30 ℃(P<0.05,P<0.01). The findings of high temperature stress indicated that activities of SOD, CAT,GSH-PX and LDH of coelomic fluid and extracting fluid of visceral mass from the second generation of Lianjiang population of sea cucumber exposed to high temperature during summer in Fujian province,southeast China were significantly higher than Daliang population of sea cucumber; contents of MDA were lower significantly from Lianjiang population than Daliang population of sea cucumber. The increasing enzymes thermostability of the sea cucumber could be favorable to clean out excessive free radicals in the body under high temperature stress, and to protect the organism from high temperature stress damage.
Apostichopusjaponicus; heat stress; superoxide dismutase; catalase; glutathione peroxidase; lactate dehydrogenase; alkaline phosphatase; malonaldehyde
S968.9
A
1003-1111(2016)04-0327-07
10.16378/j.cnki.1003-1111.2016.04.003
2015-08-25;
2015-12-10.
福建省科技重大专项项目(2011NZ0001-1).
谢兆文(1990-),男,硕士研究生;研究方向:鱼类疾病与保健. E-mail:xiezhaowen@outlook.com. 通讯作者:王寿昆(1956-),男,教授;研究方向:水产养殖与动物寄生虫学. E-mail:wsk138@163.com.
