一步法多重RT-PCR检测猪流行性腹泻病毒、猪传染性胃肠炎病毒和猪A群轮状病毒方法的建立和应用
2016-12-19于新友李天芝沈志强
于新友,李天芝,沈志强,2
(1.山东绿都生物科技有限公司,山东滨州256600;2.山东省滨州畜牧兽医研究院,山东滨州256600)
一步法多重RT-PCR检测猪流行性腹泻病毒、猪传染性胃肠炎病毒和猪A群轮状病毒方法的建立和应用
于新友1,李天芝1,沈志强1,2
(1.山东绿都生物科技有限公司,山东滨州256600;2.山东省滨州畜牧兽医研究院,山东滨州256600)
根椐GenBank中登录的猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)和猪A群轮状病毒(PARV)基因序列,分别设计3对引物,在建立各病毒单项一步法RT-PCR技术的基础上,优化多重RT-PCR反应条件,建立了3种病毒的一步法多重RT-PCR检测方法,用这3对引物对同一样品中的PEDV、TGEV和PARV核酸模板进行多重RT-PCR扩增,结果可同时扩增PEDV的450 bp、TGEV的609 bp、PARV的241 bp特异性片段,而对其它4种病原的扩增结果均为阴性。敏感性测定结果表明,该多重RT-PCR技术能检出10 pg的PEDV、10 pg的TGEV和1 pg的PARV模板。用67份临床病料对建立的多重RT-PCR技术和单项RT-PCR技术进行对比验证,结果显示,两者的总符合率为100%。表明建立的一步法多重RT-PCR检测方法,具有特异、快速、准确的特点,可用于这3种病毒的同时检测和鉴别诊断。
猪流行性腹泻病毒;猪传染性胃肠炎病毒;猪A群轮状病毒;一步法多重RT-PCR
腹泻是当前威胁养猪业的一类重要疾病,导致猪腹泻的原因很多,包括营养性腹泻、细菌性腹泻、病毒性腹泻和寄生虫等因素。其中,病毒性因素是非常重要的一种因素,且发生与流行在近年呈现持续上升的趋势,给养猪业造成巨大的经济损失[1-2],引起猪腹泻主要病毒有猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪传染性胃肠炎病毒(Porcine transmissible gastroenteritis virus,TGEV)、猪A群轮状病毒(PorcinegroupArotavirus,PARV)[3-4],这3种病毒所致的腹泻病情相似,在临床症状、流行病学和病理变化上无明显差异[5]。各日龄猪均可感染发病,多发生于晚秋至早春的寒冷季节,也可发生于其它季节,临床表现主要为厌食、呕吐、水样腹泻,仔猪死亡率高,肥育猪掉膘,饲料报酬降低。这3种病毒有时呈混合感染[6],使病情加重[7]。针对这3种病毒传统检测方法耗时长、检测敏感性较低及准确性差。多重PCR是在常规PCR基础上发展起来的一种检测技术,即具有常规PCR测快度、灵敏度高、特异性好等特点,又能检测和鉴别多种病原,可节约大量的时间、人力和物力[8],适合大量临床样品(特别是混合感染样品)中病原体的快速诊断。笔者根据PEDV、TGEV和PARV相关保守基因序列设计引物,优化了反应条件,建立一种可用于上述3种病毒的一步法多重RT-PCR诊断方法,可用于临床病料进行检测。
1 材料与方法
1.1 病毒
猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)、猪A群轮状病毒(PARV)、猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪乙型脑炎病毒(JEV)、猪捷申病毒(PTV)由山东省滨州畜牧兽医研究院预防兽医学与动物生物技术重点开放实验室保存,临床疑似病料为2015年2—11月采自山东、安徽、河南和江苏各地猪场猪肠道、肠道内容物等。
1.2 工具酶及试剂盒
DL 2 000 Marker、PrimeScriptTMOne Step RT-PCR Kit Ver.2等购自宝生物工程(大连)有限公司,多功能DNA纯化回收试剂盒、高纯质粒小量制备试剂盒购自北京百泰克生物科技有限公司产品,AxyPrep体液病毒DNA/RNA小量试剂盒购自爱思进生物技术(杭州)有限公司,其它化学试剂如异丙醇、乙醇等,均为国产分析纯产品。
1.3 引物的设计与合成
参考GenBank中登录的PEDV(JN601060)、TGEV(JX827605)和PARV(DQ786577)基因序列,利用Primer Premier 5.0软件设计3对特异性引物(表1),由上海生工生物工程技术服务有限公司合成,用灭菌水溶解并配成15 pmol/mL溶液备用。
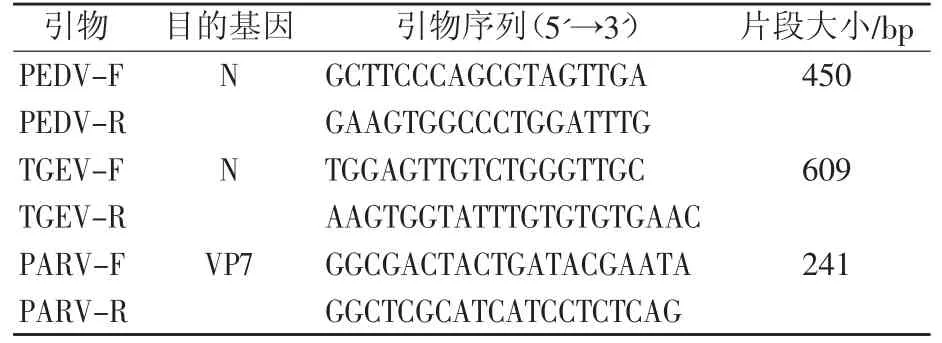
表1 PEDV、TGEV和PARV基因扩增引物
1.4 病毒RNA的提取
按AxyPrep体液病毒DNA/RNA小量试剂盒使用说明书分别提取PEDV、TGEV、PARV的RNA,并提取其它几种病毒的核酸。
1.5 一步法RT-PCR扩增及条件优化
参照一步法RT-PCR试剂盒操作说明,RT-PCR反应体系,即PrimeScript 1 step Enzyme Mix 2 μL,2×stepbuffer 25 μL,上、下游引物各1 μL,RNA模板10 μL,加ddH2O至50 μL。各参数为50℃逆转录30 min,95℃预变性2 min,然后进入95℃30 s、52℃30 s、72℃40 s循环,共40个循环,最后72℃延伸10 min。取5 μL产物,1.5%琼脂糖凝胶电泳。同时对各扩增条件进行优化,包括退火温度(40~60℃梯度温度,每2℃为1个梯度)和引物浓度(0.2~1.2 μmol/L,每0.2 μmol/L为1个梯度)。
1.6 特异性试验
用已建立的多重RT-PCR扩增,分别对PEDV、TGEV、PARV、CSFV、PRRSV、JEV和PTV的RNA模板进行扩增,扩增反应同时设双蒸水阴性对照,扩增反应结束后进行凝胶电泳检测,以检验多重RT-PCR的特异性。
1.7 多重RT-PCR的敏感性试验
分别提取PEDV、TGEV和PARV的RNA,用仪器测定含量,并依次做10倍梯度稀释,每个稀释度取1 μL为模板,采用已优化的多重PCR反应条件分别对上述不同稀释度的RNA进行多重RT-PCR扩增,反应结束后进行凝胶电泳检测,以检测建立的一步法多重RT-PCR的敏感性。
1.8 重复性试验
用建立的多重PCR检测方法分别对PEDV感染的8份阳性样品,TGEV感染5份阳性样品,PARV感染的3份阳性样品及3份阴性样品重复检测3次,以验证本方法的重复性和稳定性。
1.9 临床样品的检测
对山东、安徽、河南和江苏等省送检的67份猪病料进行多重RT-PCR检测,并对扩增产物进行测序鉴定。
2 结果与分析
2.1 反应条件的优化
通过对PEDV、TGEV、PARV 3种引物浓度及多重RT-PCR扩增温度及时间和循环次数等的优化,最后确定多重RT-PCR中最佳引物浓度分别为PEDV 0.4 pmol/μL、TGEV 0.6 pmol/μL、PARV 0.4 pmol/μL。多重RT-PCR的最佳反应模式为:50℃30 min,95℃2 min,94℃30 s,52℃30 s,72℃40 s,40个循环,最后72℃延伸10 min。
2.2 扩增产物的检测
将PEDV、TGEV和PARV的核酸分别进行多重RT-PCR扩增,结果能扩增出与预期相符,PARV的241 bp,PEDV的450 bp,TGEV的609 bp的特异性片段,而对照扩增不出任何条带,其扩增产物的电泳结果见图1。
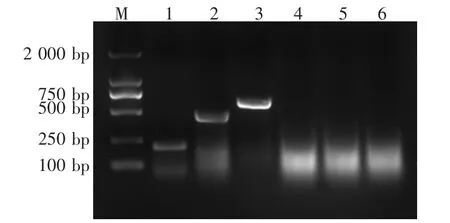
图1 单项RT-PCR扩增结果
2.3 特异性试验
采用建立的多重RT-PCR方法对PEDV、TGEV、PARV、CSFV、PRRSV、JEV和PTV在相同的条件进行扩增。结果显示,PEDV、TGEV和PARV的PCR产物的片段长度分别为450 bp、609 bp和241 bp,与预期大小一致,而CSFV、PRRSV、JEV和PTV均未扩增出片段,说明本研究建立的一步法多重RTPCR方法特异性强(图2)。
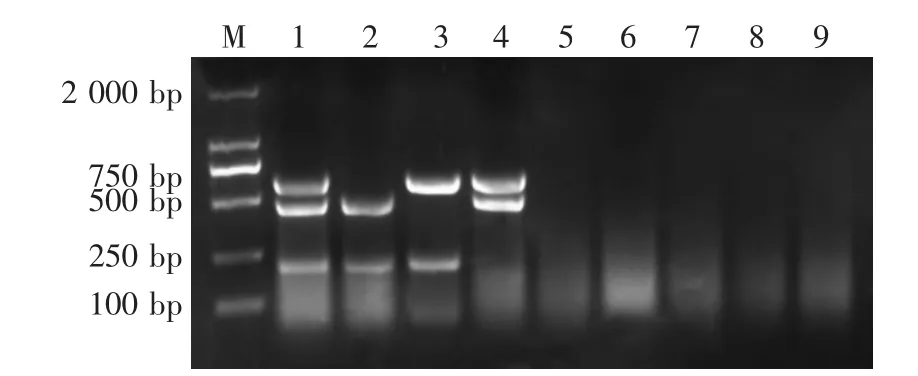
图2 一步法多重RT-PCR的特异性试验
2.4 敏感性试验
提取PEDV、TGEV、PARV基因组RNA,用仪器测定含量,然后做10倍梯度稀释,每个稀释度取1 μL,作为模板。结果显示用10 pg的PEDV、10 pg的TGEV、1 pg的PARV可以扩增出特异性条带(图3),表明该多重RT-PCR敏感性强。
2.5 重复性试验
经3次重复操作,结果一致,表明本研究建立的一步法多重RT-PCR方法是稳定可靠的。
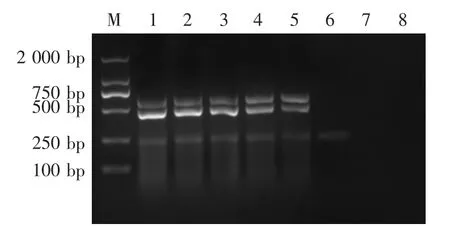
图3 一步法多重RT-PCR的敏感性试验
2.6 临床样品的检测
对67份在不同地区采集的疑似病料,用建立的多重RT-PCR和单项RT-PCR进行了检测,两者符合率达100%(表2),结果表明建立的多重PCR检测体系的特异性和敏感性较好。

表2 被检病料单项RT-PCR与多重RT-PCR检测对比试验结果
3 讨论
猪病毒性腹泻是目前困扰规模化猪场生产的主要疾病之一,对猪病毒性腹泻进行快速、准确地诊断是有效控制和消灭猪场病毒性腹泻病前提,郭容利等[9]建立了一种同时检测PEDV、TGEV和PARV的三重RT-PCR方法,并对其进行特异性与敏感性试验,该法能检测约50TCID50的混合病毒,能够扩增出3条长度为750 bp(PEDV)、544 bp(TGEV)、275 bp(PARV)特异性片段,而其它病毒无特异性条带。本试验建立的多重RT-PCR检测PEDV、TGEV和PARV方法与郭容利等的方法并不相同,具有操作简单,减少了繁琐的反转录加样的过程,不需要单独做反转录,反转录与PCR扩增一步完成,减少了反应时间,使得检测速度更快,避免了模板RNA的降解,提高了检测的敏感性,更加方便、实用,适合基层兽医工作者使用,优化反应条件后,PEDV、TGEV和PARV最佳引物浓度分别为0.4 pmol/μL、0.6 pmol/ μL和0.4 pmol/μL,最佳退火温度为52℃。对PEDV、TGEV和PARV的扩增产物的片段长度分别为450 bp、609 bp和241 bp,通过电泳即可区分,该多重RT-PCR方法具有良好的特异性,对其它猪病毒的扩增结果均为阴性,对PEDV、TGEV和PARV的最低检测量分别为10 pg、10 pg和1 pg。用本研究建立的方法对来自山东、安徽、河南和江苏等省的67份病料进行检测,同时进行单项RT-PCR检测,结果显示,多重RT-PCR方法与单项RT-PCR检测结果符合率为100%。PEDV阳性率为47.8%,TGEV阳性率为13.4%,PARV阳性率为7.5%,PEDV与TGEV混合感染2份,PEDV与PARV混合感染1份,二重混合感染率为4.5%,PEDV、TGEV与PARV三重混合感染阳性样品1份,感染率为1.5%。可以看出PEDV为猪场流行性腹泻最主要的病原,与近年来PEDV在腹泻病猪样本中的阳性率为33.3%~84.4%相关文献报道相一致[10]。也有一些研究指出猪病毒性腹泻也能由猪嵴病毒和猪博卡病毒等新发现的病毒引起,但笔者以为这些病毒的致病机理尚不清楚,可能在猪腹泻中起到了一定的作用,但并不起主要作用,是否具有单独致病性还有待于进一步研究。该多重RT-PCR方法比单项RT-PCR检测可节省70%的时间和2/3的试剂用量,减少了污染环境的机会,为猪腹泻性病毒病的诊断、流行病学调查等提供一种简单、快速的分子生物学诊断方法。
[1]何启盖.猪腹泻病的鉴别诊断与防控措施[J].北方牧业,2014(9):17.
[2]杨汉春.2013年猪病流行情况与2014年流行趋势及防控对策[J].猪业科学,2014(2):42-43.
[3]殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:681-690.
[4]于新友,李天芝,王金良,等.一步法RT-PCR快速检测猪流行性腹泻病毒[J].养猪,2014(5):118-120.
[5]陈少华,谢三星.猪三大病毒性腹泻区别诊断问题[J].中国动物检疫,1995(3):22-23.
[6]Sergeev O V.Porcine epidemic diarrhea[J].Vopr Virusol, 2009,54(2):4-8.
[7]Ben Salem A N,Chupin Sergei A,Bjadovskaya Olga P,et al. Multiplex nested RT-PCR for the detection of porcine enteric viruses[J].J Virol Methods,2010,165(2):283-293.
[8]Ogawa H,Taira O,Hirai T,et al.Multiplex PCR and multiplex RT-PCR for inclusive detection of major swine DNA and RNA viruses in pigs with multiple infections[J].J Virol Methods, 2009,160(1-2):210-214.
[9]郭容利,何孔旺,倪艳秀,等.PEDV、TGEV、PARV多重RTPCR检测方法的建立及其应用[J].江苏农业学报,2013,29(5):1065-1069.
[10]霍金耀,郑逢梅,陈陆,等.猪流行性腹泻病毒、传染性胃肠炎病毒、A群轮状病毒和嵴病毒多重RT-PCR检测方法的建立及临床应用[J].中国兽医学报,2013,33(12):1792-1797.
(编辑:郭玉翠)
Establishment and Application of One Step Multiplex RT-PCR Assay for Detection of Porcine Epidemic Diarrhea Virus,Porcine Transmissible Gastroenteritis Virus and Porcine Group A Rotavirus
YU Xinyou1,LI Tianzhi1,SHEN Zhiqiang1,2
(1.Shandong Lvdu Bio-Industry Co.,Ltd.,Binzhou 256600,China; 2.Animal Science and Veterinary Medicine Academy,Binzhou 256600,China)
A multiplex RT-PCR was optimized to simultaneously detect three pathogens of Porcine epidemic diarrhea virus(PEDV),Porcine transmissible gastroenteritis virus(TGEV)and Porcine group A rotavirus(PARV)in this article.Three sets of specific primers were designed according to the sequences of PEDV,TGEV and PARV at the GenBank.By using three pairs of virus specific primers,three RT-PCR assay were established to amplify the conservative regions of the three viruses,respectively.Consequently,a multiplex RT-PCR method to detect the three viruses in one tube was developed.The multiplex RT-PCR system would amplify a 450 bp fragment for PEDV,a 609 bp for TGEV and a 241 bp for PARV simultaneously or separately in the samples,depending on its infection status.But not specific band amplified from other four pig pathogenic viruses.As little as 10 pg of PEDV, 10 pg of TGEV and 1 pg of PARV RNA were detected using gel electrophoresis in the multiplex PCR.To evaluate the multiplex PCR,67 clinical samples were comparatively detected.The data showed that the multiplex RTPCR method being 100%coincidence with the single RT-PCR,and it can be used for this three viruses detection and differential diagnosis.
Porcine epidemic diarrhea virus;Porcine transmissible gastroenteritis virus;Porcine group A rotavirus;one step multiplex RT-PCR
S858.28
A
1002-1957(2016)02-0105-04
2016-01-14
山东省现代农业产业技术体系生猪产业创新团队项目(SDAIT-06-022-15);山东省自然科学基金项目(ZR2013CQ006);山东省自然科学基金青年基金项目(ZR2014CQ010)
于新友(1983-),男,山东菏泽人,助理研究员,硕士,主要从事动物传染病诊断技术研究.E-mail:yuxinyou_2006@126.com
