抗菌肽在断奶仔猪饲粮中的应用效果研究
2016-12-19朱宇旌王博李方方郑丽莉高原孟玲郭福来丁兰张勇
朱宇旌,王博,李方方,郑丽莉,高原,孟玲,郭福来,丁兰,张勇
(1.沈阳农业大学畜牧兽医学院,辽宁沈阳110866;2.辽宁德宝农牧集团有限公司,辽宁沈阳110171;3.沈阳福康农牧科技有限公司,辽宁沈阳110164)
抗菌肽在断奶仔猪饲粮中的应用效果研究
朱宇旌1,王博1,李方方1,郑丽莉1,高原2,孟玲2,郭福来2,丁兰3,张勇1
(1.沈阳农业大学畜牧兽医学院,辽宁沈阳110866;2.辽宁德宝农牧集团有限公司,辽宁沈阳110171;3.沈阳福康农牧科技有限公司,辽宁沈阳110164)
为研究抗菌肽(AMPs)在仔猪生产中的应用效果,选取(10.30±1.13)kg大白仔猪180头,随机分为3组,每组4个重复,每个重复15头,对照组饲喂基础饲粮,试验组分别在基础饲粮中添加抗菌肽A(AMPs-A)500 mg/kg和抗菌肽B(AMPs-B)300 mg/kg,试验期28 d。结果表明:1)AMPs-A组在试验1~14 d、15~28 d、1~28 d这3个时间阶段日增重比对照组分别提高5.66%(P>0.05)、3.92%(P>0.05)、3.85%(P>0.05)。2)AMPs-A组血清尿素氮水平比对照组降低14.55%(P<0.01)。3)与对照组相比,AMPs-A、AMPs-B血液中IgG分别提高2.07%(P<0.05)、1.27%(P<0.05),血清总蛋白水平分别提高4.48%(P<0.05)、4.03%(P<0.05),血液T淋巴细胞转化率AMPs-A组提高39.02%(P<0.05)。4)AMPs-A组干物质、粗蛋白质和粗脂肪消化率分别比对照组提高2.62%(P<0.05)、3.95%(P<0.05)、3.70%(P<0.05)。5)肠道中大肠杆菌数,AMPs-A、AMPs-B比对照组分别降低5.53%(P<0.05)、3.77%(P<0.05);乳酸杆菌数,AMPs-A、AMPs-B比对照组分别提高4.94%(P<0.05)、3.67%(P<0.05);双歧杆菌数,AMPs-A、AMPs-B比对照组分别提高5.61%(P<0.05)、4.75%(P<0.05)。综上所述,在仔猪饲粮中添加AMPs可以有效提高仔猪的生长性能、饲料养分消化利用率,改善血清生理生化指标水平、肠道微生物平衡。综合本试验各项指标,仔猪饲粮中添加AMPs-A效果较好。
抗菌肽;断奶仔猪;生长性能;血清生理生化指标;养分消化率;粪便微生物菌群
目前寻找可替代抗生素类的新型饲料添加剂已成为动物营养领域的研究热点。抗菌肽(antimicrobial peptides,AMPs)是指昆虫及动物体内通过诱导作用产生的一类分子量较小的多肽物质,产生于生物体的免疫系统当中,可以抵抗病原体的侵害,是具有广谱杀菌功能的一类多肽,属碱性,同时它也是生物体中天然免疫系统不可分割的重要组成部分[1]。经大量研究发现,抗菌肽具有提高动物生长性能、调节机体免疫性能、改善肠道微生物环境、抗病毒活性等优点[2-4]。但目前有关AMPs在仔猪生产中的应用效果及作用机制少有报道。因此,本试验以大白仔猪为试验对象,通过在饲粮中添加不同的AMPs研究其对仔猪生长性能、血液生理生化指标、免疫机能、养分消化率和粪便中微生物菌群的影响,为AMPs在实际生产中的应用提供参考。
1 材料与方法
1.1 试验材料
抗菌肽A(AMPs-A)主要成分为猪防御素、蝇蛆杀菌肽、枯草芽孢杆菌。枯草芽孢杆菌≥1.5×109CFU/g。
抗菌肽B(AMPs-B)主要成分为天蚕素、枯草芽孢杆菌。枯草芽孢杆菌≥1×109CFU/g。
1.2 试验动物及饲粮
试验于2014年4—6月在辽宁德宝农牧集团艾德蒙种猪场进行。大白仔猪平均体重在(10.30±1.13)kg。基础饲粮参考NRC(1998)配制,其组成及主要营养水平见表1。
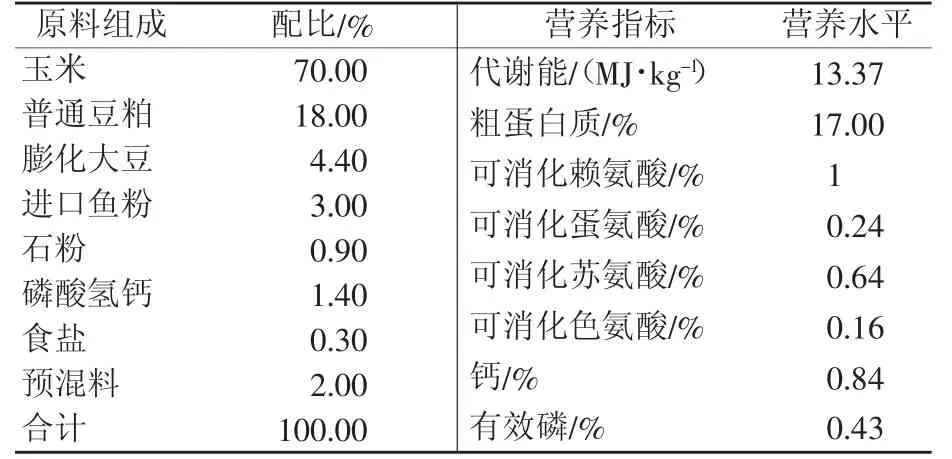
表1 基础饲粮组成及营养水平(风干基础)
1.3 试验设计及饲养管理
选用体重相近、健康的大白仔猪180头,随机分为3组,每组4个重复,每个重复15头仔猪。饲喂期28 d。对照组饲喂基础饲粮,试验组分别在基础饲粮中添加500 mg/kg AMPs-A、300 mg/kg AMPs-B。
试验开始前对保育猪舍进行冲洗及消毒,试验仔猪采用高床饲养,自由采食及饮水。免疫和驱虫程序按猪场常规程序进行,随时观察、记录仔猪的采食和腹泻情况以及每天的饲料消耗量。
1.4 检测指标及方法
1.4.1 生长性能指标的测定分别在试验第1天、第14天和第28天以个体为单位对所有试验猪进行空腹称重,试验过程中以重复为单位记录采食量,并测定仔猪的平均日采食量、平均日增重。根据平均日增重(ADG)和平均日采食量(ADFI)计算料重比(F/G)。
1.4.2 血清生理生化指标的测定采用日本日立7160全自动生化仪测定血清中总蛋白(totalprotein,TP)、尿素氮(urea nitrogen,BUN)。采用比色法测定IgA、IgG、IgM含量,试剂盒由南京建成生物工程研究所提供。
1.4.3 T淋巴细胞转化率的测定取抗凝血3 mL,500 r/min离心10 min,取中层(血浆与血细胞之间的白色膜)加Hank'S液2 mL,3 500 r/min离心10 min,取上清液。洗涤2次。用PRMI 1640稀释细胞用血球仪计数白细胞,使其密度为107/mL的白细胞悬液,分装成2管。在一管中加10%小牛血清和10%植物血凝素各100 μL,另一管(对照管)加10%小牛血清和PRMI 100 mL,混匀。取上述100 μL加入96孔板细胞培养板内,设2个重复管,在5%二氧化碳、37℃、饱和湿度下培养48 h,每孔加5 mg/mL MTT 10 μL培养4 h,再加10 mL 10%的SDS-0.04M HCl,培养2 h后取出,室温放置5 min。采用酶联免疫检测仪检测[5]。
1.4.4 养分消化率的测定以酸不溶灰分作为内源指示剂测定各养分消化率。在正式试验期的第26、27和28天选取每个重复中生长较好、体况相近的猪各5头,连续3 d于6:00至8:00间收集粪样,每天每头猪采集粪样约200 g,并加入体积分数为10%的酒石酸水溶液20 mL,防止氨气挥发。收集后将每个粪样单独冷冻保存,密封后低温运回实验室,粪样进行概略养分分析。测定酸不溶灰分(AIA)含量,计算干物质(DM)、粗蛋白质(CP)、粗脂肪(EE)、钙(Ca)和磷(P)的表观消化率[5]。
1.4.5 粪中微生物菌群的测定在正式试验期的第28天选取每个重复中生长较好、体况相近的猪各5头,连续3 d于6:00~8:00间收集粪样,每头猪采集粪样约50 g,分别使用无菌自封袋采集封装记录后置于-4℃冰箱内保存用于测定大肠杆菌、乳酸杆菌、双歧杆菌菌落数量,采用平板涂布法计数[5]。试验所用培养基均购自青岛高科园海博生物技术有限公司,大肠杆菌用麦康凯培养基(HB6238-1)37℃下恒温需氧培养24 h后计数;乳酸杆菌用乳酸杆菌选择性琼脂培养基(LBS培养基,HB0385)、双歧杆菌用双歧杆菌琼脂培养基(BL培养基,HB0395),置于37℃培养箱厌氧培养48 h后观察计数,结果均以每克粪便中含有的菌落总数的常用对数值[log(CFU/g)]表示。
1.5 数据统计分析
试验数据经Excel初步处理后采用SPSS 19.0软件进行单因素方差分析(one-way ANOVA),差异显著时采用邓肯法(duncan)进行多重比较,P<0.05为差异显著,P<0.01为差异极显著,数据结果以平均数±标准差表示。
2 结果与分析
2.1 抗菌肽对仔猪生长性能的影响
由表2可知,与对照组相比,AMPs-A组仔猪中期重、末重分别提高3.61%(P>0.05)、3.89%(P>0.05),AMPs-B中期重、末重比对照组分别显著降低4.57%(P<0.05)、5.65%(P<0.05)。AMPs-A组有提高日增重趋势(P>0.05),试验1~14 d、15~28 d、1~28 d这3个时间阶段日增重比对照组分别提高5.66%、3.92%、3.85%。但AMPs-B仔猪日增重显著低于对照组(P<0.05),试验1~14 d、15~28 d、1~28 d这3个时间阶段日增重比对照组分别显著降低11.32%、7.84%、9.62%。各试验组日采食量与对照组相比差异不显著(P>0.05),但AMPs-A各试验阶段有高于对照组趋势。料重比,试验1~14 d,AMPs-B组显著高于对照组和AMPs-A组,分别提高8.06%、11.67%;AMPs-A组与对照组相比降低3.23%,但差异不显著(P>0.05)。
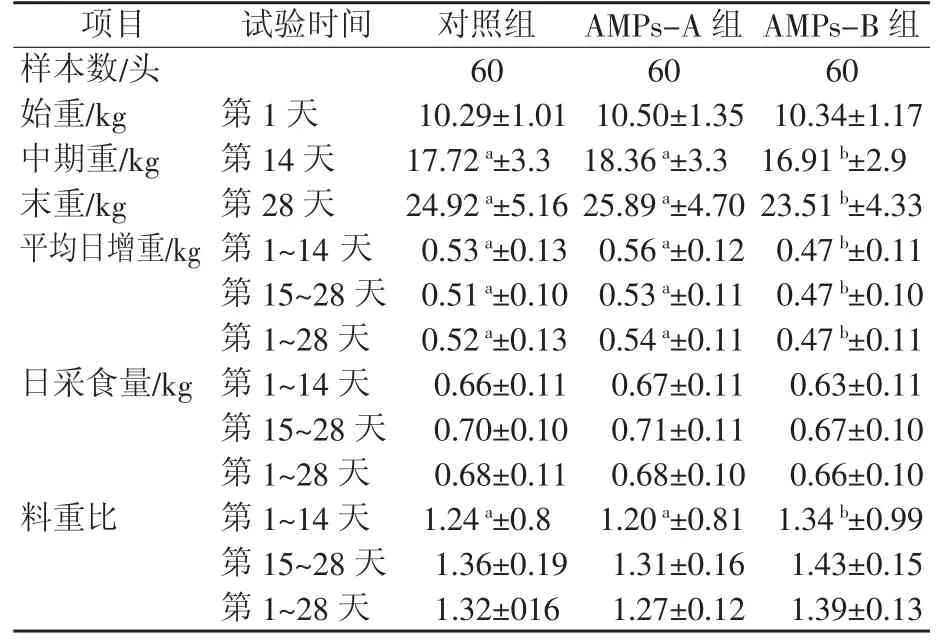
表2 抗菌肽对仔猪生长性能的影响
2.2 抗菌肽对仔猪血液生化指标的影响
2.2.1 抗菌肽对仔猪蛋白质代谢指标的影响由表3可知,AMPs-A组尿素氮极显著低于对照组(P<0.01),AMPs-B组尿素氮显著低于对照组(P<0.05),与对照组相比分别降低14.55%和8.18%。
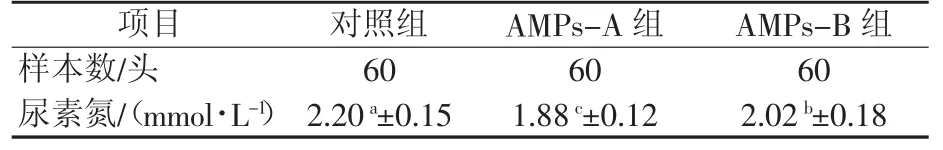
表3 抗菌肽对仔猪蛋白质代谢的影响
2.2.2 抗菌肽对仔猪免疫性能的影响由表4可知,各试验组血液IgA和IgM含量与对照组相比差异不显著(P>0.05)。AMPs-A组、AMPs-B组与对照组相比,血液IgG含量显著提高(P<0.05),分别提高2.07%、1.27%。AMPs-A组血液T淋巴细胞转化率显著高于对照组(P<0.05),比对照组提高39.02%; AMPs-B组血液T淋巴细胞转化率显著低于对照组(P<0.05),比对照组降低9.76%。AMPs-A、AMPs-B组血清总蛋白水平比对照组分别显著提高4.48%、4.03%。
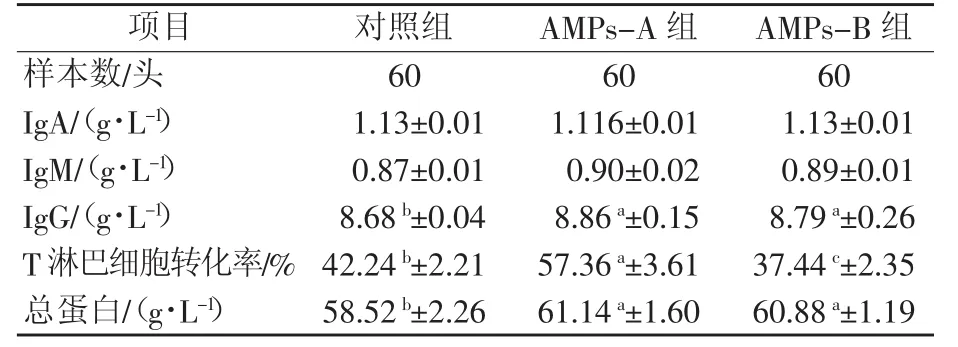
表4 抗菌肽对仔猪血液免疫指标的影响
2.3 抗菌肽对仔猪养分消化率的影响
由表5可见,与对照组相比,AMPs-A组干物质、粗蛋白质、粗脂肪消化率分别显著提高2.62%、3.95%、3.70%。AMPs-B组干物质、粗蛋白质、粗脂肪消化率与对照组差异不显著。AMPs-B组钙和磷消化率比对照组显著低6.73%、4.92%,AMPs-A组钙和磷消化率与对照组差异不显著。

表5 抗菌肽对仔猪养分消化率的影响
2.4 抗菌肽对仔猪肠道微生物数量的影响
由表6可知,AMPs-A、AMPs-B组肠道中大肠杆菌数量均显著低于对照组(P<0.05),分别降低5.53%、3.77%;乳酸杆菌菌落数,AMPs-A、AMPs-B组分别比对照组显著提高了4.94%、3.67%;双歧杆菌菌落数,AMPs-A、AMPs-B组分别比对照组显著提高5.61%、4.75%。

表6 抗菌肽对仔猪肠道微生物数量的影响
3 讨论
3.1 抗菌肽与仔猪生长性能的关系
研究发现,断奶仔猪抵抗力下降,容易引发腹泻、生长性能下降等,这很可能与抗菌肽的表达下降有关,通过外源性添加抗菌肽可提高畜禽防御功能,增强自身免疫力和抗病能力[5]。在饲粮中添加抗菌肽能够增加仔猪对外源性病原菌的抵抗能力[5]。本试验结果表明,在饲粮中添加AMPs-A能显著地提高仔猪日增重,降低试验仔猪料重比,但对日采食量无显著影响,这与Jin等[6]的研究结果相似。AMPs-B组中期重和末重低于对照组,可能是这种抗菌肽反而引起体内免疫反应导致负面效果,所以抗菌肽的种类对仔猪生长性能的影响很大。AMPs-A是来自猪源型的抗菌肽,效果明显好于对照组和AMPs-B组。
3.2 抗菌肽与仔猪免疫性能及血清生理生化的关系
血清总蛋白含量和尿素氮浓度能够比较准确地反映出动物体内蛋白质代谢和饲粮氨基酸平衡的状况[7]。本研究发现,在饲粮中添加AMPs-A能显著提高仔猪血清中总蛋白水平,极显著降低仔猪血液中尿素等水平,这与Coma等[8]研究结果相似。这是由于AMPs能促进蛋白质在仔猪体内的合成,降低体内氨基酸的分解作用,从而改善了机体内氨基酸的平衡状态,促进机体蛋白质的合成或减少体内含氮物质的分解,进而增加机体蛋白质沉积。
顾宪红等[9]指出,断奶会使仔猪肠绒毛萎缩、隐窝加深,保护仔猪的胃肠道黏膜可减弱应激对仔猪的损伤作用,而免疫球蛋白在保护肠道、呼吸道、泌尿生殖道、乳腺和眼睛抵抗微生物入侵方面起关键作用。本试验结果表明,添加AMPs-A能够提高仔猪IgG和IgM水平,进而保护断奶仔猪胃肠道黏膜,减少断奶应激,这与Papagianni等[10]的研究结果基本一致。此外本试验结果还发现,饲粮中添加AMPs-A后仔猪血液T淋巴细胞转化率显著高于对照组,这也说明AMPs-A具有减少机体应激、增强机体免疫力的功效。
3.3 抗菌肽与仔猪营养消化利用率的关系
仔猪消化酶活性越高,消化吸收能力越好,添加AMPs能提高十二指肠蛋白酶、淀粉酶活性,从而促进营养物质的消化吸收[11-12]。本试验结果表明,AMPs-A能提高干物质、钙、磷、粗蛋白质和粗脂肪消化率,与以上报道基本一致。
3.4 抗菌肽与粪便微生物菌群数的关系
本试验表明,AMPs-A和AMPs-B能显著地降低大肠杆菌的数量,同时还能显著地提高肠道乳酸杆菌和双歧杆菌数量,这与Manzanilla等[13]、Namkung等[12]研究结果基本一致。仔猪早期断奶后受到各种应激导致肠道微生物菌群严重失调,断奶后2 d内回肠中乳酸杆菌的数量几近消失,而大肠杆菌的数量显著增加,且pH越高,大肠杆菌的数量越多,而大肠杆菌是引起仔猪断奶后腹泻的主要病原菌[14]。Chen等[14]进行了天蚕素的体外抑菌试验,结果发现,肠道中大量的致病菌,如大肠杆菌和沙门氏菌等被优先抑制。由此可见,抗菌肽具有较强的抑菌效果。
4 结论
(1)在仔猪饲粮中添加AMPs-A有提高仔猪日增重趋势,有利于提高仔猪的生长性能。
(2)添加AMPs显著提高血液中IgG含量,AMPs-A显著提高血液T淋巴细胞转化率,AMPs显著提高血清总蛋白水平,使仔猪的免疫机能得到改善。
(3)添加AMPs-A极显著降低尿素氮水平,显著提高干物质、粗蛋白质、粗脂肪消化率。
(4)添加AMPs显著降低肠道大肠杆菌数量,显著提高乳酸杆菌和双歧杆菌数量,间接反映了其能够抑制肠道大肠杆菌的生长和繁殖,增加有益菌数量,维持肠道微生态平衡。
[1]Krismar A,Sahm J,Pfaffl M W,et al.Effects of avilamycin and essential oils on mRNA expression of apoptotic and inflammatory markersand gut microbiology of piglets[J].Czech Journal of Animal Science,2008,53(9):377-387.
[2]Chrubasik S,Pittler M H,Roufogalls B D.Zingiberis rhizoma:a comprehensive review on the ginger effect andefficacyprofiles[J]. Phytomedicine,2005,12(9):684-701.
[3]Planet K,Srinivasan K.Influence of dietary spices or their active principles on digestive enzymes of small intestinal mucosa in rats[J].International Journal of Food Sciences and Nutrition, 1996,47(1):55-59.
[4]Planet K,Srinivasan K.Digestive stimulant-action of spices:a myth or reality[J].The Indian Journal Medical Research,2004, 119(5):167-179.
[5]William H,George W.Official methods of analysis[M].18th ed. US:Association of Official Analytical Chemists,2006:248-256.
[6]Jin Z,Yang Y X,Choi J Y,et al.Effects of potato(Solanum tuberosum L.cv.Golden valley)protein having antimicrobial activity on the growth performance,and intestinal microflora and morphology in weanling pigs[J].Animal Feed Science and Technology,2008,140(1):139-154.
[7]Fujiwara Y,Kaji T.Possible mechanism for lead inhibition of vascular endothelial cell proliferation:a lower response to basic fibroblast growth factor through inhibition of heparan sulfate synthesis[J].Toxicology,1999,133(2):144-157.
[8]Coma J,Carrion D,Zimmerman D R.Use of plasma urea nitrogen as a rapid response criterion to determine the lysine requirement of pigs[J].Journal of Animal Science,1995,73(2):472-481.
[9]顾宪红,张宏福.环境条件对断奶仔猪健康及生产性能的影响[J].动物营养学报,1999(4):22-24.
[10]Papagianni M.Ribosomally synthesized peptides with antimicrobial properties:biosynthesis,structure,function,and applications[J]. Biotechnology advances,2003,21(6):465-499.
[11]Castillo M,Martín-Orúe S M,Roca M,et al.The response of gastrointestinal microbiota to avilamycin,butyrate,and plant extracts in early-weaned pigs[J].Journal of Animal Science,2006, 84(10):2725-2734.
[12]Namkung H,Li J,Gong M,et al.Impact of feeding blends of organic acids and herbal extracts on growth performance,gut microbiota and digestive function in newly weaned pigs[J].Canadian Journal of Animal Science,2004,84(4):697-704.
[13]Manzanilla E G,Nofrarías M,Anguita M,et al.Effects of butyrate, avilamycin,and a plant extract combination on the intestinal equilibrium of early-weaned pigs[J].Journal of Animal Science, 2006,84(10):2743-2751.
[14]Chen X,Zhu F,Cao Y,et al.Novel expression vector for secretion of cecropin AD in bacillus subtillis with enhanced antimicrobial activity[J].Antimicrob Agents Chemotherapy,2009,53(9): 3683-3689.
(编辑:富春妮)
The Research and Application of Plant Extract in Piglets
ZHU Yujing1,WANG Bo1,LI Fangfang1,ZHENG Lili1,GAO Yuan2,MENG Ling2,GUO Fulai2,DING Lan3,ZHANG Yong1
(1.College of Animal Sciences and Veterinary Sciences,Shenyang Agricultural University,Shenyang 110866, China;2.Liaoning Debao Argi-animal Husbandry Co.,Ltd.,Shenyang 110171,China;3.Shen Yang Fukang Agriculture and Animal Husbandry Technology Co.,Ltd.,Shenyang 110164,China)
This test was designed to study the effects of antimicrobial peptides(AMPs)in pig production.180 pigs (10.30±1.13)kg had been randomly divided into 3 groups,and each group 4 repeats,each repeat 15 pigs.The control group was fed based diet,the experimental group were fed basic feeding food with 500 mg/kg AMPs-A and 300 mg/kg AMPs-B.Experiment lasted for 28 days.Results showed that:1)compared with control group,ADG respectively increase 5.66%(P>0.05),3.92%(P>0.05),3.85%(P>0.05)the day of 1~14,15~28,1~28 in AMPs-A. 2)AMPs-A dramatically significantly reduce BUN 14.55%(P<0.01).3)compared with control group,the IgG of AMPs-A and AMPs-B had increased 2.07%(P<0.05)and 1.27%(P<0.05);the TP of AMPs-A and AMPs-B had increased 4.48%(P<0.05)and 4.03%(P<0.05);and AMPs-A significantly increased T lymphatic conversion rates 39.02%(P<0.05)in blood.4)AMPs-A respectively significantly increased DM,CP and EE absorption rate 2.62% (P<0.05),3.95%(P<0.05),3.70%(P<0.05).5)E.coli colony count in pig feces had decreased 5.53%(P<0.05)and 3.77%(P<0.05)in AMPs-A and AMPs-B.Lactobacillus in AMPs-A and AMPs-B has increased 4.94%(P<0.05) and 3.67%(P<0.05),and Bifidobacterium colony count of AMPs-A and AMPs-B had increased 5.61%(P<0.05) and 4.75%(P<0.05).Adding AMPs in daily diet can effectively improve pig growth performance,blood physiological and biochemical indicators feed digestion utilization and improve intestinal microbial balance.The test indicate that adding AMPs-A is better than AMPs-B.
AMPs;weaning pig;production performance;blood physiological and biochemical indices;nutrient digestibility;fecal microflora
S816.7
A
1002-1957(2016)02-0017-04
2015-11-24
国家自然科学基金(31440082和31101253)
朱宇旌(1972-),女,辽宁彰武人,副教授,博士,主要从事动物营养与饲料科学研究工作.E-mail:syndzhyj@163.com
张勇,教授,硕士生导师.E-mail:syndzhy@126.com
