中药周期疗法对多囊卵巢综合征患者性激素和糖脂代谢的影响
2016-12-19徐碧红李茂清陈春玲骆宇戟
徐碧红,李茂清,陈春玲,骆宇戟
1.江门市五邑中医院,广东 江门 529031;2.梅州市残联康复医院,广东 梅州 514000
中药周期疗法对多囊卵巢综合征患者性激素和糖脂代谢的影响
徐碧红1,李茂清2,陈春玲1,骆宇戟1
1.江门市五邑中医院,广东 江门 529031;2.梅州市残联康复医院,广东 梅州 514000
目的 观察中药周期疗法联合炔雌醇环丙孕酮片(达英-35)治疗多囊卵巢综合征(PCOS)临床疗效及其对性激素和糖脂代谢的影响。方法 将74例PCOS患者随机分为西药组和中西药组各37例,西药组予达英-35,中西药组在此基础上加用中药周期疗法,28 d为1个疗程,连续3个疗程。治疗前后及停药3个月观察2组临床症状、性激素和糖脂代谢变化。结果 2组各有2例失访。中西药组愈显率、总有效率优于西药组(P<0.05)。治疗后中西药组各症状评分均下降(P<0.01),2组血清雌二醇均升高(P<0.01),黄体生成激素、睾酮和黄体生成激素/卵泡生成激素下降(P<0.01)。治疗后、停药3个月中西药组临床症状、血清性激素水平改善优于西药组(P<0.01),空腹血糖、空腹胰岛素、三酰甘油、总胆固醇和体质指数降低(P<0.05),优于西药组(P<0.05,P<0.01)。西药组、中西药组不良反应发生率分别为17.1%和5.71%(P<0.05)。结论 中药周期疗法联合达英-35治疗PCOS疗效显著,能明显改善患者临床症状,调节性激素和糖脂代谢紊乱状态,不良反应少。
多囊卵巢综合征;中药周期疗法;性激素;糖脂代谢
多囊卵巢综合征(polycystic ovarian syndromes,PCOS)是由于卵巢卵泡内膜细胞良性增生,引起雄激素分泌过多,造成月经紊乱或不孕,高雄激素症状、卵巢多囊样变、黄体生成激素(LH)/卵泡生成激素(FSH)比值升高,肥胖患者多伴高胰岛素血症和高血脂等的一种内分泌、代谢性疾病。目前PCOS的确切发病机制未完全阐明,尚缺乏有效的治疗方法,已成为妇科内分泌研究领域的难点之一。为此,笔者观察中药周期疗法联合炔雌醇环丙孕酮片(达英-35)治疗PCOS的临床疗效,探讨其对PCOS患者性激素、糖脂代谢的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2013年1月-2014年5月在江门市五邑中医院就诊的PCOS患者74例,采用随机数字表与自愿原则相结合分成西药组和中西药组各37例。西药组年龄18~40岁,平均(29.6±5.8)岁;病程1~6年,平均(3.4±0.9)年;体质指数(BMI)22~30 kg/m2,平均(26.7±3.4)kg/m2。中西药组年龄19~40岁,平均(30.1.±6.0)岁;病程1.5~5.5年,平均(3.5± 0.8)年;BMI 22~29 kg/m2,平均(26.5±3.3)kg/m2。2组患者年龄、病程、BMI比较,差异均无统计学意义(P>0.05),具有可比性。本研究经江门市五邑中医院医学伦理委员会批准,取得患者知情同意并签名。
1.2 诊断标准
1.2.1 西医诊断标准 参照2003年欧洲人类生殖和胚胎与美国生殖医学学会制定的“PCOS鹿特丹诊断标准”[1]:①稀发排卵或无排卵;②高雄激素血症或高雄激素的临床表现(如多毛、痤疮等);③卵巢多囊性改变:B超检查可见一侧或双侧卵巢有直径2~9 mm卵泡≥12个和/或卵巢体积增大(每侧>10 cm3)。符合上述3项中任何2项者即可诊断PCOS。
1.2.2 中医辨证诊断标准 参照《中药新药临床研究指导原则(试行)》[2]“月经后期”“闭经”属肾虚痰阻证型:月经稀发,继发闭经,不孕,肥胖,多毛,嗜睡,乏力,怕冷,腰酸,舌淡胖、苔薄白,脉细。
1.3 纳入标准
①符合PCOS西医诊断标准;②符合中医辨证诊断标准;③年龄18~40岁。
1.4 排除标准
①子宫畸形或先天发育异常者;②有高泌乳素血症、甲状腺疾病、先天性肾上腺皮质增生、雄激素分泌性肿瘤、库欣综合征等内分泌疾病者;③合并心、肝、肾等严重原发病者;④服药出现严重不良反应者;⑤无法坚持服药治疗,依从性差者。
1.5 治疗方法
西药组予达英-35(2 mg/片,拜耳医药保健有限公司,批号120917),自月经第5日开始,每日服1片,连服21 d,停药7 d后重复,连续治疗3个疗程。
中西药组在西药组治疗基础上予中药周期疗法。以右归丸加减(熟地黄20 g,山药15 g,山萸肉15 g,枸杞子15 g,菟丝子15 g,当归15 g,茯苓15 g,陈皮10 g等)为基础方,月经后期(月经周期第6-10日)以基础方加何首乌15 g、白芍10 g、续断15 g等,排卵前期(月经周期第11-14日)以基础方加丹参10 g、泽兰10 g、香附10 g、益母草15 g、川牛膝15 g,排卵后期(月经周期第15-23日)以基础方加续断15 g、巴戟天15 g、杜仲10 g,月经前期(月经周期第24-28日)以基础方加川牛膝15 g、赤芍10 g、香附10 g。每日1剂,水煎至200~300 mL,分2次温服,经期停药。28 d为1个疗程,连续治疗3个疗程。服药期间注意调情志,少进辛辣油腻之品。
1.6 观察指标
1.6.1 月经恢复和排卵情况 观察月经周期、经期、经量、经色及伴随症状;采用基础体温(BBT)和B超监测排卵情况。
1.6.2 临床症状评分 分别于治疗前后及停药3个月参照《中药新药临床研究指导原则(试行)》[2]进行症状评分,记录月经异常(月经稀发、闭经)、腰酸、怕冷、性欲冷淡、肥胖、多毛、小便清长、大便稀烂8个主要症状,按症状无、轻、中、重分别计0、1、2、4分,分值为0~32分,分值越高提示病情越重。
1.6.3 血清学指标(性激素水平、血糖和血脂) 治疗前于月经周期第3~5日,闭经患者B超检查无优势卵泡时采集标本。空腹12 h抽取静脉血,测定性激素[FSH,LH,雌二醇(E2),睾酮(T)],血糖[空腹血糖(FPG)、空腹胰岛素(FINS)]和血脂[总胆固醇(TC),三酰甘油(TG),低密度脂蛋白胆固醇(LDL-C)]。治疗后、停药3个月复查。
1.6.4 安全性指标 治疗前行血常规、B超及肝、肾功能检查,治疗后、停药3个月复查,并记录药物不良反应。
1.7 疗效标准
参照《中药新药临床研究指导原则(试行)》[2]及《妇科疑难病现代中医诊断与治疗》[3]自拟。痊愈:治疗后临床症状、体征消失或基本消失,月经周期恢复正常,其中2个周期BBT双相,停药期间月经维持正常2~3个周期。显效:治疗后临床症状、体征明显改善,月经周期为1~1.5个月,其中2个周期BBT双相,停药期间月经周期维持1~1.5个月。有效:治疗后临床症状、体征均有好转,月经周期为1~2个月,6个月内有1个周期BBT双相,卵巢功能有改善。无效:治疗3个月无月经来潮,临床症状及有关实验室检查均无改善。
1.8 统计学方法
2 结果
2.1 2组临床疗效比较
2组各有2例患者失访。西药组显效9例,有效14例,无效12例,愈显率、总有效率分别为25.7%(9/35)和65.7%(23/35);中西药组痊愈9例,显效15例,有效6例,无效5例,愈显率、总有效率分为68.6%(24/35)和85.7%(30/35)。组间比较差异有统计学意义(P<0.05)。
2.2 2组治疗前后临床症状评分比较
治疗后中西药组各症状评分显著下降(P<0.01),西药组仅月经异常、多毛症状有改善(P<0.01);与治疗后比较,停药3个月中西药组各症状评分无明显变化(P>0.05),而西药组月经异常、多毛症状评分升高(P<0.05,P<0.01),与同期中西药组比较差异均有统计学意义(P<0.01)。结果见表1。
表1 PCOS患者临床症状评分2组治疗前后比较(±s,分)

表1 PCOS患者临床症状评分2组治疗前后比较(±s,分)
注:与本组治疗前比较,*P<0.05,**P<0.01;与本组治疗后比较,△△P<0.01;与西药组同一时点比较,▲P<0.05,▲▲P<0.01(下同)
西药组(35例)中西药组(35例)临床症状治疗前 治疗后 停药3个月 治疗前 治疗后 停药3个月月经异常 2.97±0.45 1.74±0.47**2.51±0.42△△3.00±0.46 1.26±0.39**▲▲1.37±0.40**▲▲腰酸 2.06±0.41 2.03±0.39 1.90±0.40 2.09±0.42 0.97±0.22**▲▲1.06±0.23**▲▲怕冷 2.37±0.52 2.31±0.51 2.31±0.53 2.40±0.53 1.23±0.25**▲▲1.31±0.26**▲▲性欲冷淡 2.54±0.63 2.49±0.60 2.49±0.61 2.60±0.65 1.63±0.38**▲▲1.74±0.40**▲▲肥胖 2.11±0.46 2.08±0.45 2.06±0.45 2.14±0.45 1.77±0.41**▲▲1.83±0.42**▲▲多毛 2.34±0.49 2.03±0.42**2.29±0.45△△2.31±0.50 1.70±0.40**▲▲1.72±0.43**▲▲小便清长 2.57±0.56 2.50±0.55 2.49±0.51 2.60±0.54 1.23±0.29**▲▲1.37±0.32**▲▲大便稀烂 2.23±0.48 2.14±0.51 2.17±0.46 2.26±0.49 1.03±0.21**▲▲1.11±0.22**▲▲总分 19.19±4.01 17.32±3.90 18.22±3.83 19.40±4.04 9.82±2.55**11.51±2.68**▲▲
2.3 2组治疗前后性激素比较
治疗后2组血清E2升高(P<0.01),LH、T和LH/FSH下降(P<0.01),FSH略升高(P>0.05);停药3个月中西药组血E2、LH、FSH、T和LH/FSH无明显变化(P>0.05);而西药组血清E2降低,LH、T和LH/FSH升高,与治疗后比较差异有统计学意义(P<0.01),与同期中西药组比较差异均有统计学意义(P<0.01)。结果见表2。
表2 PCOS患者性激素2组治疗前后比较(±s)
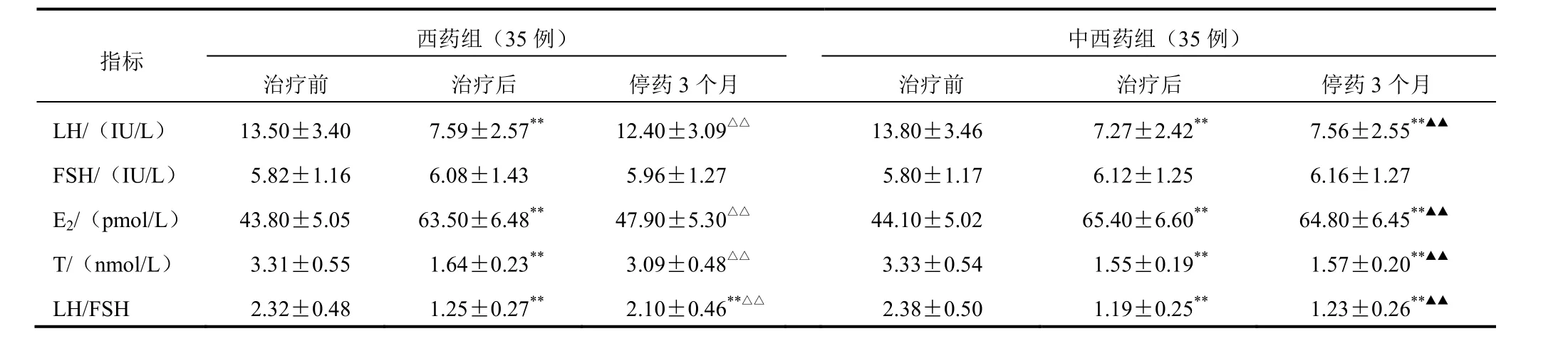
表2 PCOS患者性激素2组治疗前后比较(±s)
西药组(35例)中西药组(35例)指标治疗前 治疗后 停药3个月 治疗前 治疗后 停药3个月LH/(IU/L) 13.50±3.40 7.59±2.57**12.40±3.09△△13.80±3.46 7.27±2.42**7.56±2.55**▲▲FSH/(IU/L) 5.82±1.16 6.08±1.43 5.96±1.27 5.80±1.17 6.12±1.25 6.16±1.27 E2/(pmol/L) 43.80±5.05 63.50±6.48**47.90±5.30△△44.10±5.02 65.40±6.60**64.80±6.45**▲▲T/(nmol/L) 3.31±0.55 1.64±0.23**3.09±0.48△△3.33±0.54 1.55±0.19**1.57±0.20**▲▲LH/FSH 2.32±0.48 1.25±0.27**2.10±0.46**△△2.38±0.50 1.19±0.25**1.23±0.26**▲▲
2.4 2组治疗前后糖脂代谢情况比较
治疗后中西药组FPG、FINS、TG、TC和BMI较治疗前降低(P<0.05),停药3个月上述指标无明显变化(P>0.05);西药组治疗后、停药3个月FPG、FINS、TG、TC和BMI无明显变化(P>0.05)。各指标组间比较差异有统计学意义(P<0.05,P<0.01)。结果见表3。
2.5 安全性评价
西药组有4例乳房胀痛,2例头痛,不良反应发生率为17.1%;中西药组有2例患者头晕,不良反应发生率为5.71%,上述患者经对症治疗后病情缓解。未见严重心血管、血液系统疾病和肝、肾功能异常。
表3 PCOS患者糖脂代谢指标2组治疗前后比较(s)
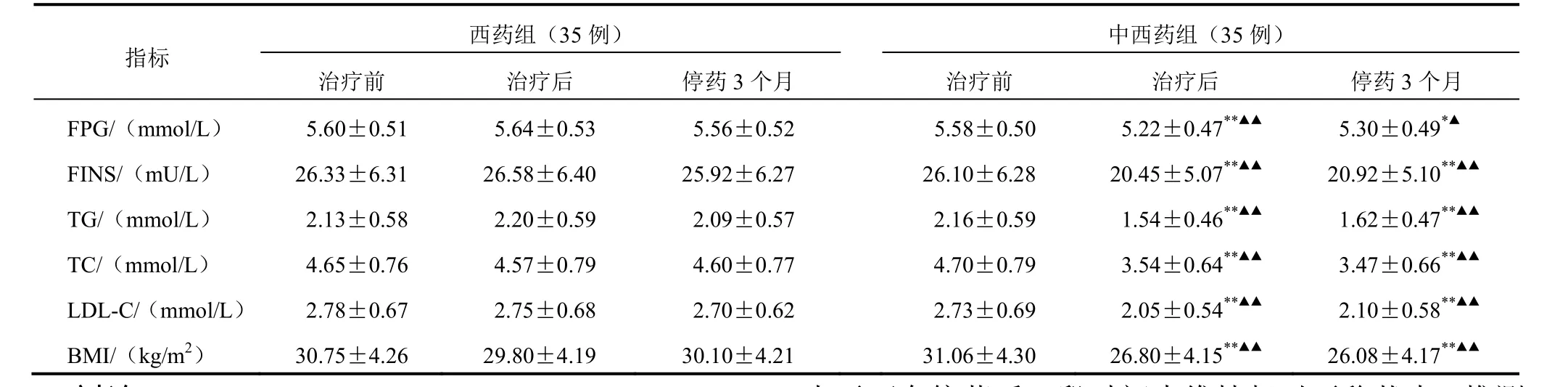
表3 PCOS患者糖脂代谢指标2组治疗前后比较(s)
西药组(35例)中西药组(35例)指标治疗前 治疗后 停药3个月 治疗前 治疗后 停药3个月FPG/(mmol/L) 5.60±0.51 5.64±0.53 5.56±0.52 5.58±0.50 5.22±0.47**▲▲5.30±0.49*▲FINS/(mU/L) 26.33±6.31 26.58±6.40 25.92±6.27 26.10±6.28 20.45±5.07**▲▲20.92±5.10**▲▲TG/(mmol/L) 2.13±0.58 2.20±0.59 2.09±0.57 2.16±0.59 1.54±0.46**▲▲1.62±0.47**▲▲TC/(mmol/L) 4.65±0.76 4.57±0.79 4.60±0.77 4.70±0.79 3.54±0.64**▲▲3.47±0.66**▲▲LDL-C/(mmol/L) 2.78±0.67 2.75±0.68 2.70±0.62 2.73±0.69 2.05±0.54**▲▲2.10±0.58**▲▲BMI/(kg/m2) 30.75±4.26 29.80±4.19 30.10±4.21 31.06±4.30 26.80±4.15**▲▲26.08±4.17**▲▲
3 讨论
PCOS临床表现呈异质性,是以性腺轴功能失调为主的内分泌、神经和代谢紊疾病,甚至会导致乳腺癌、子宫内膜癌、代谢综合征和心血管疾病等远期并发症[4]。有研究发现,肥胖PCOS患者以高雄激素血症和胰岛素抵抗较为严重,内分泌紊乱更显著,与胰岛素抵抗密切相关的代谢综合征的发病风险会增加[5]。POCS治疗目前主要使用激素类药物调整月经周期、促排卵或手术治疗,但激素类药物治疗不良反应多、远期疗效不佳,手术治疗费用较高且易引起卵巢过度刺激征[6-7]。因此,如何恢复PCOS患者的卵巢排卵功能,改善胰岛素抵抗状态,纠正糖脂代谢异常,预防或减少远期并发症已成为PCOS治疗的研究焦点。
根据其临床症状,PCOS属中医“月经后期”“闭经”“不孕”等范畴。若先天肾气不足,或房劳多产或久病伤肾,损伤冲任;肾虚则气化无力,气机升降失常,而产生痰湿、瘀血等病理现象,影响肾-天癸-冲任-胞宫性腺轴的平衡,就会出现月经失调、闭经、不孕等症。笔者根据月经周期不同阶段的阴阳转化、消长和气血盈亏变化规律,采用右归丸加减为基础方,以温补肾阳,化痰活血为治则辨证用药治疗本病。月经后期属于肾阴增长期,胞宫空虚,冲任不充,方加予养精血、滋肾阴中药,为卵泡生长发育提供了支持;排卵前期为重阴转阳、阴盛阳动,方加予补肾活血中药,有利于排卵;排卵后期阴盛阳生,阳盛渐至重阳,方加予温补肾阳中药,为种子、育胎作好准备;经前期加予补肾活血化瘀中药,促进经血下泄。
本研究结果显示:①中西药组在恢复正常月经、促进排卵和改善临床症状方面的疗效优于西药组。②2组均能不同程度改善患者性激素水平,达英-35能改善PCOS患者高LH和高雄激素状态,解除卵泡发育抑制。与文献[8]研究结果一致。中西药组的性激素水平可在停药后一段时间内维持相对平稳状态,推测中药可能通过调节下丘脑-垂体-卵巢-子宫性腺轴作用,促使卵泡发育、成熟和排卵,改善内分泌紊乱状态[9]。③中药可通过整体调节作用改善机体糖脂代谢紊乱状态,而达英-35无此作用。④中药治疗可减少达英-35的不良反应,有利于提高患者治疗的依从性。
综上所述,中药周期疗法联合达英-35治疗PCOS疗效显著,能明显地改善患者的临床症状,调节性激素和糖脂代谢紊乱状态,也可减少西药的不良反应,停药后不易复发。
[1] The Rotterdam ESHRE/ASRM-sponsored PCOS Consensus-Workshop Group. Revised 2003 consensus on diagnostic criteria and longterm health risks related to polycystic ovary syndrome (PCOS)[J]. Hum Reprod,2004,19:41-47.
[2] 郑筱萸.中药新药临床研究指导原则(试行)[M].北京:中国医药科技出版社,2002:385-389.
[3] 程泾.妇科疑难病现代中医诊断与治疗[M].北京:人民卫生出版社, 2003:247-257.
[4] 许丽凤.加味二陈汤联合中药周期疗法治疗肾虚痰湿肥胖型多囊卵巢综合征临床研究[D].广州:广州中医药大学,2012.
[5] 徐碧红,张凤.肥胖与非肥胖多囊卵巢综合征患者内分泌激素对比研究[J].华南国防医学杂志,2011,28(5):450-451.
[6] 拜如霞.中西医结合治疗多囊卵巢综合征并发不孕症的临床观察[D].昆明:云南中医学院,2013.
[7] 苏丹,张晋峰,侯丽辉,等.多囊卵巢综合征治疗研究进展[J].中国中西医结合杂志,2013,33(2):286-288.
[8] 汪莎,谢靳.中药周期疗法联合达英-35治疗多囊卵巢综合征不孕的临床研究[J].湖北中医杂志,2010,32(2):14-15.
[9] 徐碧红,李茂清,骆宇戟,等.补肾调经方配合激素替代疗法治疗卵巢早衰患者的临床观察[J].中国中西医结合杂志,2013,33(10):1326-1329.
Effects of TCM Periodic Therapy on Sex Hormone, Glucose and Lipid Metabolism of Patients with Polycystic Ovary Syndrome
XU Bi-hong1, LI Mao-qing2, CHEN Chun-ling1, LUO Yu-ji1
(1. Wuyi TCM Hospital of Jiangmen, Jiangmen 529031, China; 2. FIMITIC Rehabilitation Hospital of Meizhou, Meizhou 514000, China)
Objective To observe the clinical efficacy of TCM periodic therapy combined with estradiol progesterone tablets (Diane-35) in the treatment for polycystic ovary syndrome (PCOS), and its effects on serum sex hormone, glucose and lipid metabolism. Methods Totally 74 patients with PCOS were randomly divided into Western medicine (WM) group and Chinese and Western medicine (CWM) group, 37 cases in each group. WM group was given Diane-35, while CWM group was treated with TCM periodic therapy additionally, for three courses, 28 d of one course. Clinical symptoms, sex hormones and glucose and lipid metabolism of two groups were observed before and after treatment and withdrawal treatment for 3 months. Results Two patients in each group were lost to follow-up. Markedly effective rate and total efficiency rate of CWM group were better than WM group (P<0.05). After treatment, symptom integrals of CWM group decreased significantly (P<0.01). Serum E2increased (P<0.01), while LH, T and LH/FSH decreased in two groups (P<0.01). After treatment and withdrawal treatment for 3 months, improvement of clinical symptoms and sex hormone levels in CWM group was superior to CM group (P<0.01), FPG, FINS, TG, TC and BMI of CWM group decreased in CWM group (P<0.05), and lower than that of CM group (P<0.05, P<0.01). Adverse reaction rates of WM group and CWM group were 17.1% and 5.71% (P<0.05). Conclusion Efficacy of TCM periodic therapy combined with Diane-35 in treatment of PCOS is significant, which can obviously improve patients’clinical symptoms, and regulate hormone and lipid metabolism disorders, with fewer adverse reactions.
polycystic ovary syndrome; TCM periodic therapy; sex hormone; glucose and lipid metabolism
10.3969/j.issn.1005-5304.2016.01.008
R271.917.51
A
1005-5304(2016)01-0035-04
2015-03-03)
(
2015-03-19;编辑:陈静)
江门市科技计划项目(2013年)
李茂清,E-mail:329473003@qq.com
