两广部分地区仔猪腹泻死亡的流行病学调查
2016-12-19罗亚坤练斯南蔺文成梁琳史利军赵占中白挨泉崔尚金
罗亚坤,练斯南,蔺文成,梁琳,史利军,赵占中,白挨泉,崔尚金
(1.中国农业科学院北京畜牧兽医研究所,北京海淀100193;2.农业部兽用药物与兽医生物技术北京科学观测实验站,北京海淀100193;3.佛山科学技术学院,广东佛山528231;4.华南农业大学动物科技学院,广东广州510642)
两广部分地区仔猪腹泻死亡的流行病学调查
罗亚坤1,2,练斯南1,3,蔺文成4,梁琳1,2,史利军1,2,赵占中1,2,白挨泉3,崔尚金1,2
(1.中国农业科学院北京畜牧兽医研究所,北京海淀100193;2.农业部兽用药物与兽医生物技术北京科学观测实验站,北京海淀100193;3.佛山科学技术学院,广东佛山528231;4.华南农业大学动物科技学院,广东广州510642)
研究旨在分析广东、广西地区2015年1—10月份腹泻仔猪群中猪流行性腹泻病毒(PEDV)、猪伪狂犬病病毒(PRV)发病情况和流行特征,以便为今后的防控提供理论数据。分别采用RT-PCR检测PEDV、用NanoPCR方法检测PRV,对2015年1—10月份广东、广西地区7个地市临床送检的56份组织样品(包括心、肝、脾、肺、肾、淋巴等,其中有35份含有小肠样品)进行病原核酸检测。病原核酸检测结果显示:PEDV的阳性率为14.28%,PRV的阳性率为53.6%;PEDV与PRV混合感染率为8.57%。对PEDV阳性样品的S1基因进行遗传进化分析,结果显示,研究获得PEDV阳性样品的S1基因与2015年广东分离的CH-HGC-01-2015的亲缘关系较近。由此可见,广东、广西地区PRV发病率较高,PEDV的发展呈新的流行态势,并且存在PEDV和PRV的混合感染。
猪病流行性腹泻病毒;猪伪狂犬病病毒;流行病学调查;克隆;序列分析
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种严重的病毒性传染病。该病的临床症状一般表现为严重的水样腹泻,并伴有呕吐现象,全身脱水明显,粪便稀且呈黄色或灰黄色。病猪精神萎靡,眼窝下陷,食欲减退或废绝,病猪在腹泻3~4 d后会因严重脱水而死亡,并且致死率极高[1]。自1971年英国首次报道PED之后在日本、德国、比利时等地相继暴发。1976年,我国首次报道了该病。在之后的20年间,该病已在我国的20多个省份暴发,给养猪业造成了巨大的损失。在我国,各阶段的猪群都极易感染PEDV[2-3]。在春季和冬季,保育与肥育猪PEDV的感染率高于哺乳仔猪和母猪[4]。PEDV基因组是单股正链RNA,基因组序列包括6个ORF,从5'→3'依次为编码复制酶多聚蛋白lab、纤突蛋白、ORF3蛋白、小膜蛋白、膜糖蛋白和核衣壳蛋白的基因[5]。S蛋白可划分为S1区(1~789位氨基酸)和S2区(790~1 383位氨基酸)[6]。其中S1可以识别宿主细胞的特异性受体并与之结合,S2结构域的作用为促进细胞膜与病毒膜的融合[7]。S1基因的变化能体现病毒的变异情况,所以有必要对PEDV S1基因进行研究[8-9]。
猪伪狂犬病(Pseudorabies,PR)是由猪伪狂犬病病毒(Pseudorabies virus,PRV)引起的以发热、流产、死产及脑脊髓炎等为主要临床症状的急性败血性传染病,对猪群危害严重。自2011年以来,猪群中有许多已经免疫了gE基因缺失活疫苗的规模化猪场出现了母猪产弱仔、死胎、流产,仔猪出现神经症状及死亡等疑似伪狂犬病的临床症状,其中也有PR的局部暴发,并呈上升趋势,给养猪业造成了严重的经济损失[10]。病毒基因组为双链DNA,大小约为150 kb,可以编码70~100种病毒蛋白。在众多的病毒蛋白中,gB蛋白是该病毒糖蛋白中最保守的糖蛋白,无论是强毒株还是疫苗株,在复制过程中都必须有gB基因的参与[11-12]。
为了解广东、广西地区2015年猪流行性腹泻和伪狂犬病的流行情况,本研究对2015年1—10月广东、广西部分地区猪疑似腹泻和疑似伪狂犬病组织样品,采用RT-PCR和NanoPCR技术进行病原调查,旨在为广东、广西地区猪流行性腹泻和伪狂犬病的综合防控提供参考。
1 材料和方法
1.1 病料来源
采集2015年1—10月广东、广西部分地区7个地市56份组织样本(包括心、肝、脾、肺、肾、淋巴,其中有35份含有小肠样品),并置于-80℃冰箱内保存以备用。
1.2 主要试剂
组织/细胞基因组DNA提取试剂盒购自天根生物科技有限公司;NanoPCR GREDBIO(NPK02)试剂盒购自山东大正医疗器械股份有限公司;总RNA提取试剂盒、2×Taq Mix、抑制剂、Oligod(T)15、dNTPs、DNA Marker,pMD-19T载体购自TAKARA公司;TRIzol试剂和反转录酶M-MLV,购自Promega公司;2×Easy Taq PCR Supper Mix,DH5α感受态细胞购自北京全式金生物技术有限公司;其他试剂均为国内分析纯。
1.3 引物设计
根据GenBank收录的PEDV S1基因(登录号:AF353511)、PRV gB序列(登录号:NC_006151),应用Oligo6.0软件设计引物,见表1,送北京华大科技有限公司合成。
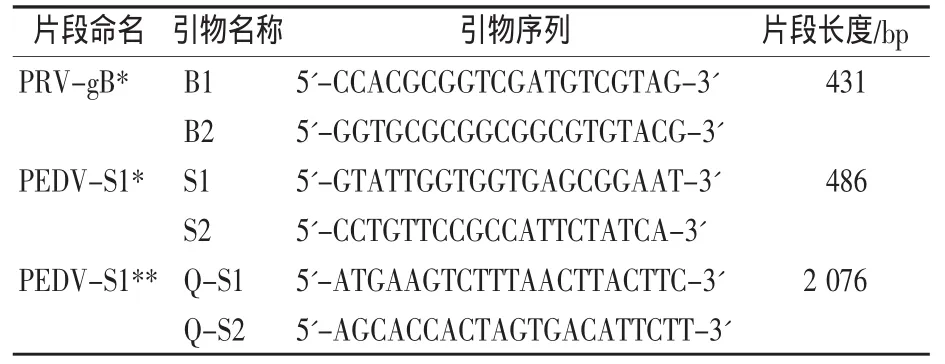
表1 引物序列
1.4 病毒RNA和DNA的提取及病原检测
小肠样本总RNA提取操作步骤按照TAKARA MiniBest Universal RNA Extraction Kit(Cat:#9767)说明书进行(所有移液吸头和EP管均为DNase&RNase-Free)。通过反转录合成cDNA,然后进行PCR的扩增,反应体系如下:cDNA 2.0 μL,2× Easy Taq PCR Supper Mix 10.0 μL,S1(10 μM)1.0 μL,S2(10 μM)1.0 μL,灭菌ddH2O补至20 μL。PCR扩增条件如下:90℃预变性3 min,94℃变性30 s,56℃退火30 s,72℃延伸1 min,共计30个循环,72℃延伸10 min。组织样本基因组DNA提取操作步骤按照TIANamp组织/细胞基因组DNA提取试剂盒(Cat:#DP304-03)说明书操作。然后参考Ma等[13]方法进行nanoPCR扩增,反应体系:2×nano buffer 10.0 μL,B1(10 μM)1.0 μL,B2(10 μM)1.0 μL,Taq DNA polymerase(5 U/L)1.0 μL,组织DNA 1.0 μL,灭菌ddH2O补至20 μL。将PCR扩增产物10 μL通过1.0 g/100 mL的琼脂糖凝胶电泳进行检测。
1.5 PCR产物克隆、测序以及PEDV S1基因遗传进化分析
以PEDV检测为阳性样品的cDNA为模板,分别以Q-S1、Q-S2为引物对S1基因进行PCR扩增,PCR产物经1.0 g/100 mL琼脂糖凝胶电泳进行鉴定后,克隆至pMD19-T载体中,转化后挑取阳性克隆,进行PCR和酶切鉴定,送至北京华大基因科技有限公司进行测序。测序结果与GenBank中登录的PEDV S1基因的核苷酸进行同源性分析,用CLUSTAL和Mega 6等软件进行遗传进化树分析,参考序列见表2。
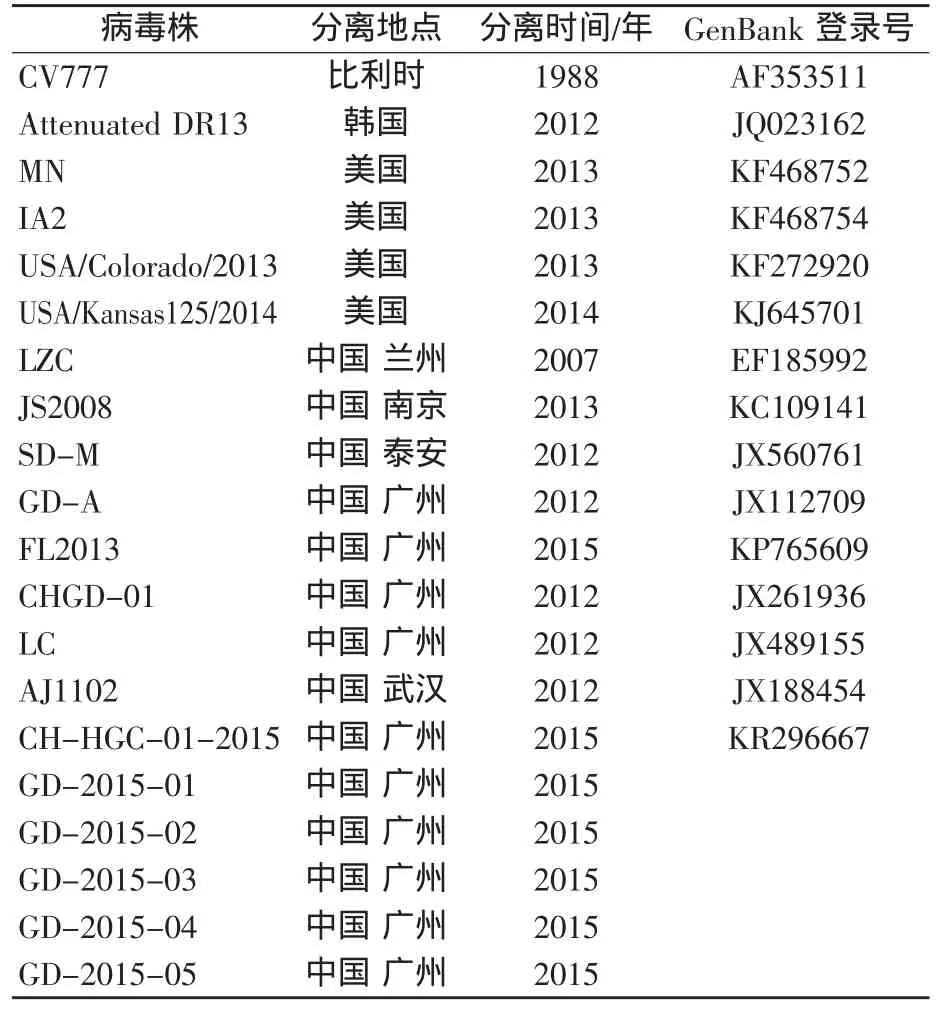
表2 PEDV参考序列
2 结果
2.1 PEDV病原核酸检测结果
采用RT-PCR扩增的方法将来自广东、广西地区临床送检的35份小肠样品进行了PEDV的检测,检测重复3次,结果一致。通过表3可看出,广东、广西地区养猪场猪群PEDV的阳性率为14.28%(5/35)。由数据看出,广东地区的大沥PEDV阳性率最高为28.57%,化州市和惠州市次之。花都、肇庆以及广西地区的陆川市在本次检测中没有检测出PEDV的阳性样品。

表3 PEDV检测结果
2.2 PRV病原核酸检测结果
采用NanoPCR扩增检测PRV,将来自于广东、广西地区临床送检的56份组织样品进行了检测,检测重复3次,结果一致。通过表4可看出,广东、广西地区养猪场猪群PRV的阳性率为53.6%(30/56)。由数据看出,PRV的阳性率较高,感染严重,流行范围广,其中广东化州市PRV发病率在本次检测中最高达到80%,肇庆最低为25%。
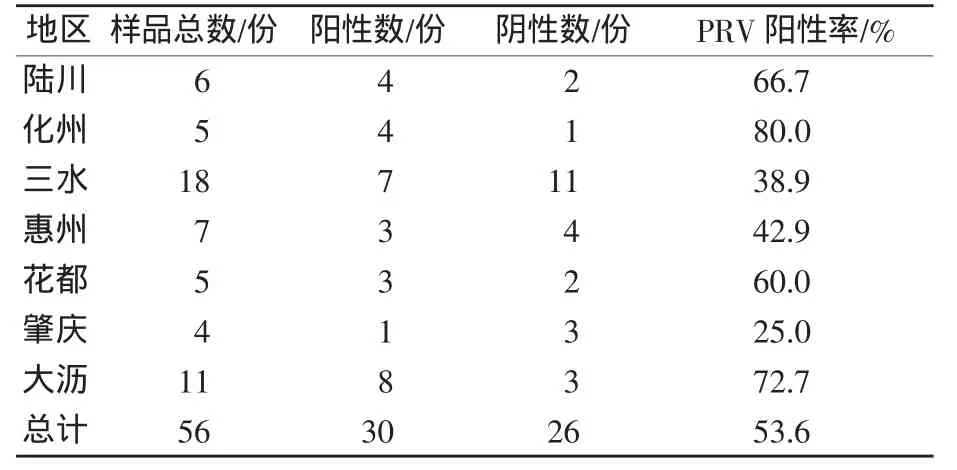
表4 PRV检测结果
2.3 PEDV和PRV混合感染检测结果
对广东、广西地区临床送检56份组织样本中的35份小肠样本进行了PEDV和PRV混合感染情况调查检测(表5)。检测重复3次,结果一致。从表5可看出,PEDV与PRV有混合感染的情况,本次检测中混合感染率为8.57%。

表5 PEDV和PRV混合感染检测结果
2.4 PEDV S1基因遗传进化分析
将5个PEDV检测阳性样品PCR产物克隆后由北京华大公司测序,S1大小均为2 076 bp。5个病毒株命名分别为:GD-2015-01,GD-2015-02,GD-2015-03,GD-2015-04和GD-2015-05。测序结果与GenBank中登录的PEDV S1基因的核苷酸进行同源性分析(参考序列见表2),用CLUSTAL和Mega 6软件NJ法进行遗传进化树分析(图1)。基因进化树分析结果显示,21个PEDV病毒株分为2个大群,即:Pandemic Group和Classical Group;Pandemic Group群又分为两个亚型1和2,广东地区流行的PEDV毒株都分布在Pandemic Group群中1亚型,比对结果与Zhang等[14]的比对结果一致。而本研究测序的5个PEDV病毒株与在2015年广东分离的CH-HGC-01-2015株及在美国2014年分离的USA/ Kansas125/2014株分布在同一分支,即Pandemic Group群中2亚型,亲缘关系较近。其他的中国病毒株(除LZC病毒株外)与欧洲病毒株CV777亲缘关系较远,与其他学者报道基本一致[15-16]。
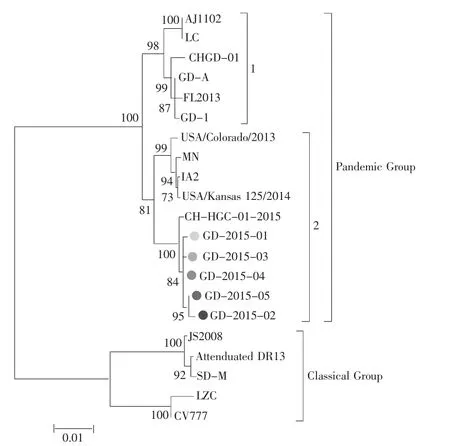
图1 国内外PEDV病毒株S1基因序列遗传进化树
3 讨论
PEDV属于Ⅰ型冠状病毒,是引起仔猪腹泻疾病的主要病原,仔猪感染后具有较高的死亡率[17]。PEDV于1971年由Pensaert等[18]首次报道于英国,自20世纪80年代后期在我国呈现出大面积流行,多与猪传染性胃肠炎病毒(Porcine transmissible gastroenteritis virus,TGEV)、轮状病毒(Porcine rotavirus)等其他肠道病毒混合感染,对养猪业造成极大危害[19-20]。2010年底至今,首先在广东等华南部分地区流行,随后蔓延至全国的哺乳仔猪“顽固性腹泻”疾病,表现为7日龄内仔猪呕吐、水样腹泻、肠道出血、发病率高、死亡率高,产房母猪不表现任何临床症状,二次感染的新流行特点[21]。PEDV S蛋白具有较高的变异性和能诱导机体产生保护性中和抗体的主要免疫蛋白。S基因变异性较大,在分析PEDV流行性毒株的遗传变异和流行情况中发挥重要的作用[22-23]。
猪是PRV的贮存宿主,病猪、带毒猪是该病的主要传染源,带毒鼠类也是该病重要的传染源。PRV只有一个血清型,耐过的猪会终身带毒,会因应激而将感染的病毒活化。伪狂犬病病毒可引起猪发热、奇痒、脑脊髓炎。仔猪一旦患病,死亡率高达100%。gB为PRV最保守的糖蛋白之一,同时也是PRV的一个重要包膜组分和中和抗原,对于病毒的感染必不可少。因此可以选择gB基因作为检测PRV的分子探针[24]。
本研究对广东、广西地区疑似PRV、PEDV感染的临床送检的56份组织样品,其中有35份含有小肠组织样品,分别应用RT-PCR和NanoPCR方法对PRV、PEDV进行病原检测。检测结果表明,PEDV的阳性率为14.28%,PRV的阳性率为53.6%;同时,存在PRV和PEDV的混合感染,其阳性率为8.57%。本次样品检测结果PRV阳性率较高,主要是因为送检的病料来自小规模的猪场,这些猪场的对疫病的防疫和饲养管理水平均较低,可能是导致猪群PRV的感染率较高的原因之一。对本研究中测序的5个PEDV毒株的遗传进化树分析可知,2015年在广东地区流行病毒株基因发生变异,并与美国分离的毒株有联系,但其基因变异机制尚需进一步研究和证实。
总之,本次对2015年1—10月广东、广西部分地区PEDV、PRV的初步筛查为下一步两广地区,乃至整个华南地区PED和PR的防控提供参考。
[1]林忠武.猪流行性腹泻的流行特点及其防治措施[J].福建畜牧兽医,2011,33:14-15.
[2]甘振磊,汤德元,李春燕,等.猪流行性腹泻流行特点及流行现状的研究[J].猪业科学,2010,27:24-28.
[3]王靓靓,李训良,李鹏冲,等.猪流行性腹泻的诊断与预防[J].世界华人消化杂志,2013,21(1):33-38.
[4]张坤.猪病毒性腹泻多重RT-PCR诊断方法的建立和应用及猪轮状病的的分离[D].武汉:华中农业大学,2010.
[5]陈建飞,王承宝,时洪艳,等.猪流行性腹泻病毒的分子流行病学研究[C]//中国畜牧兽医学会畜牧兽医生物技术学分会暨中国免疫学会兽医免疫分会第八次学术研讨会论文集,2010:203-206.
[6]Timoney J F,Gillespie J H,Scott F W,et al.Microbiology and infectious disease of domestic animals[J].Comstock Publishing Associate Ithaca,1988,8:897-898.
[7]Sun D B,Feng L,Shi H Y,et al.Spike protein region(aa 636789) of porcine epidemic diarrhea virus is essential for induction of neutralizing antibodies[J].Acta Virologica,2007,51(3):149-156.
[8]Shibata I,Tsuda T,Mori M,et al.Isolation of porcine epidemic diarrhea virus in porcine cell cultures and experimental infection of pigs of different ages[J].Vet Microbiol,2000,72(3-4):173-182.
[9]刘洋,库旭钢,刘晓丽,等.猪流行性腹泻病和猪圆环病毒病混合感染的诊治[J].中国畜牧兽医,2015,42(10):2753-2761.
[10]梁琳,李明昕,崔尚金.猪伪狂犬变异株与经典株的流行特点比较及防治策略[J].饲料与畜牧:规模养猪,2015,10(2):52-54.
[11]Muller T,Klupp B G,Freuling C,et al.Characterization of pseudorabies virus of wild boar origin from Europe Epidemiol[J].Infect,2010,138(11):1590-1600.
[12]朱淑芬.伪狂犬病毒gB基因在毕赤酵母中的表达及初步应用[D].泰安:山东农业大学,2012.
[13]Ma X,Cui Y C,Qiu Z,et al.A nanoparticle-assisted PCR assay to improve the sensitivity for rapid detection and differentiation of wild-type pseudorabies virus and gene-deleted vaccine strains[J].J Virol Methods,2013,193:374-378.
[14]Zhang X B,Pan Y F,Wang D D,et al.Identification and pathogenicity of a variant porcine epidemic diarrhea virus field strain with reduced virulence[J].Virol J,2015,12:88.
[15]Wei Z Y,Lu W H,Li Z L,et al.Complete genome sequence of novel porcine epidemic diarrhea virus strain GD-1 in China[J].Virol J,2012,86(24):13824-13825.
[16]Pan Y F,Tian X Y,Li W,et al.Isolation and characterization of a variant porcine epidemic diarrhea virus in China[J].Virol J, 2012,9:195.
[17]张强敏,郭福生,尹燕博,等.猪流行性腹泻病毒分子生物学特征[J].中国病毒学,2002,17(4):381-384.
[18]Pensaert M,Debouck P.A new Coronavirus like particle associated with diarrhea in Swine[J].Arch Virol,1978,58:243-247.
[19]陈如敬,吴学敏,车勇良,等.猪流行性腹泻病毒FJ-11株的分离与ORF3基因序列分析[J].福建农业学报,2011,26(6):947-951.
[20]Puranavehja S,Poolperm P,Lertwatchararsarakul P,et al.Chineselike strain of porcine epidemic diarrhea virus,Thailand[J].E-merg Infect Dis,2009,15(7):1112-1115.
[21]蔡汝健,张乐宜,宋长绪.2010—2013年华南地区猪流行性腹泻病流行情况调查及防控效果[J].广东农业科学,2013(11):104-105.
[22]Park S J,Song D S,Ha G W,et al.Cloning and further sequence analysis of the spike gene of attenuated porcine epidemic diarrhea virus DR13[J].Virus Genes,2007,35(1):55-64.
[23]Timoney J F,Gillespie J H,Scott F W,et al.Microbiology and infectious disease of domestic animals[J].Comstock Publishing Associate Ithaca,1988,8:897-898.
[24]罗亚坤,崔尚金.猪伪狂犬病病毒和猪博卡病毒混合感染的检测[J].猪业科学,2014(9):40-42.
(编辑:富春妮)
他汀类药物可抵御P M2.5危害
【美国《科学美国人》月刊网站11月24日报道】题:他汀类药物可以保护人们免受空气污染的危害
他汀类药物常被用来降低胆固醇,减少心脏病和中风的风险。它们似乎还能够缓解人们吸入空气颗粒物之后出现的炎症。
美国肺脏学会高级医疗顾问诺曼·埃德尔曼说:“空气中的颗粒物大量增加会对健康造成严重影响。他汀类药物似乎不仅能保护肺部免受影响,而且能够保护心脏。”
加拿大不列颠哥伦比亚大学肺脏专家斯蒂芬·范埃登副教授介绍说,虽然医生不能通过开药的方式保护人们免受空气污染的危害,但已有多项研究证明,如果服用他汀类药物,血液内某种蛋白质的数量就会减少,而这种蛋白质正是人体组织发炎的标志物。此类炎症有可能加重呼吸和心血管疾病。美国加利福尼亚州环境健康风险评估办公室的流行病学专家巴特·奥斯特罗说,他们考察了1 923名美国女性,发现服用他汀类药物的人可能避免PM2.5的炎症效应。
范埃登的研究小组让实验兔摄入他汀类药物,然后将其放入颗粒物环境,结果药物降低了肺部炎症的水平。在另一组兔子实验中,他汀类药物似乎有助于清除肺部的大颗粒。
(转自参考消息[N],2014-11-27)
S858.28
A
1002-1957(2016)01-0101-04
2016-01-06
中国农业科学院创新工程项目(ASTIP-IAS15)
罗亚坤(1992-),男,黑龙江哈尔滨人,在读硕士研究生,研究方向为动物传染病学与分子流行病学.E-mail:lykxbumtozs@163.com
崔尚金,博士生导师,研究员,研究方向为动物疫病防控.E-mail:cuishangjin@126.com
