CHD患者PCI术后氯吡格雷治疗与出血事件发生和TIAM2基因突变的关系及其影响因素*
2016-12-19张虹
张 虹
(河北大学附属医院心电图室,河北保定 071000)
·论 著·
CHD患者PCI术后氯吡格雷治疗与出血事件发生和TIAM2基因突变的关系及其影响因素*
张 虹
(河北大学附属医院心电图室,河北保定 071000)
目的 探讨冠状动脉性心脏病(CHD)患者经皮冠状动脉介入术(PCI)后应用氯吡格雷治疗发生出血事件与T细胞淋巴瘤侵袭转移因子2(TIAM2)基因突变的关系及影响出血事件的相关因素。方法 选取该院心血管内科行急诊PCI后采用氯吡格雷治疗的200例CHD患者,进行随访观察半年,7例患者失访,根据是否发生出血事件分为出血组33例,未出血组160例,采用聚合酶链反应(PCR)测定TIAM2基因型,分析TIAM2基因型与出血事件的关系,并分析出血事件的相关因素。结果PCR法测得TIAM2基因出现3个位点有等位基因出现突变,分别为:3168+3261A>G、3168+3116C>T、3168+3596A>C,分别统计分析这3个位点等位基因各种基因构成在出血组和未出血组间的差异,结果差异均无统计学意义(P>0.05)。Logistic回归模型进行分析:消化道溃疡病史(OR=2.096),入院前诊断为急性冠脉综合征(ACS)的(OR=1.842),应用血小板糖蛋白(GP)Ⅱb/Ⅲa拮抗剂(OR=1.692)是CHD患者PCI后应用氯吡格雷治疗发生出血事件的危险因素(P<0.05)。结论CHD患者PCI后应用氯吡格雷治疗发生出血事件与消化道溃疡病史,入院前诊断为ACS,应用GPⅡb/Ⅲa拮抗剂有关,与TIAM2基因突变无关。
冠状动脉性心脏病;经皮冠状动脉介入术;氯吡格雷;出血事件;TIAM2基因
冠状动脉性心脏病(coronary heart disease,CHD)可致冠状动脉腔因粥样硬化而阻塞,造成心肌缺血及缺氧,并诱发心脏动脉痉挛或心肌缺血性损伤,危急患者生命[1-2]。经皮冠状动脉介入术(PCI)被广泛CHD等各类冠心病治疗中,疗效显著,能够明显改善患者心肌缺血,降低病死率,但其可致患者术后出现支架内血栓(stent thrombosis,ST)[3-4]。氯吡格雷常被用于预防CHD患者PCI术后心脏血栓形成,但研究显示,T细胞淋巴瘤侵袭转移因子2(TIAM2)基因能够影响氯吡格雷抗血小板凝结效果[5]。因此,本文选择出血事件作为反映抗血小板疗效检测指标,采取TIAM2基因突变干预CHD患者PCI术后服用氯吡格雷,并对治疗后患者出血事件相关因素进行了分析。
1 资料与方法
1.1 一般资料 选取本院心血管内科行急诊PCI后采用氯吡格雷治疗的200例CHD患者,进行随访观察半年,7例患者失误。根据是否发生出血事件分为出血组33例,未出血组160例。出血组33例患者,其中男20例,女13例,年龄53~72岁,平均年龄(63.2±7.6)岁。未出血组160例患者,其中男102例,女58例,年龄49~74岁,平均年龄(62.7±7.3)岁。两组的年龄、性别差异无统计学意义(P>0.05)。纳入标准:(1)CHD患者的诊断标准依据美国心脏病学会/美国心脏病协会(AHA/ACC)的诊断标准,经冠脉造影检查证实至少有一支冠脉血管的狭窄程度大于或等于50%[6];(2)PCI成功的标准,患者心肌缺血的症状消失,PCI后冠脉狭窄程度小于20%,TIMI血流分级达到3级,未见严重并发症;(3)患者按照医嘱应用氯吡格雷规律治疗;(4)本研究取得研究对象的知情同意。排除标准:(1)对本研究治疗药物具有严重禁忌证的患者;(2)术前1周应用抗凝药物治疗的患者;(3)具有活动性出血倾向或凝血功能障碍的患者、既往合并脑血管疾病的患者;(4)未能按照本研究规定服用氯吡格雷治疗的患者。
1.2 方法
1.2.1 资料收集 收集并统计纳入研究对象的年龄、性别、伴随疾病等基本情况,采用电话、门诊随诊的方式对患者进行随访观察,出血事件即为本次随访观察的终点事件,随访时间最长6个月,出血事件主要包括:皮肤黏膜出血、牙龈出血、消化道出血、脑出血等。
1.2.2 基因测序 取经PCI术患者空腹静脉血5 mL滴入含EDTA-K2抗凝管内,4 ℃下3 200 r/min离心10 min获取血清,Gentra Puregene Blood Kit试剂盒提取血清DNA,试剂盒购于武汉博士德生物工程有限公司。选择FASTSNP软件检测启动子区基因变异情况并评分,采取PCR发测定TIAM2启动子区功能性的基因分区,设定引物如下,正向:5′-GGA GGA ACC ATG TGG CAT AC-3′,反向:5′-AGA GTC CCC CAA GCT ACC AT-3′。反应体系总量26 μL,含GO TAQ MASTER Mix 13 μL,5 μmol/L 反向引物 1 μL,5 μmol/L 正向引物 1 μL,DNA 2.3 μL,双蒸水 8.7 μL。反应条件:95 ℃预变性5 min,热循环96 ℃变性30 s,58 ℃退火45 s,73 ℃延伸1 min,共42个循环,73 ℃延伸6 min,4℃保存,选择PCR产物作Sanger测序。

2 结 果
2.1TIAM2基因变异位点与CHD患者PCI后应用氯吡格雷治疗出血的相关性PCR法测得TIAM2基因出现3个位点有等位基因出现突变,分别为:3168+3261A>G、3168+3116C>T、3168+3596A>C,根据基因测序结果发现,这3个位点的等位基因突变处于完全连锁的状态,分别有突变纯合型、野生纯合型、突变杂合性构成,这3个位点等位基因各种基因构成在出血组和未出血组间比较,差异均无统计学意义(P>0.05),见表1、图1。
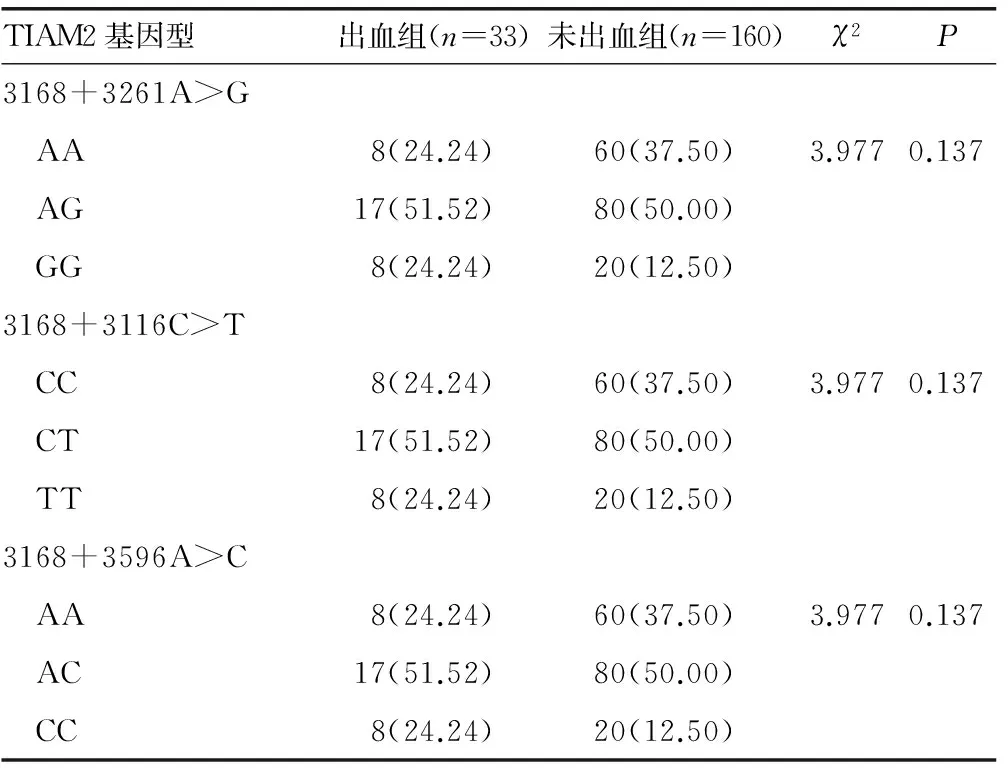
表1 TIAM2基因变异位点与CHD患者PCI后应用 氯吡格雷治疗出血的相关性[n(%)]
2.2CHD患者PCI后应用氯吡格雷治疗出血的相关因素单因素分析 采用单因素分析法统计出血组和未出血组患者间的一般资料,结果显示,患者合并高血压、消化道溃疡病史、入院前诊断为ACS、应用GPⅡb/Ⅲa拮抗剂可能与CHD患者PCI后氯吡格雷治疗发生出血事件有关(P<0.05),结果见表2。

表2 CHD患者PCI后应用氯吡格雷治疗出血的相关 因素单因素分析[n(%)]
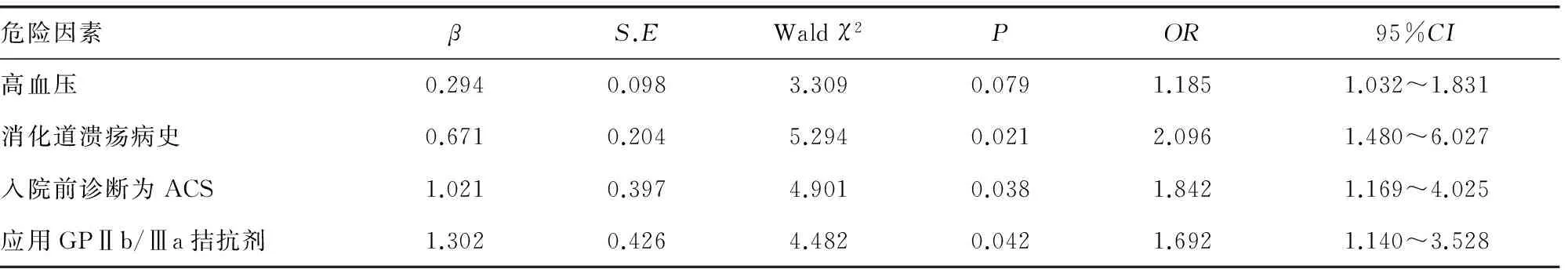
表3 CHD患者PCI后应用氯吡格雷治疗出血的多因素分析

图1 TIAM2基因变异位点测序结果
2.3CHD患者PCI后应用氯吡格雷治疗出血的多因素分析 选取2.2中具有统计学意义的因素患者合并高血压、消化道溃疡病史、入院前诊断为ACS、应用GPⅡb/Ⅲa拮抗剂作为自变量,患者是否出血作为因变量,采用进入Logistic回归模型进行分析,结果显示:消化道溃疡病史(OR=2.096),入院前诊断为ACS(OR=1.842),应用GPⅡb/Ⅲa拮抗剂(OR=1.692)作为自变量是CHD患者PCI后应用氯吡格雷治疗发生出血事件的危险因素(P<0.05),见表3。
3 讨 论
3.1 氯吡格雷治疗CHD患者出血的一般情况 目前,PCI治疗CHD等其他类型CHD的疗效及安全性已经得到医学界认可,但患者术后也需进行超过1年的药物抗血小板治疗[7]。这是因为PCI术易形成支架内血栓,造成患者心血管事件风险仍较高。通常选择氯吡格雷作为CHD患者PCI术后的抗血小板药物方案,但不同患者对其药效的临床反应各异,甚至有患者反应轻微或无反应,研究者将该现象称为氯吡格雷抵抗(clopidogrelresistance,CR),这也是笔者行医过程常遇到的情况,因此采取有效方式消除CHD患者CR或其他抗血小板药物抵抗,具有极其重要研究和临床应用价值[8]。
氯吡格雷作为心脏疾病临床中常用的前体药物之一,属于一种噻吩吡啶类药物。其只有被肝细胞色素P450酶分解成活性分子后,才具有抗血小板功能。研究显示,氯吡格雷被色素P450酶代谢的转化率只有15%,且药性受到CYP2C18-CYP2C19-CYP2C9-CYP2C8基因束内13个SNPs调控[9]。因此,笔者推断不同CHD患者基因及肝细胞功能的差异性可能是造成CR的主要原因。
3.2TIAM2基因变异位点与CHD患者PCI后应用氯吡格雷治疗出血的相关性TIAM2和人体TIAM1属于同系基因家族,并能够通过人工编码转变为鸟嘌呤核苷酸交换因子,可显著影响人体神经系统组织发育或各类恶性肿瘤产生、发展及转归[10];异常高表达TIAM2能够诱发恶性肿瘤细胞快速增殖及浸润,启动和介导Rac1蛋白功能,影响该蛋白调控血小板集聚功能,从而间接影响各类冠状动脉硬化、CHD或PCI术后血栓的产生和发展[10-11]。研究者通过对外显子进行测序后,证明人TIAM2基因可影响氯吡格雷抗血小板凝结效果[12],但关于该基因突变对CHD患者PCI术后氯吡格雷临床使用终点事件的影响尚未有清晰的结论。
在参阅资料基础上笔者设计试验,选取经PCI术的CHD患者血清进行TIAM2启动子区基因检测,同时将直接反映抗血小板效果的出血事件作为评估指标。PCR法测定试验结果显示,TIAM2基因3168+3261A>G、3168+3116C>T和3168+3596A>C等3个等位基因存在突变,分别统计分析这3个位点等位基因各种基因构成在出血组和未出血组间的差异,结果差异均无统计学意义(P>0.05),笔者认为出血CHD患者确实存在TIAM2基因突变现象,可能影响其机体产生CR,并影响CR抵抗程度。本试验结果还显示,患者基因突变处于完全连锁的状态,分别由突变纯合型、野生纯合型、突变杂合性构成,而他人研究中显示纯合突变及杂合子基因患者血小板聚集率显著低于野生型患者,但本研究没有发现3个位点等位基因各种基因构成在出血组和未出血组间存在明显差异(P>0.05),笔者推断TIAM2基因突变影响患者血小板聚集率的效果可能并不像其他研究显示那么明显,但该结果也可能和试验对象采取出血和未出血分组相关,未对血小板聚集率进行更多的分组,同时试验选取患者人数较少,也是造成统计差异不明显,这些均是本试验设计不足之处。
3.3HD患者PCI后应用氯吡格雷治疗出血的相关因素分析 在本研究中,通过对单因素进行分析,高血压、消化道溃疡、ACS和GPⅡb/Ⅲa拮抗剂服用均是促使CHD患者PCI后服用氯吡格雷产生出血事件的高诱发因素,这表明非遗传因素特别是相关基础疾病和药物使用不当也可影响CHD患者氯吡格雷抗血小板疗效,增加其出血风险。
综上所述,笔者证明氯吡格雷药物抵抗与遗传因素具有相关性,同时也创新性表明药物间相互作用、高胰岛素血症、血小板反应性等多种因素有关,CYP2C19 基因型变异只是其中因素之一,CYP2C19基因检测必须与其他临床因素有机结合,才能更好指导临床决策。CYP2C19基因遗传变异与临床预后相关性尚待明确,增加剂量可能克服氯吡格雷低反应性。根据基因型调整治疗方案尚缺乏证据,但缺乏证据不等于无潜在获益,验证CYP2C19基因检测在指导CHD介入术后个体化抗血小板治疗中的应用价值。
[1]李新新,钟诗龙,李园,等.TIAM2功能性基因突变对冠心病患者氯吡格雷抗血小板治疗后出血事件的影响[J].实用医学杂志,2014,2(7):1080-1083.
[2]袁慧.心血管药物个体化用药指导的基因检测及临床意义[J].中华检验医学杂志,2015(7):442-444.
[3]Karp ND,Boespflug S,Kumar JW,et al.ATF3 is a novel regulator of mouse neutrophil migration[J].Blood,2014,123(13):2084-2093.
[4]Bonello M,Laine S,Arméro M,et al.Clinical impact of genetically determined platelet reactivity[J].J Cardiovasc Transl Res,2013,6(3):398-403.
[5]尤家聪.强化抗血小板治疗对PCI术后QT离散度的影响[J].现代仪器与医疗,2013,19(4):53-55.
[6]Akihiro N,Mikio G,Hoshino M,et al.Phosphorylation of STEF/Tiam2 by protein kinase A is critical for Rac1 activation and neurite outgrowth in dibutyryl cAMP-treated PC12D cells[J].Mol Biol Cell,2011,22(10):1780-1790.
[7]王涛.血小板膜受体P2Y12基因多态性与冠心病患者氯吡格雷抵抗的相关性研究[J].中西医结合心脑血管病杂志,2015,3(3):353-355,356.
[8]胡珺婷,杨向军.PCI术后高血小板反应与CYP2C19基因多态性关系的分析[J].浙江临床医学,2015,17(10):1673-1675.
[9]Zhao ZY,Han CG,Liu JT,et al.TIAM2 enhances non-small cell lung cancer cell invasion and motility[J].Asian Pac J Cancer Prev,2013,14(11):6305-6309.
[10]王立娜,孙艺红,王长鹰,等.氯吡格雷个体化治疗的现状与未来[J].中华医学杂志,2015,95(41):3393-3395.
[11]郭元芳,杨波,成少永,等.冠心病高血压及无基础心血管病患者房性早搏对血流动力学的影响[J].重庆医学,2015,44(28):3930-3932.
[12]Fuentes TR,Shepherd RL,Hard AM,et al.Distinct ligand specificity of the Tiam1 and Tiam2 PDZ domains[J].Biochemistry,2011,50(8):1296-1308.
Relationship between clopidogrel therapy with bleeding events and TIAMI2 gene mutation in patients with CHD after PCI and its influencing factors
ZhangHong
(RoomofElectrocardiogram,AffiliatedHospitalofHebeiUniversity,Baoding,Hebei071000,China)
Objective To study the relationship between bleeding events occurrence due to clopidogrel use and TIAM2 gene mutation in the patients with coronary heart disease(CHD) after percutaneous coronary intervention (PCI) and the related factors influencing bleeding events.Methods Two hundreds cases of CHD treated by clopidogrel after emergency PCI were selected and followed for six months.Seven cases were lost to follow-up.According to whether the bleeding event happened or not,the patients were divided into the bleeding group(33 cases) and non-bleeding group(160 cases).TIAM2 genotypes were detected by polymerase chain reaction (PCR) assay.The relationship of TIAM2 genotype with bleeding events and related factors of bleeding events were analyzed.Results The PCR method measured the TIAM2 gene appearing 3 loci with mutation,which were 3168+3261A>G,3168+3116C>T and 3168+3596A>C respectively,the gene constitute of these 3 loci had no statistical difference between the bleeding group and non-bleeding group (P>0.05).In the Logistic regression analysis,the history of peptic ulcer disease(OR=2.096),diagnosis of acute coronary syndrome (ACS) before admission(OR=1.842),application of platelet glycoprotein (GP) Ⅱb/Ⅲa antagonist(OR=1.692) were the risk factors of bleeding events occurrence during using clopidogrel in CHD patients after PCI (P<0.05).Conclusion The bleeding events occurrence during using clopidogrel in CHD patients after PCI is related with the history of peptic ulcer disease,diagnosis of ACS before admission and application of GP Ⅱa Ⅲb/antagonists,and has no relation with TIAM2 gene mutation.
coronary heart disease;percutaneous coronary intervention;clopidogrel;hemorrhage;TIAM2 gene
张虹(1977-),主治医师,硕士,主要从事主要从事心血管疾病的检查和评估的研究。
10.3969/j.issn.1671-8348.2016.32.002
R
A
1671-8348(2016)32-4468-03
2016-06-20
2016-08-08)
