Peroxiredoxin-1基因沉默对转化生长因子β1促进肺成纤维细胞Ⅰ、Ⅲ型胶原合成的影响*
2016-12-19刘宝欣刘英宇魏中秋梁婷婷范玉磊
刘宝欣, 刘英宇,魏中秋, 梁婷婷,范玉磊,杨 方,孙 影△
(1.华北理工大学附属唐山市工人医院呼吸内科,河北唐山 063000;2.华北理工大学基础医学院病理学系,河北唐山 063000)
·技术与方法·
Peroxiredoxin-1基因沉默对转化生长因子β1促进肺成纤维细胞Ⅰ、Ⅲ型胶原合成的影响*
刘宝欣1, 刘英宇1,魏中秋2, 梁婷婷2,范玉磊2,杨 方2,孙 影2△
(1.华北理工大学附属唐山市工人医院呼吸内科,河北唐山 063000;2.华北理工大学基础医学院病理学系,河北唐山 063000)
目的 探讨Peroxiredoxin-1(Prx-1)基因沉默对转化生长因子β1(TGF-β1)促进肺成纤维细胞合成Ⅰ和Ⅲ型胶原的影响及其作用机制。方法 体外培养肺成纤维细胞分为4组:对照组(0.4%血清),TGF-β1组(5μg/L),TGF-β1+阴性转染组(5μg/L TGF-β1+阴性对照siRNA),TGF-β1+Prx-1siRNA转染组(5μg/L TGF-β1+Prx-1siRNA)。利用脂质体Lipo2000将阴性对照siRNA和Prx-1siRNA分别转染到TGF-β1+阴性转染组和TGF-β1+ Prx-1siRNA转染组的肺成纤维细胞中,转染48h后用于后续实验。实时荧光定量PCR(RT-PCR)检测转染后各组的Prx-1mRNA表达水平,蛋白免疫印迹法(Western blot)检测磷酸化Akt(p-Akt)及Ⅰ和Ⅲ型胶原蛋白水平,2,7-二氯荧光素二乙酸检测活性氧(ROS)水平。结果 (1) Prx-1siRNA转染肺成纤维细胞后,TGF-β1+ Prx-1siRNA转染组的Prx-1mRNA表达明显降低。(2) 与对照组比较,TGF-β1组Ⅰ和Ⅲ 型胶原、ROS及p-Akt蛋白水平均明显增加(0.34±0.06vs. 0.58±0.06、0.42±0.05vs. 0.56±0.06、2988±379vs. 4315±580和0.29±0.05vs. 0.66±0.07,差异有统计学意义(P<0.05)。与TGF-β1组比较,TGF-β1+阴性转染组Ⅰ和Ⅲ型胶原、ROS及p-Akt水平无明显变化(P>0.05),但TGF-β1+Prx-1siRNA转染组Ⅰ和Ⅲ 型胶原、ROS及p-Akt蛋白水平均进一步增高(0.58±0.06vs. 0.79±0.09、0.56±0.06vs. 0.77±0.08、4315±580vs. 5841±782和0.66±0.07vs. 0.93±0.15,差异有统计学意义(P<0.05)。结论 TGF-β1能够诱导肺成纤维细胞生成ROS,并由此促进Akt的激活和肺成纤维细胞合成Ⅰ和Ⅲ型胶原;而沉默Prx-1基因可激活ROS/Akt通路,从而有助于TGF-β1促进肺成纤维细胞合成胶原。
活性氧;转化生长因子-β1;胶原;Peroxiredoxin-1
矽肺是长期吸入二氧化硅粉尘而引起的一种职业病,其主要病理变化是肺组织弥漫性纤维化,Ⅰ和Ⅲ型胶原的表达增多是其中重要原因之一[1]。转化生长因子β1(transforming growth factro-β1,TGF-β1)在矽肺肺组织中表达增高,具有促纤维化作用。笔者前期研究显示,TGF-β1可通过上调活性氧(reactive oxygen specie,ROS)激活C-Jun蛋白激酶(JNK)细胞内信号传导通路,从而促进肺成纤维细胞合成Ⅰ和Ⅲ型胶原[2-3]。最近Lu等[4]报道博来霉素通过激活ROS/Akt通路促进肺组织纤维化。Peroxiredoxin 家族是一类新发现的过氧化物酶,其中,Peroxiredoxin 1(Prx-1)在哺乳动物中广泛表达,可快速有效地清除细胞内产生的ROS,并抑制ROS介导的细胞内传导通路激活[5]。但在矽肺纤维化过程中,目前并不清楚ROS/Akt通路是否介导了TGF-β1促肺成纤维细胞Ⅰ、Ⅲ 型胶原合成增加的作用,及Prx-1是否通过抑制ROS/Akt通路激活来抑制TGF-β1的促纤维化作用。本项目利用TGF-β1刺激正常及转染Prx-1siRNA的肺成纤维细胞,检测Ⅰ和Ⅲ型胶原、ROS及Akt磷酸化的变化,探讨Prx-1对ROS/Akt通路介导的TGF-β1促纤维化作用的影响。
1 材料与方法
1.1 材料 人胚胎肺成纤维细胞MRC-5购自中国科学院细胞库;TGF-β1购自美国Peprotech公司;总Akt(T-Akt)及磷酸化Akt(p-Akt)抗体购自美国Cell Signaling公司;Prx-1抗体购自美国Abcam产品公司;Ⅰ、Ⅲ型胶原抗体和GAPDH抗体购自武汉博士德生物有限公司;Prx-1siRNA及Prx-1基因上、下游引物由上海吉玛公司合成;M-MLV逆转录试剂盒、SYBR+Tap混合剂购自美国Invitrogen公司;活性氧检测试剂盒购自江苏南通碧云天生物技术公司。凝胶图像分析仪购自美国Bio-RAD公司。
1.2 方法
1.2.1 肺成纤维细胞的培养 肺成纤维细胞在5%血清水平的改良杜氏伊格尔培养基(DMEM),5% CO2,37℃条件下常规体外培养。
1.2.2 实验分组 MRC-5细胞分为4组:对照组(0.4%血清),TGF-β1组(5μg/L),TGF-β1+阴性转染组(5μg/L TGF-β1+阴性对照siRNA),TGF-β1+Prx-1siRNA转染组(5μg/L TGF-β1+Prx-1siRNA),每组样本数为5。本研究共设计3个不同靶基因位点的特异性Prx-1siRNA,分别是Prx-1siRNA-209、Prx-1siRNA-289、Prx-1siRNA-453,选择抑制作用最明显的Prx-1siRNA用于实验。利用脂质体Lipo2000将阴性对照siRNA、Prx-1siRNA分别转染到TGF-β1+阴性转染组和TGF-β1+Prx-1siRNA转染组,转染48h后各组细胞用0.4%血清培养12h,使其同步化。
1.2.3 实时荧光定量PCR(RT-PCR)检测Prx-1siRNA转染后Prx-1mRNA水平 Trizol法提取对照组、TGF-β1+阴性转染组和TGF-β1+Prx-1siRNA转染组的细胞总RNA。逆转录后取行RT-PCR,扩增体系如下:SYRB+Taq混合剂10μL,Prx-1或甘油醛-3-磷酸脱氢酶(GAPDH)上、下游引物各0.5μL(Prx-1的上游引物为5′-CCC CAC GGA GAT CAT TGC TT-3′,Prx-1的下游引物为5′-CGA GAT GCC TTC ATC AGC CT-3′;GAPDH的上游引物为5′-ATG AAT GGG CAG CCG TTA GG-3′,GAPDH的下游引物为5′-TGG ATT TGC CAT GGG TGG A-3′,cDNA 1μL,双蒸水8μL;循环参数为:95℃预变性30s;95℃ 5s,60℃ 30s,72℃ 30s,循环40次。
1.2.4 2,7-二氯荧光素二乙酸检测细胞内ROS水平 2,7-二氯荧光素二乙酸(无荧光)进入细胞后被酯酶分解,生成还原型二氯荧光素(无荧光),还原型二氯荧光素不但无法穿过细胞膜,还可被细胞内的ROS氧化生成氧化型二氯荧光素,二氯荧光素可发出荧光,因此荧光量可间接反映细胞内ROS水平。本研究中,细胞同步化后,与TGF-β1共孵育20min,收集制备单细胞悬液。加入2,7-二氯荧光素二乙酸(终浓度为10μmol/L),37℃孵育20min,洗涤后计数1×104个细胞,荧光酶标仪(激发波长488nm,发射波长525nm)检测各组的荧光强度。
1.2.5 蛋白免疫印迹法(Western blot)检测Ⅰ、Ⅲ型胶原和Akt水平 各组细胞同步化后,与TGF-β1共孵育45min (用于检测p-Akt)和48h(用于检测Ⅰ和Ⅲ型胶原蛋白),磷酸盐缓冲液(PBS)洗涤后细胞裂解液裂解细胞30min,收集细胞,离心后收集上清液,-70℃保存。利用考马斯亮蓝法测定细胞总蛋白浓度,并以每孔20μg总蛋白量进行电泳。转膜后,经5%牛血清清蛋白室温孵育1h,T-Akt、p-Akt、Ⅰ型胶原、Ⅲ型胶原和GAPDH抗体(均1∶1000稀释) 4℃孵育过夜,Ⅱ抗(均1∶3000稀释)室温孵育2h,BCIP/NBT(1∶50稀释)显色3min。Image J软件扫描蛋白表达条带并进行定量分析。p-Akt与T-Akt的比值为p-Akt的表达值,Ⅰ或Ⅲ型胶原与GAPDH的比值为Ⅰ或Ⅲ型胶原的表达值。

2 结 果
2.1 Prx-1siRNA转染对肺成纤维细胞Prx-1mRNA表达的影响 RT-PCR结果显示,对照组和TGF-β1+阴性转染组的Prx-1mRNA的表达水平差异无统计学意义(P>0.05)。与对照组和TGF-β1+阴性转染组相比,转染的3个特异性Prx-1siRNA均可不同程度地降低肺成纤维细胞Prx-1mRNA水平,其中,以Prx-1siRNA-453抑制作用最明显,遂将Prx-1siRNA-453用于后续实验,见表1。
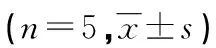
表1 Prx-1siRNA转染对MRC-5细胞Prx-1mRNA表达的影响
2.2 Ⅰ、Ⅲ型胶原蛋白表达 Western blot结果显示,对照组Ⅰ和Ⅲ型胶原的表达值分别为0.34±0.06和0.42±0.05,TGF-β1组Ⅰ和Ⅲ型胶原的表达值分别为0.59±0.07和0.57±0.07,TGF-β1组Ⅰ和Ⅲ型胶原的表达明显高于对照组,差异有统计学意义(P<0.01)。TGF-β1+阴性转染组Ⅰ和Ⅲ型胶原的表达值分别为0.52±0.07和0.58±0.09,与TGF-β1组比较,差异无统计学意义(P>0.05)。但TGF-β1+Prx-1siRNA转染组Ⅰ和Ⅲ型胶原的表达值分别为0.79±0.09和0.77±0.08,明显高于TGF-β1组的表达,差异有统计学意义(P<0.05),见图1。

1:对照组;2:TGF-β1组;3:TGF-β1+阴性转染组;4:TGF-β1+Prx-1siRNA转染组。
2.3 ROS水平 对照组、TGF-β1组、TGF-β1+阴性转染组和TGF-β1+Prx-1siRNA转染组的荧光强度分别为2988±379、4315±580、4850±572、5841±782。TGF-β1组的荧光强度显著高于对照组,差异有统计学意义(P<0.01)。TGF-β1+阴性转染组和TGF-β1组的荧光强度差异无统计学意义(P>0.05),但TGF-β1+Prx-1siRNA转染组的荧光强度明显高于TGF-β1组,差异有统计学意义(P<0.05)。
2.4 T-Akt及p-Akt的表达 各组T-Akt水平差异无统计学意义(P>0.05)。对照组、TGF-β1组、TGF-β1+阴性转染组和TGF-β1+Prx-1siRNA转染组的p-Akt表达值分别为0.29±0.05、0.65±0.07、0.70±0.10和0.93±0.15。TGF-β1组p-Akt表达明显高于对照组,差异有统计学意义(P<0.01)。TGF-β1+阴性转染组和TGF-β1组p-Akt表达差异无统计学意义(P>0.05),但TGF-β1+Prx-1siRNA转染组p-Akt表达明显高于TGF-β1组,差异有统计学意义(P<0.01,图2)。

1:对照组;2:TGF-β1组;3:TGF-β1+阴性转染组;4:TGF-β1+Prx-1siRNA转染组。
3 讨 论
ROS是在人体有氧代谢过程中产生的一类含有活性氧功能基团的化合物,包括氧自由基、过氧化物和激发态氧等。正常时ROS的生成与清除保持动态平衡,浓度很低,参与机体免疫过程、抵抗损伤等,对机体有保护作用。但病理状态下ROS生成增多或清除减少,浓度增高,通过攻击细胞脂质、蛋白质和DNA引起细胞损伤[6]。另外,ROS还参与细胞内信号转导通路,作为TGF-β1等多种细胞因子的第二信使,调节ERK1/2、JNK等信号转导途径,介导细胞增殖和胶原合成等[2,7]。Akt又称蛋白激酶B,其激酶活性区的氨基酸组成与蛋白激酶A和蛋白激酶C具有高度的同源性。Akt属于一种丝氨酸/苏氨酸激酶,当其第308位苏氨酸和第473位丝氨酸发生磷酸化时,该激酶即被激活,并从细胞膜转移到细胞内,通过调控下游靶蛋白,进而调节细胞生物学活动。最近研究显示,ROS激活的Akt途径在胶原的合成过程中发挥重要作用。如Liu等[8]报道在卵清蛋白诱导的哮喘和气道重塑过程中,高良姜素通过抑制ROS/Akt途径抑制胶原蛋白的合成,说明ROS/Akt通路介导了卵清蛋白诱导的胶原合成增加。Pérez de Obanos等[9]也报道谷胱甘肽通过降低ROS水平抑制了亮氨酸激活的Akt途径,从而减少肝星形细胞合成Ⅰ型胶原。
利用Western blot,本研究发现TGF-β1刺激肺成纤维细胞48h后,Ⅰ和Ⅲ型胶原表达水平较对照组分别增高了1.71和1.33倍,说明TGF-β1可诱导肺成纤维细胞合成Ⅰ和Ⅲ型胶原;同时TGF-β1组的ROS及p-Akt水平也明显增高,提示ROS/Akt信号通路的激活在TGF-β1诱导的肺成纤维细胞合成Ⅰ和Ⅲ型胶原过程中发挥着重要作用。
Prx-1是一种新型过氧化物酶,具有强大的抗氧化能力,其含有的过氧化半胱氨酸和可溶性半胱氨酸是消除H2O2的主要功能基团。首先过氧化半胱氨酸与H2O2作用,失去质子,转变为半胱氨酸次磺酸。然后半胱氨酸次磺酸再通过二硫键与可溶性半胱氨酸缩合,并在细胞内的二硫键还原酶作用下还原为氧化半胱氨酸,回到初始状态。这个循环过程可有效降低H2O2水平[10]。现已发现在多种疾病中Prx-1均可通过降低ROS来调节细胞的生物学活性,如Prx-1通过降低ROS抑制内皮细胞线粒体的损伤及线粒体介导的细胞凋亡[11]。Madrigal-Matute等[12]最新研究发现Prx-1与NADPH氧化酶在人动脉粥样硬化斑块巨噬细胞中表达位置相同,表达水平也呈正相关,认为不但Prx-1可在ROS产生的第一时间原位将其清除,而且对ROS敏感度高,是氧化应激的“感受器”。另外,更重要的是Prx-1还可抑制ROS介导的细胞内信号传导通路激活,如在β-拉帕醌(一种抗癌药)诱导的人子宫颈癌细胞凋亡过程中,凋亡信号调节激酶(ASK1)可通过激活JNK途径促进细胞凋亡,而Prx-1可通过促进TRX与ASK1的结合而抑制ASK1的活性和细胞凋亡[13]。
利用体内外实验,笔者前期研究发现Prx-1在矽肺大鼠肺组织中表达增高, Prx-1可以通过抑制ROS来抑制JNK和ERK1/2通路激活,抑制TGF-β1诱导的肺成纤维细胞增殖及胶原合成增加,从而抑制矽肺纤维化[3,7,14]。本实验利用Prx-1siRNA转染肺成纤维细胞使肺成纤维细胞Prx-1基因沉默,发现沉默Prx-1基因后可明显上调TGF-β1刺激的ROS水平,同时p-Akt 和Ⅰ、Ⅲ型胶原合成增强,说明沉默Prx-1基因可激活ROS/Akt信号传导通路,从而有助于TGF-β1促进肺成纤维细胞合成胶原。也进一步证实TGF-β1诱导的肺成纤维细胞合成Ⅰ和Ⅲ型胶原过程中,ROS/Akt信号传导通路的激活具有重要的促进作用。
[1]Xu H,Yang F,Sun Y,et al.A new antifibrotic target of Ac-SDKP:inhibition of myofibroblast differentiation in rat lung with silicosis[J].PLoS One,2012,7(7):e40301.
[2]赵立双,魏中秋,杨方,等.活性氧参与TGF-β1的促肺成纤维细胞增殖和胶原合成作用[J].中华劳动卫生与职业病杂志,2015,33(1):15-19.
[3]孙影,魏中秋,胡亚萍,等.新型过氧化物酶Peroxiredoxin-1对大鼠肺成纤维细胞JNK介导的Ⅰ和Ⅲ型胶原合成的影响[J].解剖学杂志,2014,37(5):590-593.
[4]Lu Y,Azad N,Wang L,et al.Phosphatidylinositol-3-kinase/Akt regulates bleomycin-induced fibroblast proliferation and collagen production[J].Am J Respir Cell Mol Biol,2010,42(4):432-441.
[5]Bae JY,Ahn SJ,Han W,et al.Peroxiredoxin Ⅰ and Ⅱ inhibit H2O2-induced cell death in MCF-7cell lines[J].J Cell Biochem,2007,101(4):1038-1045.
[6]李丹,李蓓,石亚楠,等.心力衰竭与活性氧关系研究进展[J].中华实用诊断与治疗杂志,2013,27(1):8-10.
[7]孙影,刘宝欣,魏中秋,等.ERK1/2通路在Peroxiredoxin-1抑制TGF-β1诱导的肺成纤维细胞增殖中的作用[J].广东医学,2015,36(14):2139-2141.
[8]Liu YN,Zha WJ,Ma Y,et al.Galangin attenuates airway remodelling by inhibiting TGF-β1-mediated ROS Generation and MAPK/Akt phosphorylation in asthma[J].Sci Rep,2015,5(6):11758.
[9]Pérez De Obanos MP,López-Zabalza MJ,Arriazu E,et al.Reactive oxygen species (ROS) mediate the effects of leucine on translation regulation and type Ⅰ collagen production in hepatic stellate cells[J].Biochim Biophys Acta,2007,1773(11):1681-1688.
[10]Rhee SG,Woo HA,Kil IS,et al.Peroxiredoxin functions as a peroxidase and a regulator and sensor of local peroxides[J].J Biol Chem,2012,287(7):4403-4410.
[11]Fiuza B,Subelzú N,Calcerrada P,et al.Impact of SIN-1-derived peroxynitrite flux on endothelial cell redox homeostasis and bioenergetics:protective role of diphenyl diselenide via induction of peroxiredoxins[J].Free Radic Res,2015,49(2):122-132.
[12]Madrigal-Matute J,Fernandez-Garcia CE,Blanco-Colio LM,et al.Thioredoxin-1/peroxiredoxin-1as sensors of oxidative stress mediated by NADPH oxidase activity in atherosclerosis[J].Free Radic Biol Med,2015,86(17):352-361.
[13]He T,Banach-Latapy A,Vernis L,et al.Peroxiredoxin 1 knockdown potentiates β-lapachone cytotoxicity through modulation of reactive oxygen species and mitogen-activated protein kinase signals[J].Carcinogenesis,2013,34(4):760-769.
[14]刘佳麒,郑素琴,桑银洲,等.染矽尘大鼠肺组织过氧化物还原酶Ⅰ蛋白表达的情况[J].中华劳动卫生职业病杂志,2013,31(7):531-533.
Effect of silencing peroxiredoxin-1on the expressions of collagen type Ⅰ and Ⅲ in TGF-β1induced pulmonary fibroblasts*
Liu Baoxin1,Liu Yingyu1,Wei Zhongqiu2,Liang Tingting2,Fan Yulei2,Yang Fang2,Sun Ying2△
(1.Department of Respiratory Medicine,Tangshan Works Hospital Affiliated to North China University ofScience and Technology,Tangshan,Hebei 063000,China;2.Department of Pathology,Primary MedicineCollege,North China University of Science and Technology,Tangshan,Hebei 063000,China)
Objective To investigate the effect of silencing peroxiredoxin-1(Prx-1) on the expressions of collagen type Ⅰ and Ⅲ in TGF-β1-induced pulmonary fibroblasts and the possible mechanism.Methods Cultured pulmonary fibroblasts were randomly divided into four groups:control group(0.4% serum),TGF-β1group(5μg/L),TGF-β1+negative transfection group(TGF-β1+scramble siRNA) and TGF-β1+Prx-1siRNA transfection group(TGF-β1+Prx-1siRNA).The negative control siRNA and siRNA Prx-1were transfected into the lung fibroblast cells transfected with TGF-β1+negative transfection group and TGF-β1+Prx-1siRNA transfection group by liposome Lipo2000respectively.After 48h,the cells were was used for subsequent experiments.Real-time PCR was used to evaluate Prx-1mRNA.Western blot was employed to detect the expressions of collagen type Ⅰ and Ⅲ,phosphorylated Akt(p-Akt),and total Akt.Reactive oxygen species (ROS) were measured by DCFH-DA.Results (1)After transfection of siRNA Prx-1into the lung fibroblasts,Prx-1mRNA expression was significantly decreased in the TGF-β1+ Prx-1siRNA group.(2) Compared with control group,expressions of collagen type Ⅰ and Ⅲ,ROS and p-Akt in TGF-β1group were all increased 0.34±0.06vs. 0.58±0.06,0.42±0.05vs. 0.56±0.06,2988±379vs. 4315±580,0.29±0.05vs. 0.66±0.07,(P<0.01).There were no differences in the levels of collagen,ROS and p-Akt between TGF-β1group and TGF-β1+negative transfection group(P>0.05).However,the levels of collagen type Ⅰ and Ⅲ,ROS and p-Akt in TGF-β1+Prx-1siRNA transfection group were further higher than TGF-β1group 0.58±0.06vs. 0.79±0.09,0.56±0.06vs. 0.77±0.08,4315±580vs. 5841±782and 0.66±0.07vs. 0.93±0.15,(P<0.05).Conclusion TGF-β1induces pulmonary fibroblasts to generate ROS,which contributes to Akt activation and collagen type Ⅰ and Ⅲ synthesis;these changes become more obvious with the treatment of Prx-1siRNA.
reactive oxygen species;transforming growth factro-β1;collagen;Peroxiredoxin-1
10.3969/j.issn.1671-8348.2016.29.022
国家自然科学基金资助项目(81072254);唐山市科学技术研究与发展基金资助项目(14130275B)。作者简介:刘宝欣(1974-),副主任医师,本科,主要从事肺癌研究。△
R563.9
A
1671-8348(2016)29-4099-04
2016-03-02
2016-04-19)
