热休克人羊膜间充质干细胞提取物与杀伤细胞共培养及抑瘤效应评价*
2016-12-19李培义张川骎
李培义,李 宁,王 雪,张川骎,李 菲,罗 清
(遵义医学院附属医院胸部肿瘤科,贵州遵义 563000)
·论 著·
热休克人羊膜间充质干细胞提取物与杀伤细胞共培养及抑瘤效应评价*
李培义,李 宁,王 雪,张川骎,李 菲,罗 清△
(遵义医学院附属医院胸部肿瘤科,贵州遵义 563000)
目的 将热休克人羊膜间充质干细胞(hAMSCs)提取物与细胞因子诱导的杀伤细胞(CIK)共培养,以期提高早期CIK的增殖、分泌细胞因子及体外杀伤等能力,为得到高质量CIK提供研究基础。方法 (1)从外周血单个核细胞中常规诱导培养CIK;(2)热休克处理hAMSCs(42℃,1h),48h后收集上清液及胞内物质,将提取物与第10天CIK(370μg∶2×106个)共培养;(3)计数第12、14、17天CIK细胞数,绘制生长曲线;(4)酶联免疫吸附测定(ELISA)检测细胞因子白细胞介素(IL)-2、肿瘤坏死因子α(TNF-α)、干扰素γ(IFN-γ)的分泌量;(5)MTT法检测CIK对A549的体外杀伤活性。 结果 (1)加入hAMSCs提取物的实验组增殖速度明显高于对照组,第12、14、17天CIK细胞数分别为[(5.26±0.01)×105/mL vs. (5.60±0.00)×105/mL)]、[(6.26±0.23)×105/mL vs. (9.37±0.15)×105/mL]、[(8.10±0.75)×105/mL vs. (11.00±1.67)×105/mL],差异有统计学意义(P<0.05);(2)ELISA结果表明,hAMSCs提取物对早期CIK细胞分泌细胞因子有一定促进能力,两组第14天IL-2、TNF-α、IFN-γ量(pg/mL)分别为(13.49±0.78vs. 15.49±3.47)、(53.52±5.52vs. 33.83±15.61)、(60.68±19.39vs. 50.24±18.89),差异无统计学意义(P>0.05);(3)MTT结果:对照组与实验组IC50分别为(38.60±18.63vs. 25.62±8.39),差异无统计学意义(P>0.05)。结论 成功将热休克hAMSCs提取物与CIK共培养;共培养后显著促进了早期CIK的增殖活性。
杀伤细胞;人羊膜间充质干细胞;A549肺腺癌细胞;热休克
肿瘤的形成是多个因素共同促进的复杂过程,其中免疫功能的缺陷是肿瘤发生、发展的必要条件;改善肿瘤患者的机体免疫系统是其治疗的关键,细胞因子诱导的杀伤细胞(cytokine induced killer cells,CIK)治疗作为一种细胞过继免疫疗法,间接改善肿瘤患者的免疫环境,通过免疫细胞直接杀伤肿瘤,不良反应低,适用范围广,在抗肿瘤治疗中显示了一定的优势[1-3]。它是将人外周血单个核细胞在体外经多种细胞因子诱导并大量扩增的一群异质细胞。CIK抗肿瘤治疗的关键在于如何培养获得持久增殖能力、高杀伤力的CIK细胞。目前,关于CIK的培养方法有很多,迄今国内对CIK培养技术还没有统一的规范,各家都有不同的报道:有利用肿瘤抗原负载DC活化CIK,选取不同来源的CIK,采取不同分离方式提取CIK,加入外源性刺激物提高CIK抗瘤效应[4-9]。笔者期望在CIK传统培养过程中加入一外源性刺激物,改进早期CIK的增殖能力、分泌细胞因子量(间接途径)、直接杀瘤效应、促凋亡能力等方面的能力。目前,研究较热门的是人羊膜间充质干细胞(human amniotic mesenchymal stem cells,hAMSCs),它是一种具有多分化潜能的干细胞,能分泌多种细胞因子,具有免疫调节作用,细胞增殖能力强,来源广泛,取材方便,无伦理限制等优势;hAMSCs在多个领域都显示出了可观的价值[10-12],笔者期望将hAMSCs与CIK共培养获得更优质的CIK细胞。
1 材料与方法
1.1 材料 A549人肺腺癌细胞株来源于中科院肿瘤细胞库;hAMSCs由遵义医学院细胞工程实验室提供;RPMI Medium 1640、DMEM购自美国gibco公司;细胞因子rhIL-1β、rhIL-2、PegIFN-α-2a均购自英国Peprotech公司;LEAFTMPurified anti-human CD3购自美国BioLegend公司;细胞因子酶联免疫吸附测定(ELISA)试剂盒购自深圳达科为生物工程有限公司; Annexin V-FITC细胞凋亡检测试剂盒购自凯基生物。
1.2 方法
1.2.1 CIK的提取与培养 取人外周血30mL于离心管中,加入等量的磷酸盐缓冲液(PBS)37℃预热混匀后,加入含人外周血淋巴分离液的离心管中(血液和淋巴分离液的比为1∶2),2000r/min离心25min,自然下降减速,离心后吸取第2层环状云雾状白色淋巴细胞, PBS洗涤收集。以1640完全培养基,密度(4~6)×106/mL,孵箱中静置2h,收集非贴壁细胞,调整细胞浓度为(1~2)×106/mL,同时加入PegIFN-α-2a(1000U/mL),第2天加入白细胞介素(IL)-1(100U/mL)、IL-2(1000U/mL)、CD3单抗(50ng/mL),隔天添加新鲜1640完全培养基,每隔3d补加IL-2(1000U/mL),倒置显微镜下观察细胞形态及生长情况。
1.2.2 热休克处理hAMSCs 取第4代hAMSCs, 42℃热休克1h后,孵箱静置48h,收集上清液0.22μmol/L滤膜过滤,-20℃保存,备用;反复冻融法提取热休克后hAMSCs内含物,0.22μmol/L滤膜过滤除菌,-20℃保存备用。
1.2.3 CIK与热休克hAMSCs提取物共培养 在培养第10天的CIK上清液中加入热休克hAMSCs提取物(CIK∶热休克hAMSCs提取物为2×106个∶370μg),常规培养,设为实验组。
1.2.4 CIK扩增速度比较 分别计数第12、14、17天对照组(CIK)、实验组(热休克hAMSCs+CIK)细胞数,并绘制生长曲线,对增殖情况进行统计和比较。
1.2.5 CIK分泌细胞因子比较 收集第14天CIK上清液,按ELISA试剂盒说明书检测CIK上清液细胞因子IL-2、肿瘤坏死因子α(TNF-α)、干扰素γ(IFN-γ)水平。
1.2.6 CIK杀伤活性比较 取第14天的CIK与对数生长期的A549,按CIK∶A549效靶比5∶1、10∶1、20∶1共培养24h后,MTT法计算CIK对A549的杀伤率。

2 结 果
2.1 镜下观察CIK、hAMSCs及A549肺腺癌细胞形态 CIK在镜下呈圆形,胞质饱满透亮,悬浮,集落样生长,黏附性强(图1A、B);第4代hAMSCs,细胞均贴壁生长,细胞间排列紧密,胞体拉伸,呈梭形,单层放射状或漩涡状生长(图1C);A549细胞贴壁生长,多呈梭形,伴伪足伸出(图1D)。
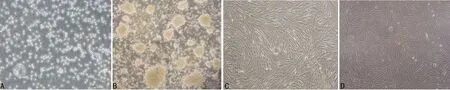
A:2d CIK(×100);B:10d CIK(×4);C:hAMSCs(×100);D:A549(×100)。
2.2 热休克hAMSCs提取物促进CIK增殖 第12、14、17天对照组及实验组CIK细胞数均随培养时间的推移呈明显的扩增趋势,实验组CIK增殖速度明显高于对照组,两组差异有统计学意义(P<0.05)。见表1、图2。
表1 两组不同时间点CIK细胞数

图2 两组CIK增殖曲线
2.3 热休克hAMSCs提取物对CIK分泌细胞因子IL-2、TNF-α、IFN-γ的影响 第14天对照组及实验组上清液中分泌的细胞因子IL-2、TNF-α、IFN-γ水平比较,差异无统计学意义(P>0.05),见表2。
表2 两组CIK分泌的细胞因子水平
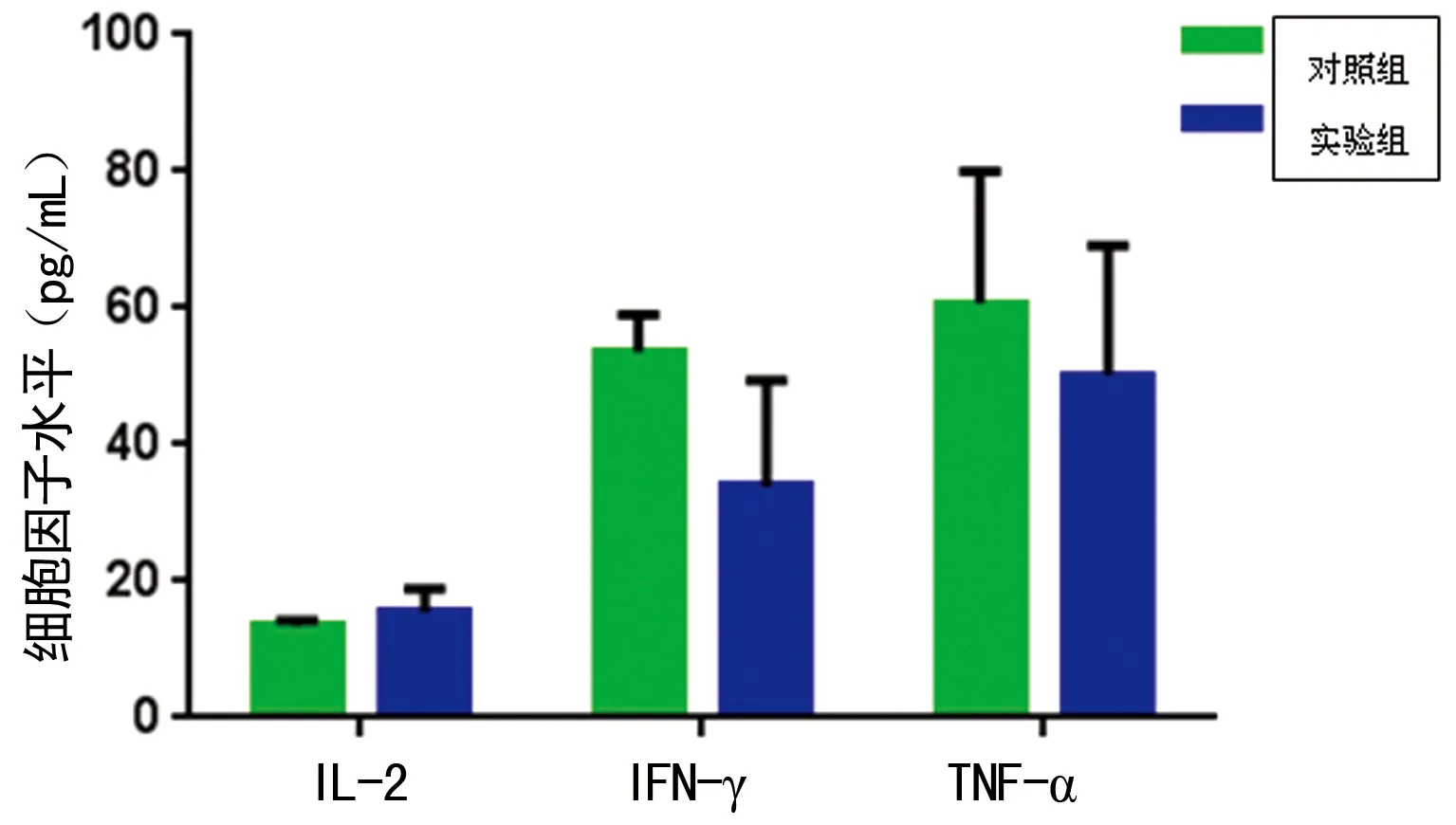
图3 两组CIK分泌的细胞因子水平
2.4 MTT法检测CIK对A549肺腺癌细胞的杀瘤活性 将第14天对照组及实验组CIK与A549肺腺癌细胞按5∶1、10∶1、20∶1效靶比共培养24h,CIK对A549的抑制率(%)分别为(9.86±2.55vs. 12.64±3.00)、(27.25±9.34vs. 30.81±8.22)、(37.17±4.59vs. 25.62±8.39),从结果可以看出在相同效靶比下实验组CIK对A549的抑制作用均高于对照组,且随着效靶比的增高,CIK的杀伤效应也在增加,IC50(38.60±18.63vs. 25.62±8.39),两组差异无统计学意义(P>0.05),见表 3。
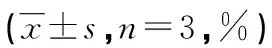
表3 CIK对A549肺腺癌细胞的抑瘤作用

图4 MTT检测两组CIK对A549的抑制率
3 讨 论
笔者对培养第10天的CIK进行了新方法的处理,在第14天对其进行增殖能力、分泌细胞因子水平、体外杀伤活性、诱导凋亡能力的检测,评估新方法(加入热休克hAMSCs提取物)是否提高了早期CIK的上述功能。为了使hAMSCs对淋巴细胞发挥促进作用,笔者将CIK与低剂量的热休克hAMSCs提取物共培养,同时为获得最大量的热休克蛋白,作者参照了Moloney等[13]对hAMSCs热休克的研究,将hAMSCs热休克处理,该研究显示间充质干细胞进行非致死性42℃热休克处理60min后,37℃孵箱静止48h后Hsp70、Hsp27等热休克蛋白达到最大表达量。
采用新方法处理CIK后,热休克hAMSCs提取物处理后的CIK增殖趋势明显高于对照组,差异有统计学意义(P<0.05)。说明热休克hAMSCs提取物能促进CIK的增殖。这一结果符合笔者的预期,间充质干细胞能修复和促进外周血单个核细胞的增殖能力,也能改善状态较差的淋巴细胞活性[14-15]; hAMSCs热休克后分泌的热休克蛋白,能促进抗原特异性CD4+细胞增殖;另外,Li等[15]在研究中提到hAMSCs对淋巴细胞既有抑制作用也有促进作用,发挥何种作用取决于T细胞与hAMSCs的数集比和一氧化氮(NO)、indoleamine 2,3-dioxygenase(iDO)的水平,低数集比及NO、iNOS受抑制时hAMSCs对T淋巴细胞表现为免疫促进作用。因此,采用热休克处理hAMSCs,改变了其胞内环境,阻断了hAMSCs中NO和iDO的作用,进而能提高免疫细胞的增殖活性,在NO和iDO被阻断的条件下,也就增强了T淋巴细胞的活性及机体的免疫反应。这一发现,为临床上更早期的获得一定数量的CIK打下了重要的实验基础。
此外,在本研究中,笔者还检测此方法下对于CIK体外杀伤活性及CIK诱导凋亡能力的影响。结果显示,实验组的杀瘤效应优于对照组,但差异无统计学意义(P>0.05);在CIK分泌细胞因子水平的实验中,两组的差异无统计学意义(P>0.05)。针对这一结果,笔者考虑存在以下几点可能:(1)选取第14天的CIK作为检测的时间点太早,未达到CIK对肿瘤细胞的最大杀伤效应及分泌细胞因子的最优时间,可在今后的实验考虑延长CIK的培养时间,检测多个时间点下CIK的杀瘤能力及促细胞因子分泌能力;(2)热休克hAMSCs提取物中NO和iDO对淋巴细胞存在一定的抑制作用,热休克hAMSCs提取物与CIK共培养比例在后续工作中还将继续深入探索,设置多个热休克hAMSCs提取物与CIK的数集比,或加入NO和iDO阻断剂,减少其对淋巴细胞的抑制作用。
综上所述,笔者采用热休克hAMSCs提取物与早期CIK细胞进行共培养,明显刺激了早期CIK(第10天)的增殖活性,此方法为继续获得数量更多、杀伤活性更强、不良反应更小的CIK提供了重要的实现途径。笔者还将继续优化此方法,持续深入探索和改进CIK的制备工艺。
[1]Martin PJ.CIK:A path to GVL without GVHD[J].Biol Blood Marrow Transplant,2011,17(11):1571-1572.
[2]Niam M,Linn YC,et al.Clinical scale expansion of cytokine-induced killer cells is feasible from healthy donors and patients with acute and chronic myeloid leukemia at various stages of therapy[J].Exp Hematol,2011,39(9):897-903.
[3]Schmeel LC,Schmeel FC,Coch C,et al.Cytokine-induced killer(CIK) cells in cancer immunotherapy:Report of the International Registry on CIK cells (IRCC)[J].J Cancer Res Clin Oncol,2015,141(5):839-849.
[4]庞冲,张腾月,王长利.肿瘤干细胞来源的DC-CIK对同源肿瘤细胞的杀伤作用[J].天津医药,2014,10(10):972-976.
[5]Zhang Z,Zhao X,Zhang T,et al.Phenotypic characterization and anti-tumor effects of cytokine-induced killer cells derived from cord blood[J].Cytotherapy,2015,17(1):86-97.
[6]刘涛,张旎娴,何凤,等.脐血CIK细胞抗肿瘤研究及临床应用进展[J].现代生物医学进展,2014(2):368-371.
[7]Liu H,Li J,Wang F,et al.Comparative study of different procedures for the separation of peripheral blood mononuclear cells in cytokine-induced killer cell immunotherapy for hepatocarcinoma[J].Tumour Biol,2015,36(4):2299-2307.
[8]Zhang Z,Wang LP,Zhao XL,et al.Pseudomonas aeruginosa injection enhanced antitumor cytotoxicity of cytokine-induced killer cells derived from cord blood[J].Biomed Pharmacother,2014,68(8):1057-1063.
[9]付庆国,应可明,朱林波.肿瘤HSP70活化的CIK细胞杀瘤作用研究[J].肿瘤学杂志,2012,18(7):512-515.
[10]He Q,Zhang H,Wang Y,et al.Purified anti-CD3×anti-HER2bispecific antibody potentiates cytokine-induced killer cells of poor spontaneous cytotoxicity against breast cancer cells[J].Cell Biosci,2014,4:70.
[11]Wang L,Deng Q,Wang J,et al.Effect of CIK on multidrug-resistance reversal and increasing the sensitivity of ADR in K562/ADR cells[J].Oncol Lett,2014,8(4):1778-1782.
[12]Burris HA.Overcoming acquired resistance to anticancer therapy:focus on the PI3K/AKT/mTOR pathway[J].Cancer Chemother Pharmacol,2013,71(4):829-842.
[13]Moloney TC,Hoban DB,Barry FP,et al.Kinetics of thermally induced heat shock protein 27and 70expression by bone marrow-derived mesenchymal stem cells[J].Protein Sci,2012,21(6):904-909.
[14]江小霞,张毅,李秀森,等.间充质干细胞对T淋巴细胞转化的影响[J].解放军医学杂志,2005,30(2):130-132.
[15]Li W,Ren G,Huang Y,et al.Mesenchymal stem cells:a double-edged sword in regulating immune responses[J].Cell Death Differ,2012,19(9):1505-1513.
The co-culture of CIK cells with heat-shock hAMSCs′ extract and the evaluation of anti-tumor effection*
Li Peiyi,Li Ning,Wang Xue,Zhang Chuanqin,Li Fei,Luo Qing△
(Department of Thoracic Oncology,Affiliated Hospital of Zunyi Medical College,Zunyi,Guizhou 563000,China)
Objective To improve the proliferation,secretion of cytokines and in vitro killing of CIK cells,and to provide the basis for the study of high quality CIK cells,heat shock hAMSCs extract and CIK cells were co-cultured.Methods (1)Conventional induction culture CIK cells from peripheral blood mononuclear.(2)Processed hAMSCs by heat shock in 42℃water bath for 1h,then collected supernate and extracted of hAMSCs after a 48h incubation in 37℃,5% CO2,co-cultured the heat shock hAMSCs′ extract with CIK cells (in a proportion of 370μg∶2×106).(3)the CIK cells number of 12,14,17d were counted,the growth curvedrawed.(4)The secretion levels (pg/mL) of IL-2,TNF-α and IFN-γ were tested by ELISA method.(5)The CIK′s cytolytic activity to A549cells were tested by MTT assay.Results (1)The experimental group joined the proliferation rate of hAMSCs extract was significantly higher than the control group,control group and experimental group 12,14,17d of cell were[(5.26±0.01)×105/mL vs. (5.6±0.00)×105/mL],[(6.26±0.23)×105/mL vs. (9.37±0.15)×105/mL] and [(8.10±0.75)×105/mL vs. (11.00±1.67)×105/mL],respectively(P<0.05).(2) The results of ELISA showed that hAMSCs extract on early stage of CIK cells secrete cytokines could promote ability,the secretion levels (pg/mL) of IL-2,TNF-α and IFN-γ were (13.49±0.78vs. 15.49±3.47),(53.52±5.52vs. 33.83±15.61) and (60.68±19.39vs. 50.24±18.89),respectively (P>0.05).(3)The results of MTT showed that,IC50in control group and experimental group were 38.60±18.63and 25.62±8.39,respectively (P>0.05).Conclusion We co-culture the CIK cells with heat-shock hAMSCs′ extract successfully;and the new method promoted the plication capacity of CIK.
cytokine induced killer cells;human amniotic mesenchymal stem cells;A549lung adenocarcinoma cells;heat shock
10.3969/j.issn.1671-8348.2016.29.001
国家自然科学基金资助项目(81260397);贵州省科技厅科学技术基金资助项目(黔科合J字[2013]2331号);遵义市科技局省-市联合项目基金资助项目[遵科合人(2014)9号];贵州省教育厅高校优秀科技创新人才支持计划基金资助项目(黔教合KY字[2015]495);遵义医学院博士启动基金资助项目[(0060616)F-616]。 作者简介:李培义(1988-),医师,硕士,现工作于贵阳中医学院第一附属医院特检科,主要从事胸部肿瘤诊疗的研究。△
R736.3
A
1671-8348(2016)29-4033-03
2016-03-12
2016-05-16)
