PI3K/Akt信号通路在转录水平调控VCAM-1表达*
2016-12-19贾圣男史家欣李小民陈晓兵
贾圣男,史家欣,李小民△,陈晓兵
(徐州医学院附属连云港医院:1.急诊内科;2.呼吸内科,江苏连云港 222000)
论著·基础研究
PI3K/Akt信号通路在转录水平调控VCAM-1表达*
贾圣男1,史家欣2,李小民1△,陈晓兵1
(徐州医学院附属连云港医院:1.急诊内科;2.呼吸内科,江苏连云港 222000)
目的 探讨PI3K/Akt信号通路是否调控脂多糖诱导的人内皮细胞VCAM-1表达及机制。方法 脂多糖(LPS)10μg/mL刺激人脐静脉血管内皮细胞(HUVEC)0、6、12、24h,蛋白免疫印迹法(Western blot)检测VCAM-1蛋白表达,刺激0、4、8、12h 行RT-PCR检测VCAM-1mRNA;LPS(10μg/mL,后同)刺激HUVEC 0、30、60、120min后,Western blot检测PI3K(磷脂酰肌醇-3激酶)、磷酸化PI3K(p-PI3K)、Akt、磷酸化Akt(p-Akt)表达;PI3K抑制剂LY294002(10、50μmol/L)、Akt抑制剂A6730(2、10μmol/L)预处理细胞1h后LPS刺激12h,Western blot检测VCAM-1蛋白表达,刺激8h行RT-PCR检测VCAM-1mRNA;加或不加抑制剂, LPS刺激8h加入放线菌素D抑制转录,于0、1、2、3、4h收细胞行RT-PCR检测VCAM-1mRNA,计算mRNA半衰期。结果 LPS刺激HUVEC(6、12、24h)后VCAM-1蛋白表达增加(P<0.05),12h达峰值,VCAM-1mRNA在刺激后也增加(P<0.05),8h达峰值;LPS刺激HUVEC后p-PI3K、p-Akt增加,p-PI3K在刺激30min达峰值(P<0.05),以后逐渐下降,120min与0h接近(P>0.05),p-Akt在刺激30min明显增加,60min达峰值,120min仍高于0h(P<0.05);LY294002下调了p-Akt表达(P<0.05),同时降低VCAM-1蛋白、mRNA合成(P<0.05);Akt抑制剂也抑制VCAM-1蛋白、mRNA(P<0.05);PI3K、Akt抑制剂均不影响VCAM-1mRNA稳定性(P>0.05)。结论 PI3K/Akt信号途径在转录水平调控VCAM-1表达。
PI3K/Akt信号通路;脂多糖;人脐静脉血管内皮细胞;血管细胞黏附分子
脓毒症是由感染引起的全身炎症反应综合征,按病情严重程度可分为脓毒症、严重脓毒症和脓毒性休克,临床表现为器官功能障碍和(或)液体治疗无法逆转的低血压[1]。随着人口的老龄化、肿瘤发病率的上升,由慢性阻塞性肺疾病、肺炎及恶病质引起的脓毒症发病率在不断升高,每年全球新增数百万脓毒症患者,其中,超过1/4的患者死亡[2]。革兰阴性细菌胞壁脂多糖(lipopolysacc haride,LPS)是其主要致病成分。LPS通过与细胞表面Toll样受体(TLR)相关受体结合,激活丝裂原激活蛋白激酶(MAPKs)、磷脂酰肌醇-3激酶(PI3K)一系列信号转导分子及转录因子,最终促进炎症因子白细胞介素(IL)-4、IL-6、IL-8、IL-10、IL-12等的表达[3-4]。而循环中的LPS还可诱导内皮细胞表达VCAM-1, VCAM-1不仅能够调节钙黏素黏附功能、内皮屏障功能及血管的通透性[5],还可以介导中性粒细胞的聚集、浸润,到达炎性局部清除病原体,以及进一步激活免疫细胞释放炎性介质,促进炎症因子大量释放,导致炎症的级联放大[6]。而PI3K/Akt信号通路是否能够调控VCAM-1的表达尚不完全清楚。因此,本研究拟探讨炎性刺激LPS作用于人脐静脉血管内皮细胞(HUVEC)后是否通过PI3K/Akt(蛋白激酶B)调控VCAM-1表达,来进一步研究其调节机制。
1 材料与方法
1.1 材料 HUVEC(中国科学院上海细胞所),RPMI1640培养基(凯基,中国),胎牛血清(维森特,南美),LPS(Sigma,L4391),PI3K(P85)、Akt、Akt磷酸化蛋白(ser473)、LY294002均购自美国CST公司,PI3K磷酸化蛋白(p-p85)(Abcam,美国),PI3K抑制剂LY294002、Akt特异性抑制剂A6730均购自Sigma公司,β-actin抗体(碧云天,中国),VCAM-1抗体(武汉三鹰,中国),Primescript RT reagent Kit With gDNA Eraser(TAKARA,RR047A),PCR master mix(捷瑞,中国),BCIP/NBT显色试剂盒、配胶试剂盒、蛋白裂解液、蛋白酶抑制剂、磷酸酶抑制剂均购自中国碧云天公司。
1.2 方法
1.2.1 内皮细胞的培养 RPMI1640培养基(含10%胎牛血清,100U/mL青霉素,100U/mL链霉素),在5%CO2、37℃条件的培养箱中培养HUVEC,胰酶消化法传代、冻存细胞,实验用第2~6代,倒置相差显微镜观察细胞的形态。
1.2.2 细胞培养与实验分组 取生长状态良好,传代3~6代,一定程度融合的细胞进行实验。实验分组为正常对照组(正常培养液孵育)、LPS组(完全培养基中加入10μg/mL LPS孵育,作用6、12、24h)、PI3K抑制剂组(不同浓度LY294002预处理1h,加入LPS刺激8、12h)、Akt抑制剂组(不同浓度A6730预处理1h,LPS作用8、12h)、放线菌素D(ActD)对照组(LPS刺激8h,加入ActD,作用0、1、2、3、4h)、PI3K抑制剂+ActD组(10μmol/L LY294002预处理1h,LPS刺激8h,加入ActD,作用0、1、2、3、4h)、Akt抑制剂+ ActD组(2μmol/L A6730预处理1h,LPS刺激8h,加入ActD,作用0、1、2、3、4h),分别收集各组细胞用于检测。
1.2.3 Western blot检测VCAM-1、PI3K、Akt、磷酸化PI3K(p-PI3K)、磷酸化Akt(p-Akt)的表达 将HUVEC细胞用冷的磷酸盐缓冲液(PBS)洗涤3遍,细胞刮刮下,1.0mL PBS悬浮,收集于1.5mL EP管中,2000r/min,弃上清液,根据沉淀量加入含1%蛋白酶抑制剂和1%磷酸酶抑制剂的蛋白裂解液,剧烈震荡1min,冰上放置10min,如此重复3次。待细胞充分裂解后,在12000r/min,4℃条件下离心15min,分离出总蛋白后用BCA法测定蛋白浓度。按体积加入蛋白上样缓冲液,混匀后用沸水煮10min。按每孔50μg总蛋白经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,半干法转移至PVDF膜,5%脱脂奶粉封闭1h,分别于1∶100人源的VCAM-1单克隆抗体、1∶1000人源PI3K(p85)抗体、Akt抗体、p-Akt抗体,1∶500人源p-PI3K抗体和1∶3000人源β-actin抗体中4℃过夜,洗膜,再以1∶500稀释的AP标记的山羊抗兔孵育2h,BCIP/NBT法显色。各目的蛋白的表达量用蛋白的A值与β-actin的A值的比值半定量表示,Image J图像分析系统进行分析。
1.2.4 RT-PCR检测VCAM-1mRNA的表达 Trizol试剂提取各组总RNA,测定RNA浓度,取2μg,应用 Primescript RT reagent Kit With gDNA Eraser进行逆转录,按照PCR master mix试剂说明进行逆转录扩增,PCR所用的引物由上海生物工程技术有限公司合成。VCAM-1mRNA:上游引物5′-CCC TTG ACC GGC TGG AGA TT-3′,下游引物5′-TGG GGG CAA CAT TGA CAT AAA GTG-3′;GAPDH mRNA:上游引物5′-AGA AGG CTG GGG CTC ATT TG-3′,下游引物5′-AGG GGC CAT CCA CAG TCT TC-3′。RT-PCR的反应条件:预变性94℃ 1min,94℃ 30s,60℃ 30s,72℃ 30s循环35次,得到cDNA扩增产物进行琼脂糖凝胶电泳,将电泳后的凝胶置于凝胶成像系统下拍照,利用Image J软件分析DNA条带灰度,目的RNA相对表达量=目的条带灰度值/内参条带灰度值。

2 结 果
2.1 LPS诱导人脐静脉血管内皮细胞VCAM-1蛋白表达 LPS组刺激HUVEC 6、12、24h后VCAM-1表达明显升高,在刺激12h达高峰,随后下降,与正常对照组比较,差异有统计学意义(P<0.05),见图1。

*:P<0.05,与正常对照组比较
2.2 LPS刺激HUVEC后激活PI3K/Akt信号分子 LPS刺激HUVEC 30、60、120min,PI3K、Akt总蛋白与正常对照组比较均差异无统计学意义(P>0.05),见图2A、2B。p-PI3K在30min明显高于正常对照组(P<0.05),60min较前降低,但仍高于正常对照组(P<0.05),120min与正常对照组比较差异无统计学意义(P>0.05),见图2C。p-Akt在细胞刺激30min明显增多,60min进一步增加,120min下降,但仍高于正常对照组(P<0.05),见图2D。
2.3 PI3K抑制剂LY294002抑制p-Akt、VCAM-1蛋白表达,Akt抑制剂A6730抑制VCAM-1蛋白合成 LY294002不同浓度(10、50μmol/L)均明显降低 p-Akt表达,与正常对照组比较差异有统计学意义(P<0.05),且50μmol/L LY294002明显低于10μmol/L LY294002,见图3A。同时LY294002(10、50μmol/L)、A6730(2、10μmol/L)均可减少炎症因子VCAM-1合成,与正常对照组比较差异有统计学意义(P<0.05),加入高浓度抑制剂VCAM-1蛋白水平明显低于低浓度抑制剂(P<0.05),见图3B、3C。
2.4 LPS刺激及PI3K抑制剂LY294002、Akt抑制剂A6730对HUVEC表达 LPS刺激HUVEC 4、8、12h,4h后VCAM-1mRNA明显增多,8h达高峰,12h较前下降,但仍高于正常对照组(P<0.05),见图4A。LY294002(10、50μmol/L)减低VCAM-1mRNA合成,与正常对照组比较差异有统计学意义(P<0.05);加入50μmol/L LY294002的VCAM-1mRNA明显低于10μmol/L LY294002(P<0.05),见图4B。 A6730(2、10μmol/L)可明显降低LPS刺激的HUVEC表达VCAM-1mRNA,与正常对照组比较,差异有统计学意义(P<0.05);加入2μmol/L A6730的VCAM-1mRNA含量明显高于10μmol/L A6730(P<0.05)。
2.5 PI3K、Akt对VCAM-1mRNA稳定性的影响 设定0h量为100%,其他时间点值为与0h的比值,应用GraphPad Prism软件one phase decay程序测定不同处理组之间mRNA的半衰期,结果发现PI3K抑制剂组、Akt抑制剂组VCAM-1的半衰期分别为160、157min,与正常对照组(169min)比较,差异无统计学意义(P>0.05),见图5D、5E。

A:PI3K总蛋白的表达;B:Akt总蛋白的表达;C:p-PI3K变化;D:p-Akt变化;*:P<0.05,与正常对照组比较

A:p-Akt表达变化 0h无LPS刺激,1h为LPS刺激1h,LY29400210、50μmol/L为不同浓度LY294002预处理1h后LPS刺激1h;B:VCAM-1蛋白表达变化。0h无LPS刺激,12h为LPS刺激12h,LY29400210、50μmol/L为不同浓度LY294002预处理1h后LPS刺激12h;C:Akt抑制剂A6730对VCAM-1表达的影响,处理方式同B;*:P<0.05,与正常对照组比较;#:P<0.05,与LPS刺激12h比较
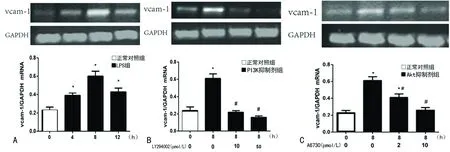
A:RT-PCR检测VCAM-1mRNA;B:10、50μmol/L不同浓度LY294002预处理1h后LPS刺激8h,RT-PCR测VCAM-1mRNA的变化;C:Akt抑制剂A6730对VCAM-1mRNA的影响;*:P<0.05,与正常对照组比较;#:P<0.05,与LPS刺激8h比较

A:LPS刺激8h加入ActD(ActD 5μg/mL)于0、1、2、3、4h收集细胞,RT-PCR检查;B:PI3K抑制剂对VCAM-1mRNA稳定性的影响LY294002(10μmol/L)预处理1h后LPS刺激8h,后续处理同上;C:Akt抑制剂对VCAM-1mRNA稳定性的影响A6730(2μmol/L) 预处理1h后LPS刺激8h,后续过程同A;D、E:利用GraphPad计算出的不同处理条件下VCAM-1mRNA的半衰期。
3 讨 论
脓毒症是由感染引起的全身炎症反应综合征,机体过度放大的炎症反应是脓毒症的本质,其主要致病成分LPS迅速大量激活免疫细胞,激活MAPKs、PI3K/Akt信号转导通路,合成IL-6、IL-8、IL-12等炎症因子,最终过度增多的炎症因子对机体造成损害[3-4]。而PI3K/Akt信号分子作为细胞质内一组脂质激酶,在相关外部刺激激活跨膜受体后,胞内区可募集PI3K至胞膜,活化后的PI3K将磷脂酰肌醇-2-磷酸(PIP2)磷酸化形成磷脂酰肌醇-3-磷酸(PIP3),PIP3作为第二信使活化下游蛋白激酶B(PKB/Akt)、磷脂酰肌醇依赖的蛋白激酶(PDPK1)[7],Akt、PDPK1进一步活化糖原合成激酶-3(GSK3)、哺乳动物雷帕霉素靶向的复合物(mTOR)下游分子[8],最终激活NF-κB、AP-1、Nrf、STAT等转录启动子,促进大量合成炎症因子[9]。而循环中的LPS也可诱导内皮细胞表达IL-6、IL-8、MCP-1、VCAM-1等一系列炎性介质[10],其中,VCAM-1不仅介导中性粒细胞的聚集、浸润,到达炎性局部清除病原体,还可以进一步激活免疫细胞释放炎性介质,导致炎症的级联放大[6]。而信号途径PI3K/Akt是否可以调控HUVEC中LPS诱导的VCAM-1表达尚不完全清楚。笔者应用LPS刺激培养的人脐静脉血管内皮细胞株发现,LPS刺激HUVEC后可激活PI3K、Akt信号分子,诱导p-PI3K、p-Akt迅速增多,并且也可以增加VCAM-1表达一直到刺激24h。可见在HUVEC,脓毒症刺激时也可激活PI3K、Akt信号分子,并上调促炎介质VCAM-1表达。
在单核巨噬细胞株THP-1中,LPS刺激可激活PI3K、Akt,p-PI3K、p-Akt表达增多,伴炎性因子IL-6、IL-10、IL-12表达增多,应用PI3K、Akt抑制剂后炎症因子表达下调[11]。因此,笔者认为PI3K/Akt可调节上述炎症因子的合成。同时,本实验中笔者应用PI3K抑制剂LY294002抑制PI3K活性后不仅降低了LPS诱导的p-Akt蛋白的增加,还可以抑制VCAM-1蛋白的表达,进一步应用Akt抑制剂发现也降低了LPS 诱导的VCAM-1蛋白增加,这就证明了HUVEC与THP-1细胞拥有同样的信号转导途径调控炎症介质的表达。为进一步明确VCAM-1基因水平的变化,在LPS刺激HUVEC不同时间及PI3K、Akt抑制剂应用后行VCAM-1RT-PCR,结果显示PI3K/Akt同样调控VCAM-1mRNA表达,这与上述蛋白测定的结果是一致的。
机体有效适度的免疫应答,是外部因素刺激机体后,免疫系统迅速大量合成炎症因子清除病原体,而后免疫调节降低炎症因子的合成,保持炎症反应的平衡[12]。炎症因子的调节包括转录及转录后调节,转录调节是通过调节基因状态、转录子、增强子等调节由DNA合成RNA的过程,转录后调节是在RNA合成后,通过5′或者3′非转录区相关序列与RNA结合蛋白结合,对RNA进行可变剪接、盖帽、加多聚A尾、调节RNA稳定性等一系列过程,最终到达翻译成为蛋白[13-14]。机体免疫系统被激活后,不仅依靠转录调节方式迅速增加炎症因子合成,还会以转录后调节方式调控信使RNA稳定性,迅速调控炎症因子蛋白的合成增多或减少。而基因3′非翻译区的富含AU的序列(ARE)即“AUUUA”序列调节,与相关RNA结合蛋白结合后调节mRNA的稳定性是一种常见转录后调节形式,如HuR、HuD与之结合并增加mRNA稳定性,而TTP、AUF1与之结合后加速了mRNA降解,缩短mRNA半衰期[15]。ARE序列的转录后调节在炎症因子的调节中发挥重要作用,在人和大鼠骨髓源性的巨噬细胞中发现,AUF1可加速LPS诱导的IL-6、IL-10、TNF mRNA降解,减少炎症因子蛋白表达。因此,笔者检索PUBMED基因库,发现在人VCAM-1基因3′非转录区含2个“AUUUA”序列,而PI3K/Akt是否可以通过ARE依赖的转录后调节机制调控VCAM-1表达尚不明确,笔者进一步在实验中测定对照组、PI3K抑制剂组及Akt抑制剂组VCAM-1mRNA半衰期,结果发现PI3K、Akt并不显著改变VCAM-1半衰期。因此,笔者明确了PI3K/Akt可以在转录水平调控VCAM-1表达,而不是转录后调节。
综上所述,本研究发现在LPS刺激HUVEC后可激活PI3K/Akt信号通路,p-PI3K、p-Akt迅速增加,并上调VCAM-1蛋白表达。应用PI3K、Akt抑制剂后发现二者可以浓度依赖性抑制VCAM-1蛋白表达,也可以抑制VCAM-1mRNA变化,这与上述蛋白结果是一致的。进一步研究PI3K/Akt对VCAM-1mRNA稳定性的影响发现,PI3K/Akt并不显著改变VCAM-1mRNA稳定性,因此,笔者认为PI3K/Akt可以通过转录水平调节方式调控LPS诱导的内皮细胞VCAM-1表达,而不是转录后调节。然而本实验由于条件限制,没能够进一步深入研究PI3K/Akt是通过哪些信号分子调控VCAM-1表达,以及本实验材料是体外培养的细胞株,可能与在体细胞会有不同,还需要进一步研究。
[1]Ghosh S.Comments on surviving sepsis guideline 2012[J].Critical care medicine,2013,41(12):e486-487.
[2]Kramer RD,Cooke CR,Liu V,et al.Variation in the contents of sepsis bundles and quality measures.A systematic review[J].Ann Am Thorac Soc,2015,12(11):1676-1684.
[3]Liu HT,Huang P,Ma P,et al.Chitosan oligosaccharides suppress LPS-induced IL-8expression in human umbilical vein endothelial cells through blockade of p38and Akt protein kinases[J].Acta Pharmacol Sin,2011,32(4):478-486.
[4]Wang H,Brown J,Gu Z,et al.Convergence of the mammalian target of rapamycin complex 1- and glycogen synthase kinase 3-beta-signaling pathways regulates the innate inflammatory response[J].J Immunol,2011,186(9):5217-5226.
[5]Sarelius IH,Glading AJ.Control of vascular permeability by adhesion molecules[J].Tissue Barriers,2015,3(1/2):e985954.
[6]Qiu HN,Wong CK,Chu IM,et al.Muramyl dipeptide mediated activation of human bronchial epithelial cells interacting with basophils:a novel mechanism of airway inflammation[J].Clin Exp Immunol,2013,172(1):81-94.
[7]Fruman DA,Bismuth G.Fine tuning the immune response with PI3K[J].Immunol Rev,2009,228(1):253-272.
[8]Nandan D,Camargo de Oliveira C,Moeenrezakhanlou A,et al.Myeloid cell IL-10production in response to leishmania involves inactivation of glycogen synthase kinase-3beta downstream of phosphatidylinositol-3kinase[J].J Immunol,2012,188(1):367-378.
[9]Kim MG,Yang JH,Kim KM,et al.Regulation of Toll-like receptor-mediated Sestrin2induction by AP-1,Nrf2,and the ubiquitin-proteasome system in macrophages[J].Toxicol Sci,2015,144(2):425-435
[10]Mako V,Czucz J,Weiszhar Z,et al.Proinflammatory activation pattern of human umbilical vein endothelial cells induced by IL-1beta,TNF-alpha,and LPS[J].Cytometry A,2010,77(10):962-970.
[11]Park SY,Park DAJ,Kim YH,et al.Schisandra chinensis alpha-iso-cubebenol induces heme oxygenase-1expression through PI3K/Akt and Nrf2signaling and has anti-inflammatory activity in porphyromonas gingivalis lipopolysaccharide-stimulated macrophages[J].Int Immunopharmacol,2011,11(11):1907-1915.
[12]Mino T,Takeuchi O.Post-transcriptional regulation of cytokine mRNA controls the initiation and resolution of inflammation[J].Biotechnol Genet Eng Rev,2013,29(1):49-60.
[13]Van Arensbergen J,Van Steensel B,Bussemaker HJ.In search of the determinants of enhancer-promoter interaction specificity[J].Trends Cell Biol,2014,24(11):695-702.
[14]Hu W,Coller J.What comes first:translational repression or mRNA degradation? The deepening mystery of microRNA function[J].Cell Res,2012,22(9):1322-1324.
[15]Komnenov D,Scipione CA,Bazzi ZA,et al.Pro-inflammatory cytokines reduce human TAFI expression via tristetraprolin-mediated mRNA destabilisation and decreased binding of HuR[J].Thromb Haemost,2015,114(2):337-349.
PI3K/Akt signaling pathway regulates VCAM-1expression at the transcriptional level*
Jia Shengnan1,Shi Jiaxin2,Li Xiaoming1△,Chen Xiaobing1
(1.Department of Emergency Medicine;2.Department of Respiratory Medicine,Lianyungang HospitalAffiliated to Xuzhou Medical University,Lianyungang,Jiangsu 222000,China)
Objective To explore the effect of PI3K/Akt signaling pathway on lps induced vascular cellular adhesive molecular 1(VCAM-1) expression and its mechanism.Methods Human umbilical vein endothelial cells(HUVECs) were treated with lipopolysaccharides(10μg/mL) for 0,6,12,24h,the production of VCAM-1protein was assessed by Western blot.HUVECs were incubated with LPS for 0,4,6,8h for the detection of VCAM-1mRNA by reverse transcription-polymerase chain reaction (RT-PCR).HUVECs were incubated with LPS for 0,30,60,120min,the protein expression of PI3K、phoph-PI3K(p-PI3K),Akt and phosphor-Akt(p-Akt) was assessed by Western blot.HUVECs were pretreated with different concentrations of PI3K inhibitor LY294002(10,50μmol/L) or Akt inhibitor A6730(2,10μmol/L) for 1h,then they were incubated with LPS for 12h,the effect of PI3K on VCAM-1protein was detected by Western blot.The effect of PI3K inhibitor(10,50μmol/L) or Akt inhibitor(2,10μmol/L) on the mRNA expression of VCAM-1was measured by RT-PCR.HUVECs were pretreated with or without LY294002(A6730) for 1hour,incubated with LPS for 8h,and then incubated with ActD 5μg/mL for 0,1,2,3,4h,collected the cells for the measure of VCAM-1mRNA by RT-PCR,calculate the half-life of mRNA.Results The expression of VCAM-1protein was significantly increased in LPS stimulated groups(6,12,24h)(all P<0.05),and the peak effect was observed at 12h.The VCAM-1mRNA levels also increased evidently after LPS incubation(all P<0.05) and peaked at 8h.LPS significantly induced p-PI3K and p-Akt,they peaked at 30min(P<0.05) or 60min (P<0.05)respectively,at 120min was higher than at 0h(P<0.05).LY294002reduced p-Akt(all P<0.05)and VCAM-1(all P<0.05)at protein and mRNA levels.A6730alsodeceased VCAM-1protein and mRNA(all P<0.05).LY294002and A6730didn′t affect mRNA half-life of VCAM-1(all P>0.05).Conclusion The PI3K/Akt signaling pathway could transcriptionally regulates lps-induced vascular cellular adhesive molecular expression.
PI3K/Akt signal pathway;lipopolysaccharides;human umbilical vein endothelial cells;vascular cellular adhesive molecular 1
10.3969/j.issn.1671-8348.2016.29.002
国家自然科学基金资助项目(81300052);中国博士后科学基金(2015M570420);江苏省卫生和计划生育委员会资助课题(H201558);江苏省自然科学基金资助项目(BK20130402);连云港科技局资助项目(SH1401)。 作者简介:贾圣男(1989-),硕士,主要从事脓毒症炎症器官功能衰竭的基础及临床研究。△
R392.6
A
1671-8348(2016)29-4036-05
2016-03-14
2016-05-18)
