玻尔兹曼因子方法打开了精确计算分子相互作用特性的大门
2016-12-19吴义彬
吴义彬
(南昌市老科学技术工作者协会 江西 南昌 330003)
物理问题研究
玻尔兹曼因子方法打开了精确计算分子相互作用特性的大门
吴义彬
(南昌市老科学技术工作者协会 江西 南昌 330003)
范德瓦耳斯方法只考虑了分子之间的吸引力,未考虑排斥力,所以范德瓦耳斯方程与实际气体并不十分符合.玻尔兹曼因子方法既包含了分子之间的吸引力,也包含了相邻分子之间的排斥力,巧妙地克服了“统计物理学处理互作用粒子系统所遇到的困难”,所以由玻尔兹曼因子方法推导出来的实际气体玻尔兹曼因子方程,不仅与传统基础知识一脉相承,涵盖了理想气体物态方程、范德瓦耳斯方程与维里方程,而且真正打开了在定量上精确计算分子相互作用特性的大门,实现了精确计算摩尔表面自由能及其相关物理量的目标;较好地解决了范德瓦耳斯方程所存在的公认缺陷问题.
理想气体方程 范德瓦耳斯方程 维里方程 玻尔兹曼因子方程
1 引言
物态方程在自然科学和工程技术中占有非常重要的地位.“理想气体物态方程是化学动力学中最早的定量描述,同时也是热力学和统计物理学的起源.分子相互作用的定量描述则起始于范德瓦耳斯方程”[1].尽管存在“范氏方程给出的曲线不包含汽液两相共存的信息”[2],“在实际应用中,如果需要较高的精度,即使在较低压强下范德瓦耳斯方程也不适用”[3]等等公认的缺陷,但在范德瓦耳斯之后,人们对实际气体物态方程的理论研究并未取得实质性进展.“具有讽刺意味的是,对于古老的气液相变,我们今天的知识并不比范德瓦耳斯增加了很多,建立包括过冷、过热和两相共存现象在内的、严格的气液相变统计理论,仍然是尚未全部解决的难题”[4].与范德瓦耳斯方法不同,玻尔兹曼因子方法既包含了分子之间的吸引力,也包含了相邻分子之间的排斥力,巧妙地克服了“统计物理学处理互作用粒子系统所遇到的困难”[5].用玻尔兹曼因子方法推导出来的实际气体玻尔兹曼因子方程[6],不仅与传统基础知识一脉相承,涵盖了理想气体方程、范氏方程与维里方程,而且真正打开了在定量上精确计算分子相互作用特性的大门,实现了精确计算摩尔表面自由能及其相关物理量的目标.较好地解决了范氏方程所存在的公认缺陷问题.
2 玻尔兹曼因子方法
玻尔兹曼因子方法与范德瓦耳斯方法的出发点类同,认为在图1中靠近器壁的ABB′A′区域内存在垂直于器壁的表面保守力场.
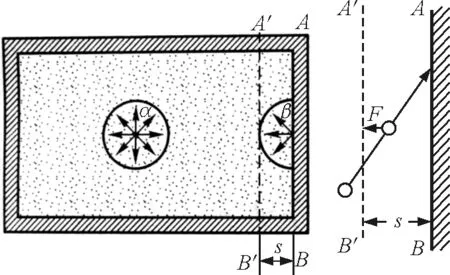
图1 分子间作用力的边界区域效应[3]
在低压强条件下,由于体系内部相邻分子之间的平均间距大于图2中的r0,相邻分子之间的相互作用合力为引力,故表面保守力场为引力势;在高压强条件下,由于体系内部分子之间的平均间距小于图2中的r0,相邻分子之间的相互作用合力为斥力,故表面保守力场表现为强大的斥力势,由于体系内部分子溢出ABB′A′区域(节流)过程中,必须克服表面保守力场做功,所以紧靠容器壁的气体分子都具有可以转变为机械能的表面自由能Eq,数值上等于分子通过表面保守力场溢出体系过程中所必须做的功.
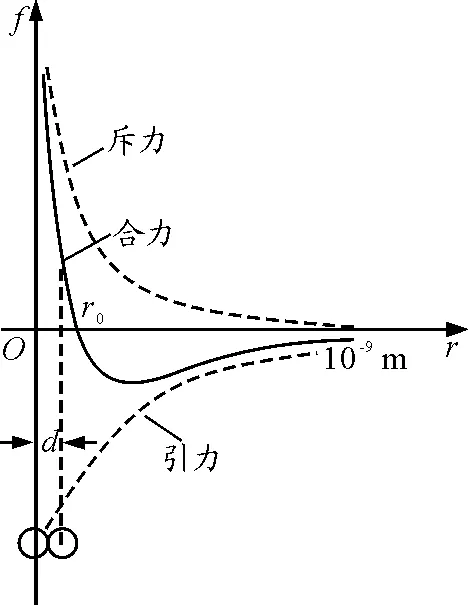
图2 分子力示意图[7]
当只是讨论表面分子在表面保守力场方向上按表面位势能的分布(类似于“重力场中微粒按高度的分布[3]”)时,完全可以将表面理解为是由完全相同的只受表面保守力场作用的“近独立粒子”所组成的系统.根据“玻尔兹曼分布律是一个普遍性的规律,它对任何物质微粒(气体、液体、固体的原子和分子,布朗粒子等)在任何保守力场(重力场、电场)中运动的情形都成立”[3]的科学论断,提出“将玻尔兹曼分布直接应用于ABB′A′区域的表面保守力场中,用描述分子相互作用特性的表面自由能Eq作为体系状态参量之一”的研究实际气体平衡体系的玻尔兹曼因子方法.
3 实际气体的玻尔兹曼因子方程
应用玻尔兹曼因子方法可以推导出实际气体的玻尔兹曼因子方程[6]
(1)
(2)
(3)
式中nAB为图1中紧靠器壁AB处气体的分子数密度;nA′B′为气体的分子数密度;Fq为摩尔表面自由能,数值上等于N0Eq;mq为气体质量;Vq为气体体积;Vqm为摩尔体积;M为摩尔质量.
实际气体的玻尔兹曼因子方程,不仅与传统基础知识一脉相承,涵盖并超越了理想气体方程、范氏方程与维里方程,而且可以在定量上精确计算摩尔表面自由能Fq及其相关物理量,较好地解决了范氏方程所存在的公认缺陷问题.
3.1 涵盖了理想气体物态方程
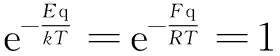
pqVqm=RT
这就是熟知的理想气体物态方程.这也就是说,实际气体玻尔兹曼因子方程式(2)或式(3)的“零级近似解”就是理想气体物态方程.
3.2 涵盖并超越了范德瓦耳斯方程
实际气体玻尔兹曼因子方程不仅可以涵盖范氏方程,而且可以精确地描述气体在各种压强条件下的自然状态.例如:表1中列出了在0℃时等温压缩氢气的实验数据与相应的理论计算值,其中第5列是本文新给出的由第1列与第2列中的实验数据代入式(3)计算得到的摩尔表面自由能Fq.
表1 在0℃时等温压缩氢气的实验数据与理论计算值[3]
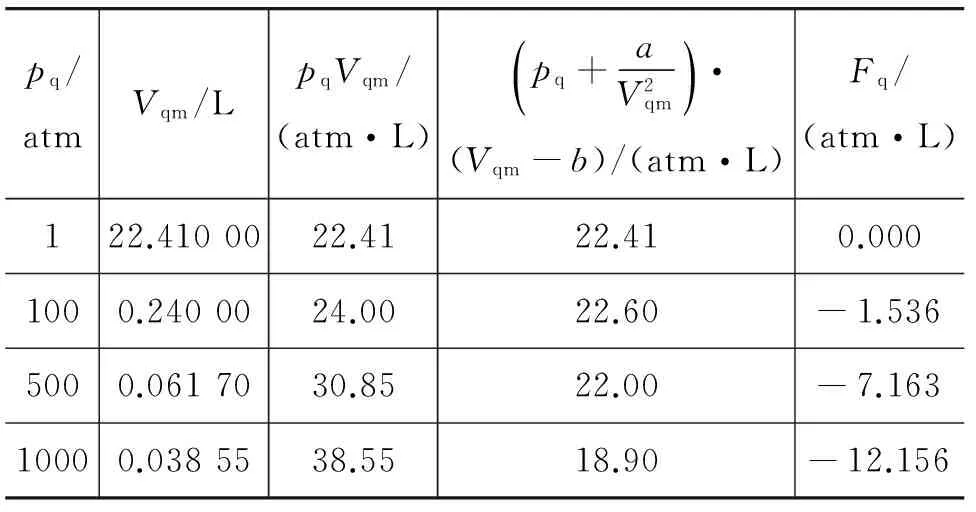
pq/atmVqm/LpqVqm/(atm·L)pq+aV2qm()·(Vqm-b)/(atm·L)Fq/(atm·L)122.4100022.4122.410.0001000.2400024.0022.60-1.5365000.0617030.8522.00-7.16310000.0385538.5518.90-12.156
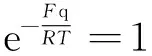
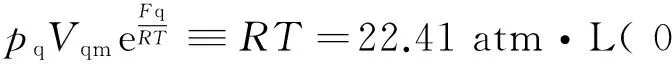
实例计算分析表明,实际气体的玻尔兹曼因子方程更加精确地描述了氢气在各种压强条件下的自然状态.较好地解决了“在实际应用中,如果需要较高的精度,即使在较低压强下范德瓦耳斯方程也不适用”[3]的公认缺陷问题.
3.3 涵盖并超越了唯象的维里方程
上式与昂内斯在20世纪初(1901年)提出(用幂级数表示)的唯象方程——维里方程
不仅形式上相似,而且完全可以取而代之:即先将pq,Vqm,T数值代入式(3),计算出Fq的数值,然后将Fq的数值视为常量代入式(3),并将式(3)当作半经验的方程,在pq±Δpq, Vqm±ΔVqm,T±ΔT区间或范围内替代唯象的维里方程进行具体的数值计算,不仅简便很多,而且表面自由能Fq的物理意义也比维里系数B,C,D,…更加明确,可以直接描述体系内部分子之间相互作用力的状态与体系边界层的物理性质(是引力势,还是斥力势及其大小)等.
3.4 精确计算摩尔表面自由能Fq
将式(3)改写为求解Fq的形式
Fq=RT(lnR+lnT-lnpq-lnVqm)
(4)
式(4)在可实验实测的宏观特性参量pq,Vqm,T与不可实验实测的摩尔表面自由能Fq之间架起了衔接的桥梁,不仅可以在定量上精确计算摩尔表面自由能Fq(详见3.2节表1中第5列Fq的精确计算值),而且摩尔表面自由能Fq的精确计算值,如实地描述了图2中气体分子平均间距(即气体的体积)的大小与分子相互作用合力大小逐点对应的自然特性:
摩尔表面自由能Fq>0 (引力势)表示气体分子平均间距大于图2中的r0时,分子之间的吸引力大于相邻分子之间的排斥力;
摩尔表面自由能Fq< 0 (斥力势)表示气体分子平均间距小于图2中的r0,气体分子之间的吸引力小于相邻分子之间的排斥力;
摩尔表面自由能Fq=0表示气体分子之间的平均间距等于图2中的r0或近似为∞(即理想气体状态),气体分子相互作用力为零.
式(4)真正在定量上实现了精确描述分子相互作用特性的目标.
3.5 精确描述气液相变的自然变化规律
组合应用气体与液体[8]的玻尔兹曼因子方程,即可在定量上精确描述气液相变或液气相变的自然变化规律.
3.5.1 精确描述等温压缩CO2气液共存体系的直线变化规律
组合应用气体与液体的玻尔兹曼因子方程,不仅可以如图3[9]所示,逐点对应地描述CO2实验实测等温线,而且可以推导出简洁的直线方程dV=-D1dmi(D1为≥0的常量),精确地描述等温压缩CO2气液共存体系时“古老的气液相变”的直线变化规律(即在气体达到饱和点B之后的等温压缩过程中,体系的饱和蒸气压保持不变,饱和蒸汽与液体的总体积,随着液化质量mi的增加而等比率地减小,这一过程持续到饱和蒸汽全部液化时的C点为止). 既较好地解决了“范氏方程给出的曲线不包含汽液两相共存的信息”的公认缺陷问题,又较好地克服了“对于古老的气液相变,……严格的气液相变统计理论,仍然是尚未全部解决的难题”[4]问题.
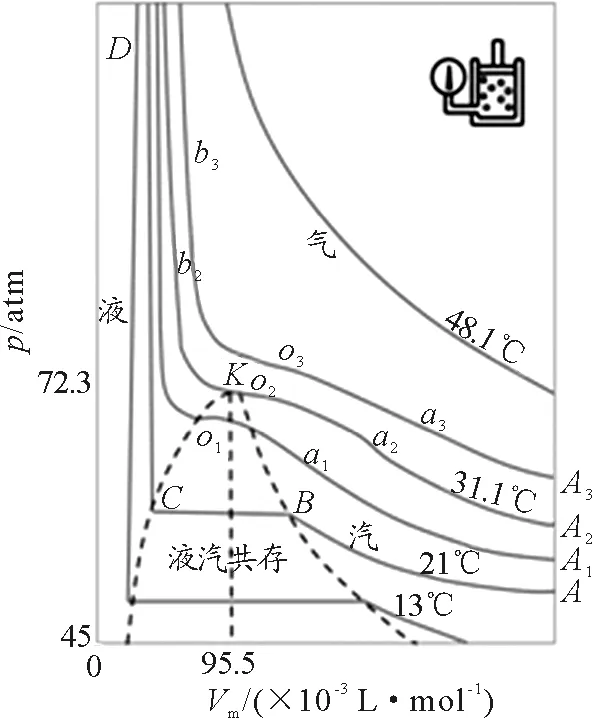
图3 CO2玻尔兹曼因子等温线[9]
3.5.2 更加准确地描述气体临界系数的趋同特性
应用玻尔兹曼因子方程式(3),即可直接给出气体临界系数Kk的数学表达式[6]
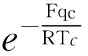
3.5.3 精确计算液气相变的气化热
应用液体的玻尔兹曼因子方程式(3)[8]导出液体气化热的理论公式[11],直接对物理性质迥异的单元液体物质——水、汞、乙醇、乙醚、苯胺的气化热进行纯理论计算的结果,与实验观测值高度吻合.相对误差:水在0~100℃区间内,均小于4%;汞、乙醇、乙醚、苯胺等物质在沸点时,也都小于7% .
3.5.4 精确计算液体的表面张力系数及其温度变化率
应用液体的玻尔兹曼因子方程式(2)[8]导出液体表面张力系数及其温度变化率的理论公式[12],对水、汞、乙醚、乙醇的表面张力系数进行理论计算的结果与实验观测值高度吻合,相对误差:水在0~80℃区间内均小于2.0%,汞小于4.0%,乙醚小于1.0%,乙醇小于6.0%;在0~80℃区间内对水的表面张力系数温度变化率进行理论计算的结果,不仅真实地描述了水的表面张力随温度的升高而减小的客观规律,而且理论计算结果与由实验观测值直接计算的结果,在数值上也吻合得很好.
4 结论
玻尔兹曼因子方法既包含了分子之间的吸引力,也包含了相邻分子之间的排斥力,巧妙地克服了“统计物理学处理互作用粒子系统所遇到的困难”[5];由玻尔兹曼因子方法推导出来的玻尔兹曼因子方程,不仅与传统基础知识一脉相承, 涵盖了理想气体方程、范氏方程与维里方程,而且真正打开了在定量上精确计算分子相互作用特性的大门,实现了精确计算摩尔表面自由能及其相关物理量的目标,较好地解决了范德瓦耳斯方程所存在的公认缺陷问题.
1 汤文辉,张若棋.物态方程理论及计算概论(第2版).北京:高等教育出版社,2008.6,47,10
2 梁希侠,班士良.统计热力学(第2版).北京:科学出版社,2008.241~242, 110~114
3 钱尚武,章立源,李椿.热学(第2版).北京:高等教育出版社,2008.52,24
4 于渌,郝柏林,陈晓松.边缘奇迹 相变和临界现象(第1版).北京:科学出版社,2005.25
5 汪志诚.热力学 统计物理(第4版). 北京:高等教育出版社,2008.265~270
6 吴义彬.实际气体的玻尔兹曼因子方程.江西科学,2011,29(1):11
7 张三慧.大学物理学 热学、光学、量子物理学(第3版).北京:清华大学出版社,2009.28
8 吴义彬.饱和蒸汽压下单元液体的物态方程及其应用.江西科学,2010,28(5):593
9 吴义彬.玻尔兹曼因子等温线对气液相变与临界系数的数学描述.物理通报,2014(6):109~114
10(美)卡尔L·约斯.MATHESON气体数据手册(第1版).陶鹏万,黄建彬,朱大方译.北京:化学工业出版社,200311吴义彬.气化热与沸点气化熵的理论计算——论证褚鲁统规则.物理通报,2013(7):90~93
12吴义彬.定量计算水表面张力系数及其温度变化率.物理通报,2015(1):103~106
Creating a Way of Precise Calculation of the Molecular Interaction Characteristics by Means of Boltzmann Factor Methods
Wu Yibin
(Nanchang Association of Senior Science and Technicians, Nanchang,Jiangxi 330003)
Van der Waals method conside only the attraction between molecules, without considering the repulsive force, So the Van der Waals equation is not quite consistent with the actual gas. Boltzmann factor method contains both the attraction between molecules and the repulsive between adjacent molecules. It skillfully overcome the difficulties of the statistical physics dealing with interacting particle system . So Boltzmann factor equation of the actual gas is derived by the Boltzmann factor method , it is not only come down in one continuous line with the traditional basic knowledge,which covers the ideal gas state equation, Van der Waals equation and Angneisi equation, but also creates a way of precise calculation on quantitative of the molecular interaction characteristics.It truly realized the precise calculation molar surface free energy and related physical quantities, it better solved the recognized defects of Van der Waals equation.
ideal gas equation; Van der Waals equation; virial equation; boltzmann factor equation
2015-10-08)
