饲料中木薯淀粉添加水平对鲤生长性能、消化能力及糖代谢的影响
2016-12-19李静辉王安琪孙金辉程镇燕白东清乔秀亭
范 泽 李静辉 王安琪 孙金辉 程镇燕 白东清 乔秀亭
(天津农学院水产学院,天津市水产生态及养殖重点实验室,天津300384)
饲料中木薯淀粉添加水平对鲤生长性能、消化能力及糖代谢的影响
范 泽 李静辉 王安琪 孙金辉 程镇燕 白东清 乔秀亭*
(天津农学院水产学院,天津市水产生态及养殖重点实验室,天津300384)
在实用饲料配方的基础上,添加5%(对照组)、10%与20%的木薯淀粉,配制成3种等脂(粗脂肪含量为6.7%左右)等能(总能为16 MJ/kg左右)饲料,在网箱中饲养平均体重为(55.73±3.55) g的鲤8周,研究饲料中木薯淀粉添加水平对鲤生长性能、消化能力及糖代谢的影响,以考察木薯淀粉替代饲料中鱼粉的可行性。每种饲料设3个重复,每个重复投喂50尾试验鱼。结果显示:鲤的增重率(WGR)、特定生长率(SGR)、蛋白质效率(PER)、肥满度(CF)均以20%木薯淀粉组为最高,显著高于5%木薯淀粉组(P<0.05),而肝体比则以20%木薯淀粉组为最低,显著低于5%木薯淀粉组(P<0.05)。随着木薯淀粉添加水平的升高,鲤的肠道蛋白酶活性呈下降趋势,5%木薯淀粉组显著高于20%木薯淀粉组(P<0.05)。10%木薯淀粉组的肠道脂肪酶活性显著高于5%和20%木薯淀粉组(P<0.05),10%木薯淀粉组的肠道淀粉酶活性显著高于20%木薯淀粉组(P<0.05)。血清中谷草转氨酶(AST)/谷丙转氨酶(ALT)及甘油三酯和总胆固醇含量随木薯淀粉添加水平的升高均呈下降的趋势,而血清总蛋白、高密度脂蛋白胆固醇含量均呈上升的趋势。随着木薯淀粉添加水平的升高,鲤的肝胰脏AST及ALT活性均呈上升趋势,且20%木薯淀粉组肝胰脏AST活性显著高于5%木薯淀粉组(P<0.05)。鲤肝胰脏6-磷酸果糖-1-激酶、丙酮酸激酶活性均随木薯淀粉添加水平的升高呈上升趋势,且20%木薯淀粉组显著高于5%木薯淀粉组(P<0.05)。20%木薯淀粉组肝胰脏葡萄糖-6-磷酸酶活性显著低于5%和10%木薯淀粉组(P<0.05),10%木薯淀粉组肝胰脏磷酸烯醇式丙酮酸羧激酶活性显著低于5%和20%木薯淀粉组(P<0.05)。根据本试验得出的结果并从饲料配制的成本考虑,鲤饲料中木薯淀粉添加水平为10%~20%时能够达到促进鱼体生长、维持机体正常的消化能力、保护肝功能的营养需求,并且能够有效调节糖酵解和糖异生关键酶活性。
鲤;木薯淀粉;消化能力;肝功能;糖代谢
糖类作为主要的能源物质,因其价格低廉、来源广泛,同时可对蛋白质起到节约作用等优点近年来被广泛应用于水产动物饲料中。但由于鱼类胰岛素受体数量不足、缺乏己糖激酶(HK)及葡萄糖激酶(GK)活性较低[1-2]等因素,不能像陆生哺乳动物那样高效利用饲料中的糖类。已有的研究表明相对于小分子糖类,结构相对复杂的淀粉的等大分子糖类更利于鱼体的吸收利用[3-4]。因此,近些年来,关于淀粉在水产饲料行业的应用研究比较活跃。
鲤(Cyprinuscarpio)因生长速度快、适应性强、食性杂、耐碱、耐缺氧、病害少、肉质鲜嫩爽口、价格便宜等特点,成为我国主导淡水养殖品种之一。目前,关于鲤的适宜饲料淀粉来源及添加水平均有研究,例如,鲤在摄食含0~13%玉米淀粉的饲料时会获得较好的生长效果[5];鲤在摄食添加10%小麦淀粉的饲料后生长性能及消化能力最优[6]。但上述研究均是以谷类淀粉对鲤生长与消化的影响为出发点,而薯类淀粉对鲤影响的研究鲜有报道。相较于谷类淀粉,薯类淀粉的直/支链淀粉比相对较低,即含有更多利于鱼类消化吸收的支链淀粉[7]。素有“淀粉之王”之称的木薯已成功地在畜禽饲料中得到应用,但因其亚麻苦苷含量较高,限制了其在水产饲料中的应用[8-10]。木薯加工产物木薯淀粉作为薯类淀粉的重要一类,剔除了上述弊端,在黏度、渗透力、成膜性等方面均优于玉米淀粉,且粗蛋白质、粗灰分含量比玉米淀粉低,因此木薯淀粉具有其不可替代的理化特性[11]。近几年来,水产工作者对木薯及木薯淀粉在水产饲料中的应用效果进行了探索。已有报道表明,在罗非鱼(Oreochromisniloticus)[8]、大口黑鲈(Micropterussalmoides)[9]、草鱼(Ctenopharyngodonidella)[10]饲料中添加木薯或木薯淀粉并不会阻碍其生长,相反还能够改善其对营养成分的吸收,改善肌肉品质。迄今,尚未出现将木薯淀粉应用在鲤饲料中的研究。
本试验通过在饲料中添加不同水平的木薯淀粉,研究饲料中木薯淀粉添加水平对鲤生长性能、消化能力及糖代谢的影响,探索鲤饲料中适宜的木薯淀粉添加水平,以期为木薯淀粉在水产饲料中合理化应用提供数据支撑,为优化鲤的饲料配方及配制低氮环保配合饲料奠定理论和实践基础。
1 材料与方法
1.1 试验饲料的制备
木薯淀粉购自广东省东莞东美食品有限公司,质量标准符合NY/T 875—2012《食用木薯淀粉》中1级要求,其水分、粗蛋白质、粗脂肪和粗灰分含量(干物质基础)分别为12.30%(<14.0%)、0.13%(<0.3%)、0.11%(<0.2%)和0.17%(<0.30%)[12]。
试验饲料以鱼粉(秘鲁鱼粉,粗蛋白质含量为64.0%)、豆粕(预压浸提,粗蛋白质含量为43.7%)、菜籽粕(预压浸提,粗蛋白质含量为36.2%)、棉籽粕(预压浸提,粗蛋白质含量为43.3%)、花生粕(预压浸提,粗蛋白质含量为46.2%)为蛋白质源,豆油为脂肪源,木薯淀粉为糖源,配制糖水平分别为5%(对照组)、10%和20%的3种等脂(粗脂肪含量为6.7%左右)等能(总能为16 MJ/kg左右)饲料,其组成及营养水平见表1。各饲料原料均通过粉碎机粉碎全部过60目筛,先将粉状原料混合均匀,再添加豆油,充分混合后使用天祥水产有限公司提供的江苏牧羊集团牧MUZLM V4型饲料制粒机制成直径为3.00 mm的沉性颗粒饲料,自然风干,用塑料袋密封保存于-20 ℃冰箱中备用。
试验饲料均在105 ℃烘干至恒重,然后分别采用杜马斯燃烧法(GB/T 24318—2009)、索氏抽提法(GB/T 5009.6—2010)及GR3500氧弹式热量计测定粗蛋白质、粗脂肪含量及总能。
1.2 试验鱼及养殖管理
试验在天津天祥水产有限责任公司的养殖池塘进行。试验用鱼为天津农学院养殖基地提供,试验前进行消毒处理,在3 m×3 m×3 m的网箱中暂养1周,期间投喂天津天祥水产有限公司提供的普通淡水鱼饲料。
暂养结束后挑选健壮、规格一致的初始体重为(55.73±3.55) g的鲤共450尾,作为试验用鱼进行分组。将挑选出的试验鱼随机分为3个组,每个组设置3个重复,每个重复50尾。养殖试验以重复为单位在1.0 m×1.0 m×1.5 m的沉性网箱中进行,试验持续8周。每天08:00、17:00各投喂1次。试验期间日投喂率为体重的4%。试验期间水温在28~32 ℃,pH为 7.8±0.2,溶解氧浓度高于6.0 mg/L,氨氮浓度小于0.52 mg/L,亚硝酸盐氮浓度小于0.08 mg/L。
1.3 样品制备与分析
1.3.1 样品制备
试验开始时,测定试验鱼初始体重,试验结束后,停食24 h,测定各组试验鱼的终末体重。每个重复中随机取出15尾鱼,测定体重、体长后,通过尾静脉抽血,每3尾鱼的全血置于同一离心管中,作为1个样本,用肝素钠抗凝并在4 ℃下以4 500 r/min离心15 min取上层血清,保存于-20 ℃冰箱备用;取血完毕后于冰盘上解剖鱼体,取肝胰脏以及肠道,并记录肝胰脏重量以计算其肝体比,然后将肝胰脏和肠道保存于-20 ℃冰箱备用。
粗酶液的制备:将保存于-20 ℃冰箱的肝胰脏及肠道用冰0.85%生理盐水漂洗,后用滤纸拭干,在匀浆器中加入9倍于组织块质量的冰0.85%生理盐水进行匀浆,在4 ℃下4 500 r/min离心15 min,取上层清液保存于-80 ℃冰箱待用。
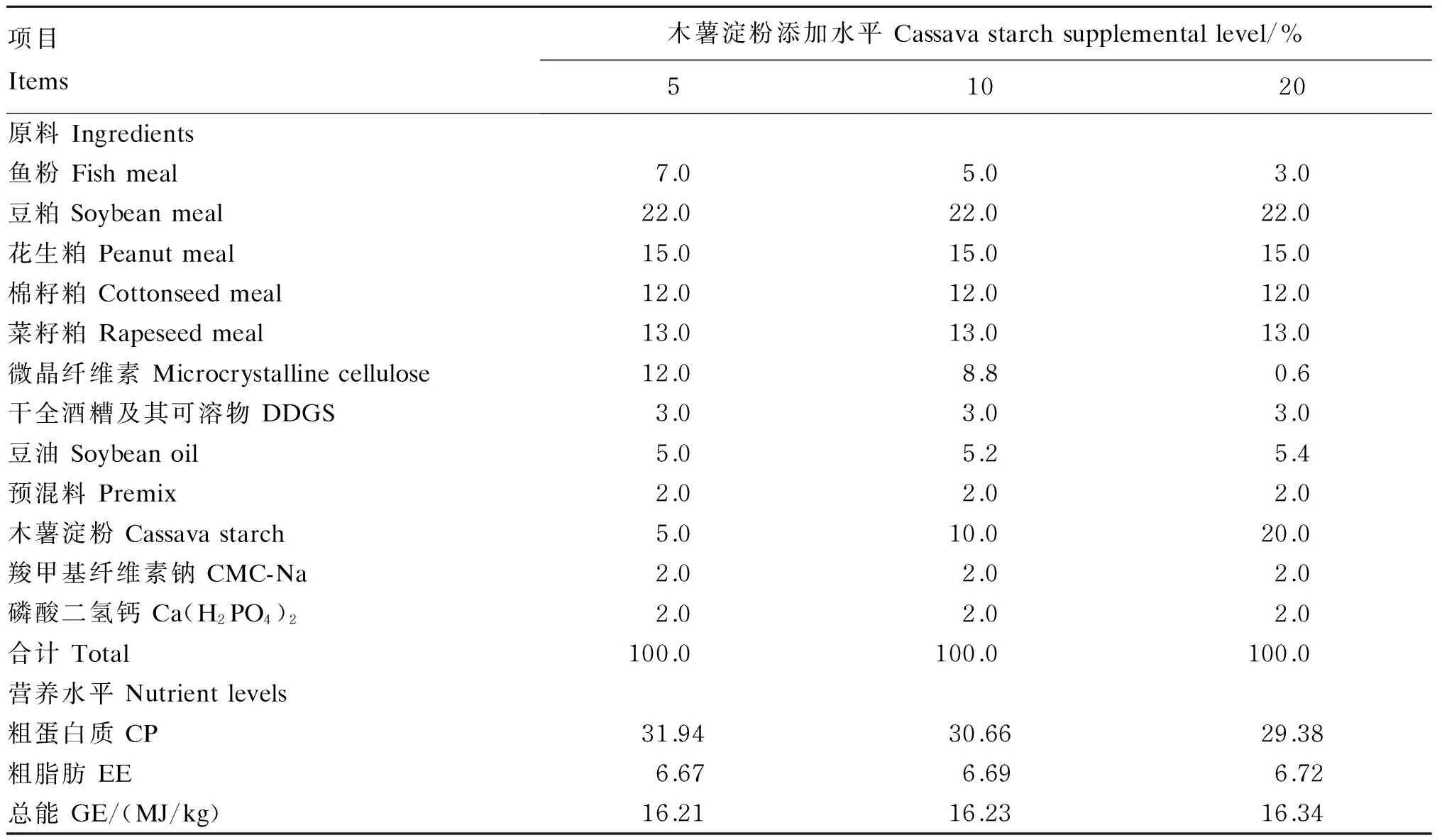
表1 试验饲料组成及营养水平 (风干基础)
预混料为每千克饲粮提供The premix provided the following per kg of diets:VA 1 500 IU,VB14.5 mg,VB25 mg,VB63.75 mg,VB125 mg,VD3500 IU,VE 25 mg,VK32.5 mg,生物素 biotin 0.03 mg,叶酸 folic acid 1 mg,D-泛酸D-pantothenic acid 5 mg,烟酸 nicotinic acid 25 mg,肌醇 inositol 20 mg,VC 30 mg,抗氧化剂 antioxidant 1 mg,Cu (as copper sulfate) 2.25 mg,Fe (as ferrous sulfate) 22.5 mg,Mn (as manganese sulfate) 0.5 mg,Zn (as zinc sulfate) 12.5 mg,I (as potassium iodide) 0.1 mg,Se (as sodium selenite) 0.005 mg,Co (as cobalt chloride) 0.075 mg。
1.3.2 指标测定与方法
血清生化指标以及肝胰脏、肠道消化酶活性均采用南京建成生物工程研究所生产的试剂盒进行检测。其中蛋白酶活性的测定采用福林-酚试剂法,淀粉酶活性的测定采用碘-淀粉比色法,脂肪酶活性的测定采用比浊法,谷草转氨酶(AST)及谷丙转氨酶(ALT)活性的测定均采用赖氏法。用于肝胰脏中糖代谢关键酶活性测定的酶联免疫吸附试验(ELISA)试剂盒均为上海酶联生物科技有限公司生产。
1.3.3 计算公式
增重率(WGR,%)=100×(Wt-W0)/W0;
特定生长率(SGR,%/d)=100×(lnWt-
lnW0)/t;
饲料系数(FCR)=F/(Wt-W0);
蛋白质效率(PER,%)=100×(Wt-W0)/
(F×P);
肝体比(HSI,%)=100×Wg/Wt;
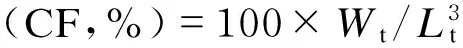
式中:W0为试验开始时鱼体重(g);Wt为试验结束时鱼体重(g);F为饲料摄入量干重(g);P为饲料中粗蛋白质含量(%);Wg为肝胰脏质量(g);Lt为试验结束时鱼体长(cm);t为试验天数(d)。
1.4 数据处理与统计分析
采用SPSS 17.0软件对数据进行统计分析。先对数据进行单因素方差分析,若组间差异显著,再用Duncan氏法进行多重比较,显著水平为P<0.05。试验数据以平均值±标准差表示。
2 结 果
2.1 饲料中木薯淀粉添加水平对鲤生长和形态学指标的影响
由表2可知,随着木薯淀粉添加水平的升高,鲤的增重率、特定生长率、蛋白质效率及肥满度呈逐渐上升趋势,而饲料系数及肝体比则呈逐渐降低的趋势。增重率、特定生长率、蛋白质效率及肥满度均以木薯淀粉添加水平为20%时最大,且均显著高于木薯淀粉添加水平为5%时(P<0.05);而饲料系数及肝体比均以木薯淀粉添加水平为20%时最小,且均显著低于木薯淀粉添加水平为5%时(P<0.05)。

表2 饲料中木薯淀粉添加水平对鲤生长和形态学指标的影响
同行数据肩标不同小写字母表示差异显著(P<0.05)。下表同。
Values in the same row with different small letter superscripts indicated significant difference (P<0.05). The same as below.
2.2 饲料中木薯淀粉添加水平对鲤肠道消化酶活性的影响
由表3可知,随着木薯淀粉添加水平的升高,鲤的肠道蛋白酶活性呈下降趋势,以木薯淀粉添加水平为5%时为最高,且显著高于木薯淀粉添加水平为20%时(P<0.05)。鲤的肠道淀粉酶及脂肪酶活性随木薯淀粉添加水平的升高呈先上升后下降的趋势,均以木薯淀粉添加水平为10%时为最高,其中肠道淀粉酶活性显著高于木薯淀粉添加水平为20%时(P<0.05),肠道脂肪酶活性显著高于木薯淀粉添加水平为5%和20%时(P<0.05)。
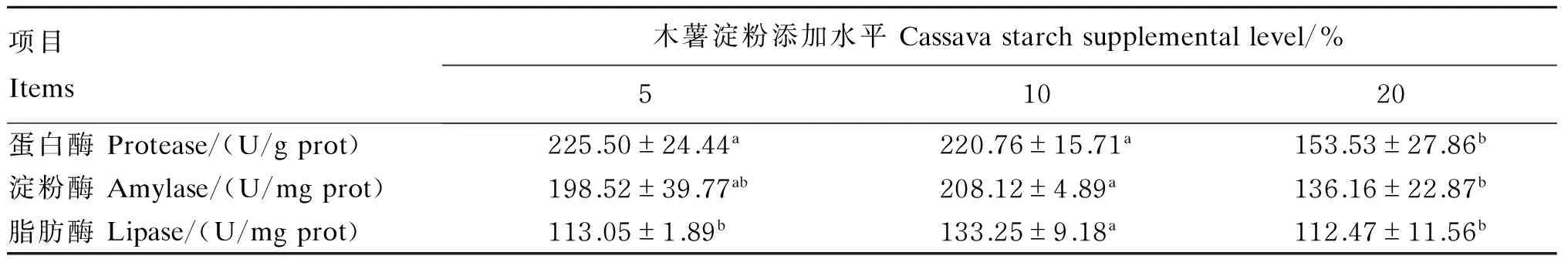
表3 饲料中木薯淀粉添加水平对鲤肠道消化酶活性的影响
2.3 饲料中木薯淀粉添加水平对鲤血清及肝胰脏转氨酶活性的影响
由表4可知,随着木薯淀粉添加水平的升高,鲤的血清AST活性呈先上升后下降的趋势,以木薯淀粉添加水平为10%时为最高,且显著高于木薯淀粉添加水平为20%时(P<0.05)。鲤的血清ALT活性随着木薯淀粉添加水平的升高呈逐渐上升的趋势,以木薯淀粉添加水平为20%时为最高,且显著高于木薯淀粉添加水平为5%时(P<0.05)。随着木薯淀粉添加水平的升高,鲤的血清AST/ALT呈下降的趋势,以木薯淀粉添加水平为20%时为最低,且显著低于木薯淀粉添加水平为5%时(P<0.05)。
由表5可知,随着木薯淀粉添加水平的升高,鲤的肝胰脏AST及ALT活性均呈上升趋势,均以木薯淀粉添加水平为20%时为最高,且其肝胰脏AST活性显著高于木薯淀粉添加水平为5%时(P<0.05)。
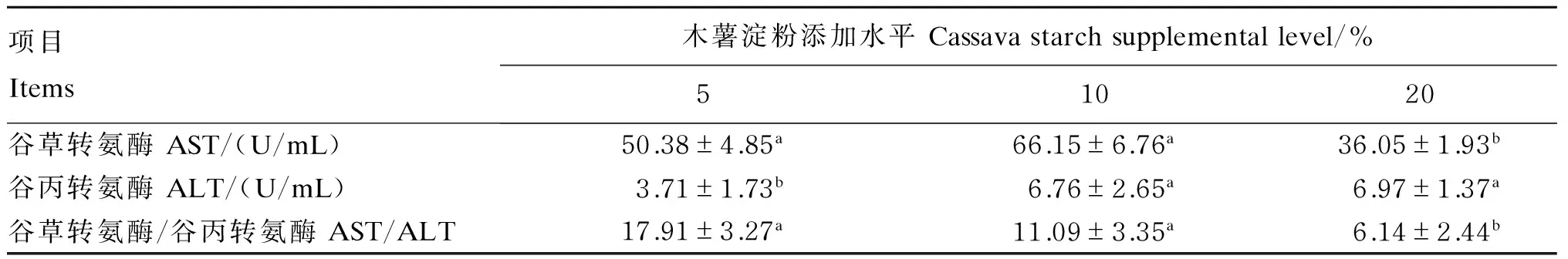
表4 饲料中木薯淀粉添加水平对鲤血清转氨酶活性的影响

表5 饲料中木薯淀粉添加水平对鲤肝胰脏转氨酶活性的影响
2.4 饲料中木薯淀粉添加水平对鲤血清生化指标的影响
由表6可知,随着木薯淀粉添加水平的升高,鲤的血清总蛋白、葡萄糖及高密度脂蛋白胆固醇含量呈升高趋势,均以木薯淀粉添加水平为20%时为最高,除葡萄糖外,均显著高于木薯淀粉添加水平为5%时(P<0.05)。鲤的血清甘油三酯及总胆固醇含量随木薯淀粉添加水平的升高呈下降趋势,均以木薯淀粉添加水平为20%时为最低,且显著低于木薯淀粉添加水平为5%时(P<0.05)。饲料中木薯淀粉添加水平未对鲤血清尿素氮及低密度脂蛋白胆固醇含量产生显著影响(P>0.05)。
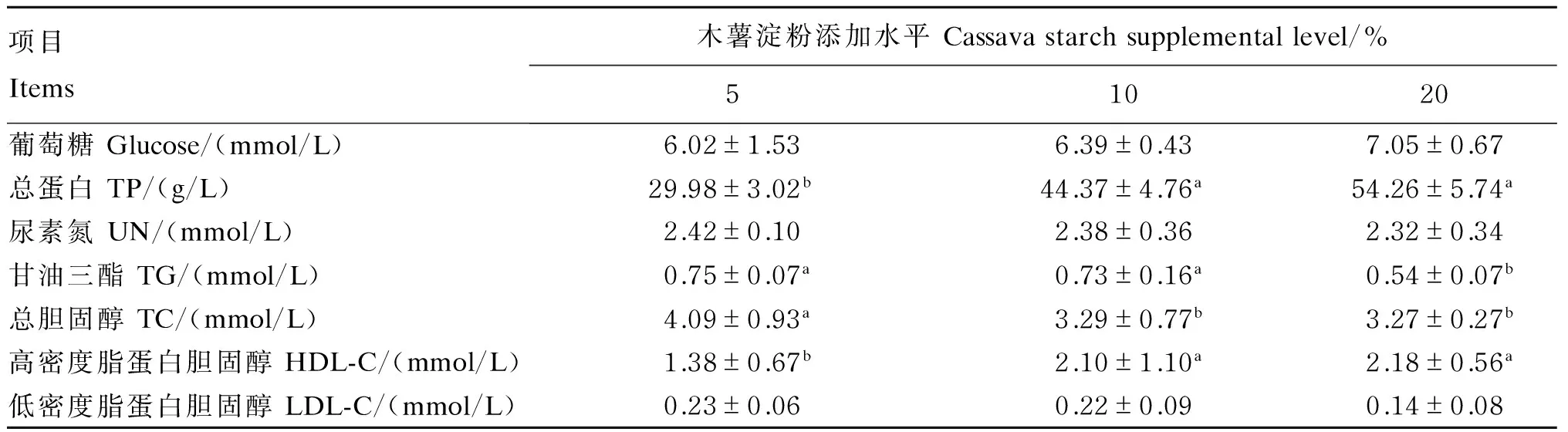
表6 饲料中木薯淀粉添加水平对鲤血清生化指标的影响
2.5 饲料中木薯淀粉添加水平对鲤肝胰脏糖代谢关键酶活性的影响
由表7可知,鲤肝胰脏6-磷酸果糖-1-激酶、丙酮酸激酶活性均随木薯淀粉添加水平的升高呈上升趋势,以木薯淀粉添加水平为20%时为最高,且显著高于木薯淀粉添加水平为5%时(P<0.05)。
由表8可知,鲤肝胰脏葡萄糖-6-磷酸酶活性随木薯淀粉添加水平的升高呈下降趋势,以木薯淀粉添加水平为20%时为最低,且显著低于木薯淀粉添加水平为5%和10%时(P<0.05)。鲤肝胰脏磷酸烯醇式丙酮酸羧激酶活性随木薯淀粉添加水平的升高呈先下降后上升的趋势,以木薯淀粉添加水平为10%时为最低,且显著低于木薯淀粉添加水平为5%和20%时(P<0.05)。

表7 饲料中木薯淀粉添加水平对鲤糖酵解关键酶活性的影响

表8 饲料中木薯淀粉添加水平对鲤糖异生关键酶活性的影响
3 讨 论
3.1 饲料中木薯淀粉添加水平对鲤生长性能的影响
从本试验结果可以看出,饲料中添加木薯淀粉对鲤生长性能不仅未产生负面影响,而且随着木薯淀粉水平升高,鲤展现了良好的增重趋势和饲料利用效果,上述结果从生长性能方面印证了木薯淀粉可以被应用在水产动物饲料中,节约饲料中鱼粉用量,从而实现饲料鱼粉用量至最小化和鱼类生长效果至最优化。上述结果与田雪等[13]在木薯粉对罗非鱼生长、饲料利用和鱼体营养成分影响的研究及Olurin等[14]在木薯粉对非洲鲇(Cluriusguriepiuu)生长性能影响的研究中所得结果一致,说明饲料中添加木薯粉或木薯淀粉对不同食性的鱼类均可达到促进生长的效果。但从马霞等[15]对乌鳢(Channaargus)的研究来看,随着饲料中木薯粉添加比例的增大,生长性能随之呈下降趋势,但影响并不显著,这一结果是与本试验结果存在差异的,主要原因可能是由于在本研究及田雪等[13]对罗非鱼的研究中所采用的木薯淀粉或木薯粉经生物技术处理,降低了某些抗营养因子(如浓缩丹宁、亚麻苦苷等)的含量。
孙金辉等[5]在鲤饲料中添加玉米淀粉的研究中发现,随玉米淀粉水平的升高,鲤饲料利用率随之降低,而蛋白质效率呈升高趋势,说明在有限的饲料利用率条件下,玉米淀粉仍能够促进鱼体高效地吸收利用饲料中蛋白质,这与本试验中呈现的结果一致,但吸收后的蛋白质利用去向存在差异。本试验发现,增重率、特定生长率及肥满度均随木薯淀粉添加水平的升高而升高,肝体比呈现下降的趋势。鱼类肝体比被视为对长期和短期营养方式均很敏感的指标,一般作为肝脏或者内脏中脂肪或者糖原蓄积的表观指标,而肥满度被视为鱼类生物学研究中衡量生长和摄食强度等健康状况的指标[16],综合分析肝体比与肥满度变化情况可以看出,鱼体获得良好的肥满度并不是因为饲料蛋白质或糖转变为脂肪或者糖原蓄积在肝脏或内脏中,而是因为糖水平的适宜升高提升了鲤充分吸收利用高糖饲料的能力,进而提高饲料转化率,也从侧而印证了饲料糖对蛋白质的节约作用,而鲤饲料中添加玉米淀粉后所呈现的结果与之相反,主要原因是由于2种淀粉的直链与支链淀粉比例不同,这与杨伟[17]的研究结果一致。
相比于陆生动物,鱼类对糖的利用程度相对较低,海水鱼类及淡水鱼类饲料糖水平分别不宜超过20%和40%。本试验中,以木薯淀粉添加水平为20%时鲤的生长性能及饲料利用效果为最好,未涉及高于20%的木薯淀粉添加水平,因此需要今后进一步进行研究。
3.2 饲料中木薯淀粉添加水平对鲤消化能力的影响
消化是影响淀粉用于鱼体生长的第一限制因素。作为与淀粉消化关系最为密切的酶类,淀粉酶活性的高低反映了机体利用饲料中淀粉的能力。本试验发现,随着木薯淀粉添加水平的升高,鲤肠道淀粉酶的活性呈先上升后下降的变化趋势,这一变化趋势与孙金辉等[5]对鲤研究中所得结果一致,说明本研究中添加适宜水平的木薯淀粉能够提升肠道分泌淀粉酶的能力,增强淀粉酶的活性。但需要注意的是在2个研究中淀粉酶活性最高时的淀粉添加水平并不相同,木薯淀粉为10%时,而玉米淀粉为6.5%时,说明鲤对于2种淀粉的利用能力存在差异。对于同一种鱼类,淀粉的颗粒大小和直链与支链淀粉比例是影响其消化淀粉的主要因素[18]。已有研究表明,支链淀粉易被酶水解,因此直链与支链淀粉比例小的淀粉利于鱼体利用[19-20]。相较于玉米淀粉,木薯淀粉中支链淀粉含量较多,直链淀粉∶支链淀粉可达到20∶80[21],因此本研究发现鲤在一定程度上表现出对木薯淀粉的消化能力强于玉米淀粉。
本试验表明,随着饲料中木薯淀粉添加水平在一定程度上的上升,鲤对糖的摄入量增加,肠道内脂肪酶活性呈先上升后下降趋势,蛋白酶活性则处于下降趋势。强俊等[22]研究得出,随着奥尼罗非鱼(Oreochromisniloticus×O.aureus)对糖摄入量的增加,肠道淀粉酶和蛋白酶活性显著上升。这与本研究结果存在一定的差异,可能是因为饲料糖水平或是鱼种、投喂频率、生长阶段等存在一定差异。
3.3 饲料中木薯淀粉添加水平对鲤肝功能的影响
三大营养物质蛋白质、脂肪及糖三者相互转化过程中转氨酶起着极其重要的作用,转氨酶是催化酮酸和氨基酸之间的氨基酸转移的一类酶,种类多样,其中最重要的是AST和ALT[23]。本试验结果表明,随着木薯淀粉添加水平的升高,估计肝脏损伤程度的血清AST/ALT有下降的趋势,即鲤肝脏的受损伤程度减弱,说明木薯淀粉在一定程度上有护肝功效。张伟涛等[24]以添加5种发酵木薯渣的饲料饲喂罗非鱼后得到与本试验一致的结果。而马霞等[15]在对乌鳢的研究中发现木薯粉高比例添加可能会损伤鱼体的肝脏,与本研究结果不符的原因可能是由于本试验所采用的木薯淀粉经过生物技术处理,降低了抗营养因子的含量。此外,本研究也发现,随着木薯淀粉添加水平的升高,肝胰脏中AST和ALT活性随之提升,再次说明鲤肝脏受损伤程度在减弱,在一定程度上促进了体内蛋白质代谢活动,提高了机体的蛋白质和氨基酸利用率。
3.4 饲料中木薯淀粉添加水平对鲤血清生化指标的影响
鱼类的血清生化指标与机体的代谢和健康营养状况有关,因此通常用血清生化指标来表示鱼类营养物质代谢的情况[25]。本试验结果表明,在鲤配合饲料中,随着木薯淀粉添加水平的升高,鲤血清葡萄糖含量呈上升趋势,这与在花鲈(Lateolabraxjaponicus)[26]、大黄鱼(LarimichthyscroceaRichardson)[27]等的研究中所得结果相符,说明鱼体血清葡萄糖含量与饲料中淀粉水平呈正相关。而在乌鳢的研究中发现,木薯粉添加水平的升高并未显著影响乌鳢血清葡萄糖含量[15],这可能与试验鱼的种类及木薯粉添加水平等不同有关。
血脂包括血液中的甘油三酯、磷脂、总胆固醇及其酯和游离脂肪酸等脂类,这些脂类在血液中以脂蛋白的形式存在并且运输。鱼类和其他脊椎动物一样,可以自身合成胆固醇,血液里的胆固醇70%~80%来自肝脏。如果肝细胞功能障碍,血液里的胆固醇含量快速升高[28]。本试验结果表明,鲤血清总胆固醇及甘油三酯含量随木薯淀粉添加水平的升高而下降,说明饲料中添加木薯淀粉可以降低鲤的血脂含量,同时从侧面反映了木薯淀粉的添加对于鲤有一定的护肝功能。而在总胆固醇中,高密度脂蛋白胆固醇被视为“好”胆固醇,主要是作为脂质的清道夫,而低密度脂蛋白胆固醇,尤其是经氧化修饰的低密度脂蛋白胆固醇(Ox-LDL-C)则被视为“坏”胆固醇[29]。本试验发现,鲤血清高密度脂蛋白胆固醇含量随木薯淀粉添加水平的升高呈升高趋势,而血清低密度脂蛋白胆固醇含量则相反,因此可以推测木薯淀粉可能通过调节体内“好”胆固醇和“坏”胆固醇的相对含量来抑制血脂含量升高。但关于木薯淀粉降低鱼类血脂的分子机理需进一步研究。
血清总蛋白含量可在一定程度上能够反映饲料中蛋白质的供给水平、动物机体自身对蛋白质的消化吸收能力及机体内蛋白质代谢情况。在本试验中,鲤血清总蛋白含量随木薯淀粉添加水平的升高即饲料蛋白质水平降低呈升高趋势,这说明在饲料蛋白质供给水平有限的情况下,血清总蛋白的沉积率并未降低,说明木薯淀粉能有效促进鱼体吸收饲料中的蛋白质,也再次印证了饲料糖对蛋白质的节约作用。此外,本试验还发现能够较准确反映机体内蛋白质代谢情况的血清尿素氮含量随木薯淀粉添加水平的升高亦呈降低趋势,说明饲料蛋白质水平的降低减轻了鲤蛋白质代谢的负担,同时未影响鲤的生长状况。以上研究结果与李彬等[30]在草鱼及Bibiano等[31]在克林雷氏鲶(Rhamdiaquelen)上的研究结果一致。
3.5 饲料中木薯淀粉添加水平对鲤糖代谢的影响
和其他动物一样,糖酵解也是鱼类最主要的葡萄糖代谢途径。1分子的葡萄糖经过一系列连续的氧化反应形成2分子的丙酮酸。在这个过程中存在3个关键限速酶对糖酵解过程进行调控,即己糖激酶、6-磷酸果糖-1-激酶及丙酮酸激酶。已有研究证明,同哺乳动物一样,摄食高糖低蛋白质饲料的虹鳟鱼肝脏中6-磷酸果糖-1-激酶的活性高于摄食高蛋白质低糖饲料的虹鳟[32],本试验发现高木薯淀粉低蛋白质饲料也显著提高了鲤肝胰脏6-磷酸果糖-1-激酶活性,这在金头鲷(Sprusaurata)[33]的研究中所得结果一致。目前的研究结果表明,饲料中糖水平对丙酮酸激酶活性的调控存在差异。本试验发现鲤肝胰脏丙酮酸激酶活性随木薯淀粉添加水平的升高呈上升趋势,与在草鱼[34]的研究中所得结果相一致,但在大黄鱼的研究中发现小麦粉淀粉水平的升高对肝胰脏丙酮酸激酶活性并无显著影响[27],产生这种差异的原因可能与试验鱼种类、淀粉种类及试验鱼自身对淀粉代谢能力的差异性有关。
糖异生是由简单的非糖前体(乳酸、甘油、生糖氨基酸等)转变为糖(葡萄糖或糖原)的过程。但糖异生并不是糖酵解的简单逆转。葡萄糖-6-磷酸酶、果糖-1,6-二磷酸酶、磷酸烯醇式丙酮酸激酶是控制糖异生的关键限速酶。本研究发现,升高木薯淀粉添加水平会鲤肝脏葡萄糖-6-磷酸酶及磷酸烯醇式丙酮酸激酶活性的下降,这与Panserat等[35]之前关于鲤的研究结果一致,但在大黄鱼[29]的研究中发现饲料中高小麦淀粉水平并未显著抑制肝脏中葡萄糖-6-磷酸酶及磷酸烯醇式丙酮酸激酶活性,导致这种差异的原因可能是所选试验鱼种类、淀粉种类及试验鱼食性不同。从上述结果可以看出,在本试验条件下,鲤在摄食高木薯淀粉低蛋白质饲料后糖酵解能力会出现适应性的增强,糖异生途径出现调节性的减弱,但需注意的是鲤血清葡萄糖含量却呈升高趋势,说明鲤通过糖代谢途径调节血糖水平处于动态平衡的能力仍需加强。
4 结 论
在本试验条件下,木薯淀粉添加水平为10%~20%时对鲤的促生长效果较好,能够在一定程度上提升鲤对淀粉和脂肪的消化能力,保护肝脏健康,改善糖代谢能力,提升糖酵解能力,实现木薯淀粉对饲料中鱼粉的节约作用。
[1] FURUICHI M,YONE Y.Availability of carbohydrate in nutrition of carp and red sea bream[J].Nippon Suisan Gakkaishi,1982,48(7):945-948.
[2] 罗毅平,谢小军.鱼类利用碳水化合物的研究进展[J].中国水产科学,2010,17(2):381-390.
[3] CUI X J,ZHOU Q C,LIANG H O,et al.Effects of dietary carbohydrate sources on the growth performance and hepatic carbohydrate metabolic enzyme activities of juvenile cobia (RachycentroncanadumLinnaeus.)[J].Aquaculture Research,2010,42(1):99-107.
[4] HEMRE G I,TORRISSEN O,KROGDAHL Å,et al.Glucose tolerance in Atlantic salmon,SalmosalarL.,dependence on adaption to dietary starch and water temperature[J].Aquaculture Nutrition,1995,1(2):69-75.
[5] 孙金辉,范泽,程镇燕,等.饲料中玉米淀粉添加水平对鲤生长性能、消化酶活性及血清生化指标的影响[J].动物营养学报,2016,28(4):1152-1159.
[6] 孙金辉,范泽,金东华,等.饲料糖水平与投喂频率对鲤生长性能、肠道消化能力及肝功能的影响[J].中国饲料,2016(11):29-35.
[7] 叶元土,蔡春芳.鱼类营养与饲料配制[M].北京:化学工业出版社,2013:117-118.
[8] 田雪,孟晓林.木薯粉在罗非鱼饵料中的适口性研究[J].河北渔业,2010(8):5-7.
[9] 徐祥泰,陈乃松,刘子科,等.饲料中不同淀粉源及水平对大口黑鲈肝脏组织学的影响[J].上海海洋大学学报,2016,25(1):61-70.
[10] 尹晓静,叶元土,金素雅,等.玉米、小麦和木薯对草鱼幼鱼(Ctenopharyngodonidellajuveniles)生长性能的影响[J].中国粮油学报,2010,25(8):70-76.
[11] 李丹辰,陈丽娇,梁鹏,等.木薯淀粉与木薯变性淀粉鱼糜加工性质的影响[J].中国粮油学报,2014,29(8):60-64.
[12] 中华人民共和国农业部农垦局.NY/T 875—2012 食用木薯淀粉[S].北京:中国农业出版社,2012.
[13] 田雪,华雪铭,周洪琪,等.木薯粉对罗非鱼生长、饲料利用和鱼体营养成分的影响[J].水产学报,2008,32(1):71-76.
[14] OLURIN K B,OLOJO E A,OLUKOYA O A.Growth of African catfishClariasgariepinufingerlings,fed different levels of cassava[J].West African Journal of Zoology,2006,1(1):54-56.
[15] 马霞,陈效儒,潘瑜,等.乌鳢饲料中木薯粉替代不同比例面粉的营养效果[J].动物营养学报,2015,27(11):3597-3603.
[16] PERES H,OLIVA-TELES A.Effect of dietary lipid level on growth performance and feed utilization by European sea bass juveniles (Dicentrarchuslabrax)[J].Aquaculture,1999,179(1/2/3/4):325-334.
[17] 杨伟.饲料中直链/支链淀粉比对罗非鱼生长、饲料利用及肠道健康的影响[D].硕士学位论文.厦门:集美大学,2012.
[18] KROGDAHL Å,HEMRE G I,MOMMSEN T P.Carbohydrates in fish nutrition:digestion and absorption in post larval stages[J].Aquaculture Nutrition,2005,11(2):103-112.
[19] GAYLORD T G,BARROWS F T,RAWLES S D,et al.Apparent digestibility of nutrients and energy in extruded diets from cultivars of barley and wheat selected for nutritional quality in rainbow troutOncorhynchusmykiss[J].Aquaculture Nutrition,2009,15(3):306-312.
[20] ZOBEL H F.Molecules to granules:a comprehensive starch review[J].Starch,1988,40(2):44-50.
[21] 杨晓惠.木薯淀粉的理化性质及其抗性淀粉制备工艺研究[D].硕士学位论文.广州:暨南大学,2011.
[22] 强俊,王辉,彭俊,等.饲料碳水化合物水平对奥尼罗非鱼仔稚鱼生长的影响[J].饲料工业,2009,30(14):32-35.
[23] 王丽宏,叶元土,张宝彤,等.几种养殖鱼类血清转氨酶活性参考值的探讨[J].饲料工业,2011,32(24):18-20.
[24] 张伟涛,叶元土,尹晓静,等.五种发酵木薯渣在罗非鱼饲料中应用的养殖性能比较[J].饲料工业,2008,29(8):28-32.
[25] DJANGMAH J S.The effects of feeding and starvation on copper in the blood and hepatopancreas,and on blood proteins ofCrangovillgaris(Fabricius)[J].Comparative Biochemistry and Physiology,1970,32(4):709-731.
[26] 窦兵帅,梁萌青,郑珂珂,等.饲料中碳水化合物水平对鲈鱼生长、生理状态参数及体组成的影响[J].渔业科学进展,2014,35(1):46-54.
[27] 王猛强,黄文文,周飘苹,等.不同蛋白质和小麦淀粉水平对大黄鱼生长性能、糖酵解和糖异生关键酶活性的影响[J].水产学报,2015,39(11):1690-1701.
[28] 邹思湘.动物生物化学[M].北京:中国农业出版社,2005.
[29] 廖端芳,唐朝克.胆固醇逆向转运基础与临床[M].北京:科学出版社,2009.
[30] 李彬,梁旭方,刘立维,等.饲料蛋白水平对大规格草鱼生长、饲料利用和氮代谢相关酶活性的影响[J].水生生物学报,2014,38(2):233-240.
[31] BIBIANO MELO J F,LUNDSTEDT L M,METN I,et al.Effects of dietary levels of protein on nitrogenous metabolism ofRhamdiaquelen(Teleostei:Pimelodidae)[J].Comparative Biochemistry and Physiology Part A,2006,145(2):181-187.
[32] WALTON M J.Metabolic effects of feeding a high protein/low carbohydrate diet as compared to a low protein/high carbohydrate diet to rainbow troutSalmogairdneri[J].Fish Physiology and Biochemistry,1986,1(1):7-15.
[33] METON I,CASERS A,FEMANDES F,et al.6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase gene expression is regulated by diet composition and ration size in liver of gilthead sea bream,Sparusaurata[J].Biochimica et Biophysica Acta:Gene Structure and Expression,2000,1491(1/2/3):220-228.
[34] YUAN X C,ZHOU Y,LIANG X F,et al.Molecular cloning,expression and activity of pyruvate kinase in grass carpCtenopharyngodonidella:effects of dietary carbohydrate level[J].Aquaculture,2013,410/411:32-40.
[35] PANSERAT S,PLAGNESl J E,KAUSHIK S.Gluconeogenic enzyme gene expression is decreased by dietary carbohydrates in common carp (Cyprinuscarpio) and gilthead seabream (Sparusaurata)[J].Biochimica et Biophysica Acta:Gene Structure and Expression,2002,1579(1):35-42.
*Corresponding author, professor, E-mail: qxt65@sohu.com
(责任编辑 菅景颖)
Effects of Dietary Cassava Starch Supplemental Level on Growth Performance, Digestive Ability and Glycometabolism of Common Carp
FAN Ze LI Jinghui WANG Anqi SUN Jinhui CHENG Zhenyan BAI Dongqing QIAO Xiuting*
(TianjinKeyLabofAqua-EcologyandAquaculture,CollegeofFisheries,TianjinAgriculturalUniversity,Tianjin300384,China)
An 8-week feeding experiment was conducted to study the effects of dietary cassava starch supplemental level on growth performance, digestive ability and glycometabolism of common carp, in order to investigate the feasibility of replacement of fish meal with cassava starch in diets for common carp. Three isolipidic (crude lipid content was about 6.7%) and isoenergetic (gross energy was about 16 MJ/kg) experimental diets were formulated with 5%, 10% and 20% cassava starch on basis of practical diet formulation, respectively. Common carp with the average body weight of (55.73±3.55) g were randomly allocated to 3 groups with 3 replicates per group and 50 fish per replicate, and the fish in the 3 groups were randomly fed one of three diets. The results showed as follows: the highest values of weight gain rate (WGR), specific growth rate (SGR), protein efficient ratio (PER) and condition factor (CF) were observed in the 20% cassava starch group and they were significantly higher than those in the 5% cassava starch group (P<0.05); the lowest value of hepatosomatic index (HSI) was observed in the 20% cassava starch group and it was significantly lower than that in the 5% cassava starch group (P<0.05). With the cassava starch supplemental level increasing, the intestinal protease activity showed a decrease trend, and 5% cassava starch group was significantly higher than 20% cassava starch group (P<0.05). The intestinal lipase activity in 10% cassava starch group was significantly higher than that in 5% and 20% cassava starch groups (P<0.05). The intestinal amylase activity in 10% cassava starch group was significantly higher than that in 20% cassava starch group (P<0.05). With the cassava starch supplemental level increasing, serum aspartate aminotransferase (AST)/alanine aminotransferase (ALT) and the contents of triglyceride and total cholesterol all showed a decrease tend, while the contents of serum total protein and high density lipoprotein cholesferol all showed an increase trend. The activities of hepatopancreas AST and ALT were increased with the cassava starch supplemental level increasing, and the hepatopancreas AST activity in 20% cassava starch group was significantly higher than that in 5% cassava starch group (P<0.05). With the cassava starch supplemental level increasing, the activities of hepatopancreas phosphofructokinase-1 (PFK-1) and pyruvatekinase (PK) all showed an increase trend, and 20% cassava starch group was significantly higher than 5% cassava starch group (P<0.05). The activity of hepatopancreas glucose-6-phosphatase (G6Pase) in 20% cassava starch group was significantly higher than that in 5% and 10% cassava starch groups (P<0.05), while the activity of hepatopancreas phosphoenolpyruvate (PEPCK) in 10% cassava starch group was significantly higher than that in 5% and 20% cassava starch groups (P<0.05). Combined the results of this study and the cost of feed production, supplementing 10% to 20% cassava starch in the diet can meet the requirements for growth, hepatic function and digestive capacity of common carp, and can effectively adjust the glycolysis and gluconeogenic key enzyme activities.[ChineseJournalofAnimalNutrition, 2016, 28(12):4044-4053]
common carp; cassava starch; digestive ability; hepatic function; glycometabolism
10.3969/j.issn.1006-267x.2016.12.040
2016-06-14
天津市科技支撑计划项目(13ZCZDNC00900);天津市应用基础与前沿技术研究计划(14JCQNJC15100)
范 泽(1992—),男,内蒙古扎兰屯人,硕士研究生,研究方向为水产动物营养与饲料。E-mail: dankey1534417945@163.com
*通信作者:乔秀亭,教授,硕士生导师,E-mail: qxt65@sohu.com
S963.1
A
1006-267X(2016)12-4044-10
