抗红斑丹毒丝菌的rSpaA蛋白猪源单链抗体库构建及单链抗体淘选
2016-12-19王锐葛猛陈一苇方超柴强强李润成余兴龙
王锐,葛猛,陈一苇,方超,柴强强,李润成,余兴龙
(湖南农业大学动物医学院,湖南 长沙 410128)
抗红斑丹毒丝菌的rSpaA蛋白猪源单链抗体库构建及单链抗体淘选
王锐,葛猛,陈一苇,方超,柴强强,李润成,余兴龙*
(湖南农业大学动物医学院,湖南 长沙 410128)
从免疫过rSpaA的猪的脾淋巴细胞中提取总RNA,采用RT–PCR技术反转录合成cDNA。设计兼并引物扩增抗体重链可变区(VH)和轻链可变区(VL)基因片段,采用重叠延伸PCR方法,将VH和VL通过Linker连接成重组单链抗体(以下简写为scFv)的基因片段。将scFv的基因连接至噬菌粒载体pComb3Xss,将重组载体电转化至宿主菌XL1-Blue,并经辅助噬菌体M13KO7拯救,获得猪源噬菌体单链抗体库,库容约为2.5×106。以rSpaA为靶抗原,经免疫亲和筛选,获得8株特异性较好的阳性克隆。本研究结果可为制备抗红斑丹毒丝菌的重组scFv提供新途径,并为猪丹毒的免疫检测和综合防制提供材料基础。
猪源抗体库;单链抗体;红斑丹毒丝菌;噬菌体展示技术
投稿网址:http://xb.ijournal.cn
红斑丹毒丝菌在自然环境中广泛存在,主要引起猪的急性或亚急性败血症和慢性关节炎及心内膜炎,能对猪肉生产的各阶段产生影响,如得不到良好的防制,会给养猪业造成较大的损失[1–2]。免疫接种是预防猪丹毒最好的方法。目前常用丹毒丝菌灭疫活苗、减毒疫苗等来预防猪丹毒的暴发和流行,但其有效性依赖于动物对该疫苗的免疫应答能力,且减毒疫苗在临床使用中存在一定的危险[3],此外,红斑丹毒丝菌的血清型较多和疫苗的免疫交叉保护性差、保护周期短等使该病至今仍未得到有效控制[4–5],因此,研发快速有效的免疫检测方法对更好地防治猪丹毒具有重要意义。
噬菌体抗体库是当今重组抗体的主要技术平台之一,它甚至可使不经免疫而在体外筛选和制备各类抗体成为可能[6–7]。scFv是由重链可变区(VH)和轻链可变区(VL)通过一段柔性短肽(Linker)连接而成的具有抗原特异性结合的最小结构功能单位[8–9]。scFv具有相对分子质量小、免疫原性低、穿透性好、易于操作等优点,一直是重组抗体研究的热点,在靶向药物研究、基因治疗和药物残留检测、抗原检测等方面得到了广泛应用[10–11]。目前,关于人、鼠天然或免疫倾向性单链抗体库的研究较多,而关于猪、犬等的抗体的研究尚少。本研究中构建猪源的抗红斑丹毒丝菌SpaA蛋白噬菌体单链抗体库,通过生物淘选获得与rSpaA特异性结合且亲和力较高的scFv,旨在为红斑猪丹毒丝菌SpaA重组抗体的制备提供新途径,为新型猪丹毒免疫检测方法的开发提供基础材料。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒
E.coli XL1–Blue、E.coli JM109、辅助噬菌体M13KO7和噬菌粒载体pComb3Xss均由湖南农业大学余兴龙教授提供。
1.1.2 主要试剂
RNA 提取试剂Trizol购于Invitrogen公司;ReverAid First Stand cDNA Kit 购于Thermo公司;rTaq DNA聚合酶、Ex–Taq DNA聚合酶、Pfu DNA聚合酶、T4DNA 连接酶、限制性内切酶SfiI、pMD19–T Vector等均购于TaKaRa公司;辣根过氧化物酶标记抗 M13 噬菌体单抗(Anti–M13 Monoclonal Conjugate) 购自 Pharmacia公司;胰蛋白胨、酵母提取物、PEG8000等试剂购自Solarbio公司。
1.1.3 PCR引物的设计
猪源抗体轻链及重链可变区引物、 轻链及重链基因连接引物(linker)和scFv 的基因扩增引物由华大基因公司合成(表1)。VH的4对引物用于扩增猪源抗体重链可变区基因,VL的16对引物用于扩增猪源抗体轻链可变区基因,将linker部分序列分别添加在重链的下游和轻链的上游作为接头引物,用于SOE–PCR拼接scFv片段。

表1 本试验中所用PCR扩增引物序列Table 1 Primer sequences of PCR amplification
1.2 方法
1.2.1 猪源抗体VH和VL的基因扩增及纯化
用Trizol法提取猪脾淋巴细胞的总RNA,并参照反转录试剂盒(Thermo Scientific)的使用说明书合成cDNA第1链。
以cDNA为模板,分别用扩增VH和VL的上下游引物克隆VH和VL的基因片段。PCR反应体系(50 μL):cDNA模板2 μL,Taq Plus DNA 聚合酶1 μL,10×Taq Plus 缓冲液 5 μL,dNTP(2.5 mmol/L)4 μL,上、下游引物各1 μL,加灭菌超纯水补至50 μL。PCR循环参数:95 ℃预变性5 min后进行32个循环(94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸7 min,产物于4 ℃保存。PCR产物在1.5%琼脂糖凝胶中电泳鉴定,并切胶纯化,回收目的片段。
1.2.2 重组scFv的基因制备
1) VH–linker、VL–linker基因片段的制备。以上步回收的VH和VL片段作为模板,用相对应的加Linker端引物(VH–L–Rp 和L–VL–Fp)分别扩增,得到VH–linker、VL–linker的基因片段。PCR反应体系和循环参数参考1.2.1,退火温度为60 ℃。PCR产物用1.5%琼脂糖凝胶电泳,切胶纯化、回收目的片段。
2) scFv的基因组装。在预拼接阶段,以等量的VH–linker、VL–linker基因片段互为模板和引物进行scFv预拼接。反应体系(50 μL):VH–linker、VL–linker基因片段各2 μL,5×Pfu 缓冲液 10 μL,dNTP(25 mmol/L)4 μL,Pfu 酶 1 μL,加灭菌超纯水补至50 μL。先将2个基因片段进行重叠延伸。反应参数为95 ℃预变性5 min后进行10个循环(94 ℃变性30 s,9 ℃退火1 min,72 ℃延伸2 min),最后72 ℃延伸10 min,反应结束后立即放入冰盒。之后进行进一步扩增,向反应体系补加VH上游引物和VL下游引物各1 μL,扩增反应参数为95 ℃预变性5 min后进行30个循环(94 ℃变性30 s,55 ℃退火30 s,72℃延伸30 s),之后72 ℃延伸7 min,4 ℃保存。最后以上述拼接产物为模板,用引物S–VH–Fp和VL–S–Rp扩增带有Sfi I酶切位点的scFv片段,PCR反应体系和PCR循环参数参考1.2.1,退火温度为65 ℃。回收PCR产物,在1.5%琼脂糖凝胶中电泳,观察结果并切胶回收。
3) scFv的基因T–A克隆鉴定。使用pMD19–T载体试剂盒对scFv的基因产物进行T–A克隆,将scFv的基因片段与pMD19–T载体连接后转化至感受态E.coli JM109,将转化菌液涂布于LB–A琼脂平板,37 ℃培养16 h,随机挑选若干转化子进行菌落PCR鉴定。
1.2.3 噬菌体单链抗体库的构建
1) 重组噬菌粒载体的转化。将带有酶切位点的scFv片段和噬菌粒载体pComb3Xss用Sfi I限制性内切酶消化处理,切胶纯化、回收后,用T4DNA连接酶连接,经NaAC–乙醇沉淀脱盐后电转化至感受态E.coli XL1–Blue,复苏后梯度稀释,并涂布到LB–A琼脂平板上,37 ℃倒置培养16 h,对菌落计数,估算库容,并随机挑选若干转化子进行PCR鉴定。剩余转化菌用终体积分数15%的甘油于–80 ℃保存。采用与以上相同的电转化条件和操作进行电转化,获得总的抗体库。
2) 重组噬菌体库的获得。将抗体库的菌种加入2×YT–AG液体培养基,培养至菌液OD600nm约0.5时加入辅助噬菌体M13KO7超感染,37 ℃培养1 h,4 000 g离心10 min,菌体用100 mL新鲜2×YT–AG液体培养基重悬,于30 ℃振荡培养过夜。第2天于4 ℃下8 000 g离心10 min,转移上清液,向其中加入20 mL的PEG/NaCl,混匀后冰浴1 h,待噬菌体充分聚沉后,于4 ℃下11 000 g离心10 min,吸去上清,用2 mL的PBS重悬噬菌体沉淀,4 ℃下11 000 g离心10 min,上清可在4 ℃短期保存,也可加入终体积分数15%的甘油置于-70 ℃长期保存。
3) 噬菌体单链抗体库滴度的测定。取10 μL制备的噬菌体单链抗体初级库,用新鲜的2×YT液体培养基梯度稀释(10–8、10–10、10–12、10–14、10–16),加入10 mL对数期的E.coli XL1–Blue,静置培养30 min后振荡培养2 h,各梯度取100 μL菌液分别涂布于LB–AG琼脂平板,37 ℃倒置培养16 h,对平板上的单菌落计数,估算噬菌体单链抗体库的滴度,用于后续免疫亲和筛选和富集试验。
1.2.4 单链抗体库的免疫亲和筛选与富集
用96孔板进行抗原抗体结合及噬菌体感染扩增和富集筛选[12–13]。将质量浓度为100 μg/mL的rSpaA原核表达纯化蛋白包被于96孔酶标板,4 ℃静置过夜,用PBST洗涤6次后加入4%的PBS–BSA,于37 ℃封闭1 h,弃尽封闭液后干燥备用[14]。
将初级噬菌体文库加入制备好的抗原板,于37℃孵育1 h,用PBS洗涤后加入100 μL 的Gly–HCl(pH2.2)洗脱,反应10 min后加入20 μL Tris–Cl(pH9.0)中和,迅速收集上清,用0.22 μm滤膜过滤除菌,加入培养至对数期的XL1–Blue菌液,37 ℃培养1 h,取10 μL培养液进行梯度稀释后涂布于LB–A平板,过夜培养后计算单菌落数,估测一轮富集噬菌体文库的滴度。向其余的培养液中加入M13KO7感染,重复上述操作,共进行5轮富集。
1.2.5 阳性噬菌体scFv的ELISA鉴定和特异性鉴定
于第4、第5轮噬菌体滴度测定输出平板上随机挑选单克隆菌落进行PCR鉴定,对PCR鉴定为阳性的克隆进行抗性培养和辅助噬菌体拯救,制备噬菌体单链抗体。以纯化的rSpaA(25 μg/mL)为抗原包被96孔酶标板,以HRP标记的抗M13的单克隆抗体为酶标二抗,用ELISA方法检测所制备的scFv,同时设置阴性对照和空白对照。具体操作:向抗原板中加入噬菌体单链抗体(阴性对照组加入M13KO7),37 ℃孵育1.5 h后弃去孔内液体,用PBST洗涤4次,拍干酶标板,加入酶标二抗,于37 ℃孵育1 h后弃去孔内液体,用PBST洗涤4次,拍干酶标板,加入TMB显色底物,于37 ℃下避光反应10 min,立即加入终止液,用酶标仪测OD450nm。设待检scFv的OD450nm为 P,阴性对照的OD450nm为N,若P/N≥2.1,则判为阳性;若P/N<1.5,则判为阴性。
分别用重组蛋白rSpaA和同浓度的其他原核表达重组蛋白(CJ/SS–1、CJ/SS–2、LQ/PEDV–1)及BSA制备抗原板,对检测为阳性的8株代表性单链抗体进行特异性验证试验,在包被不同抗原的抗原板中加入噬菌体单链抗体进行反应,以HRP标记的抗M13单克隆抗体为酶标二抗,按phage–ELISA方法检测与抗原结合的scFv。
2 结果与分析
2.1 VH和VL的基因扩增结果
以猪脾组织细胞总RNA反转录得到的cDNA为模板,用相应引物分别扩增抗体重链(VH)、轻链(VL)可变区基因,PCR产物经1.5%琼脂糖凝胶电泳,扩增出的基因片段与预期大小相符(图1)。

图1 VH和VL的基因PCR扩增产物电泳结果Fig.1 Electrophoresis of the products of gene VHand VLfrom PCR amplification
2.2 scFv的基因SOE–PCR拼接结果
采用PCR技术将切胶纯化后的VH和VL的基因片段分别添加部分Linker序列(在VH的下游和VL的上游添加)。用SOE–PCR将VH和VL拼接成scFv,并用带有酶切位点的上、下游引物给scFv片段加上不对称的Sfi I酶切位点。扩增产物经1.5%琼脂糖凝胶电泳后,扩增得到的基因片段约900 bp,与预期大小相符(图2)。

图2 scFv基因SOE–PCR拼接产物的电泳结果Fig.2 Electrophoresis of the gene scFv products from SOE–PCR amplification
2.3 scFv的基因T–A克隆PCR鉴定结果
scFv基因片段与pMD19–T载体连接后转化感受态E.coli JM109,将转化菌液涂布于LB–A琼脂平板,随机挑选12个单菌落,用scFv的上、下游引物进行PCR,扩增产物经1.5%琼脂糖凝胶电泳,显示扩增得到的基因片段约900 bp,与预期大小相符(图3)。

图3 T–A克隆产物的PCR鉴定电泳结果Fig.3 Electrophoresis of the T–A subcloning products from PCR amplification
2.4 scFv噬菌体抗体库的构建与鉴定结果
将scFv的基因与噬菌粒载体pCom3Xss经内切酶处理,重组连接后转化至E.coli XL1–Blue,从1 mL转化菌液中取5 μL涂布培养过夜,出现约568个单菌落,经22次相同条件和相同操作的电转化,积累的总抗体库库容约为2.5×106。从转化平板上随机挑选22个单菌落,用scFv的下游引物和pComb3Xss测序上游引物进行PCR,扩增产物经1%琼脂糖凝胶电泳后,显示扩增得到的片段大小约1 000 bp,与预期大小相符(图4)。鉴定结果表明成功构建了单链抗体库,scFv基因插入率约为100%,初级噬菌体单链抗体库的滴度约为6×1015PFU/mL。

图4 重组单克隆菌落PCR扩增电泳结果Fig.4 Electrophoresis of recombinant clones from PCR amplification
2.5 噬菌体单链抗体库的富集筛选结果及重组抗体的初步鉴定结果
本试验中构建的初级噬菌体单链抗体库经5轮免疫亲和筛选富集试验的结果见表2。由表2可见,第3、4、5轮筛选的抗体库的富集倍数无明显增加,说明抗体库完成了富集。与第1轮富集筛选相比,第5轮筛选后噬菌体抗体库的产出率约为第1轮产出率的12倍。
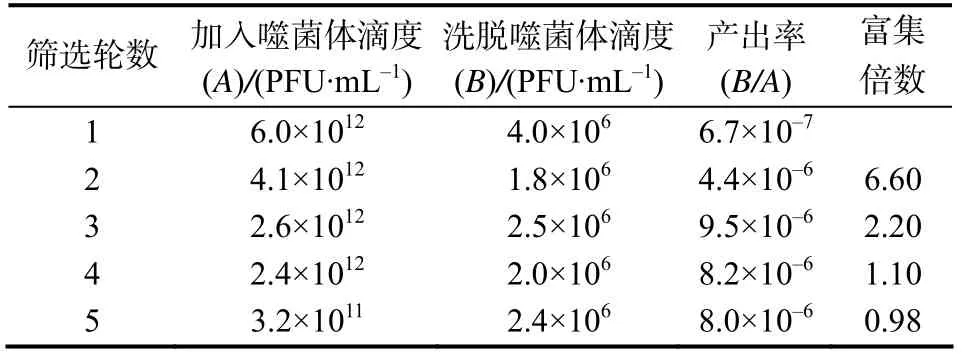
表2 噬菌体单链抗体库各轮免疫亲和筛选的富集效果Table 2 Enrichment of phage scFv library from immunoaffinity panning
2.6 阳性噬菌体单链抗体的筛选结果
经PCR鉴定为阳性的克隆共44株,制备噬菌体单链抗体后进行phage–ELISA试验,结果检测到与rSpaA415具有结合活性的阳性克隆31株(S/N>2.1,表3),其中有8株克隆的OD450nm均大于0.8,且S/N大于5,噬菌体上清液与BSA无交叉反应。阴性对照组是用包被质量浓度100 μg/mL的BSA酶标板进行phage–ELISA,检测到3组平行试验OD450nm的平均值为0.16;空白对照组是用未加蛋白包被的酶标板进行phage–ELISA,检测到3组平行试验OD450nm的平均值为0.10。
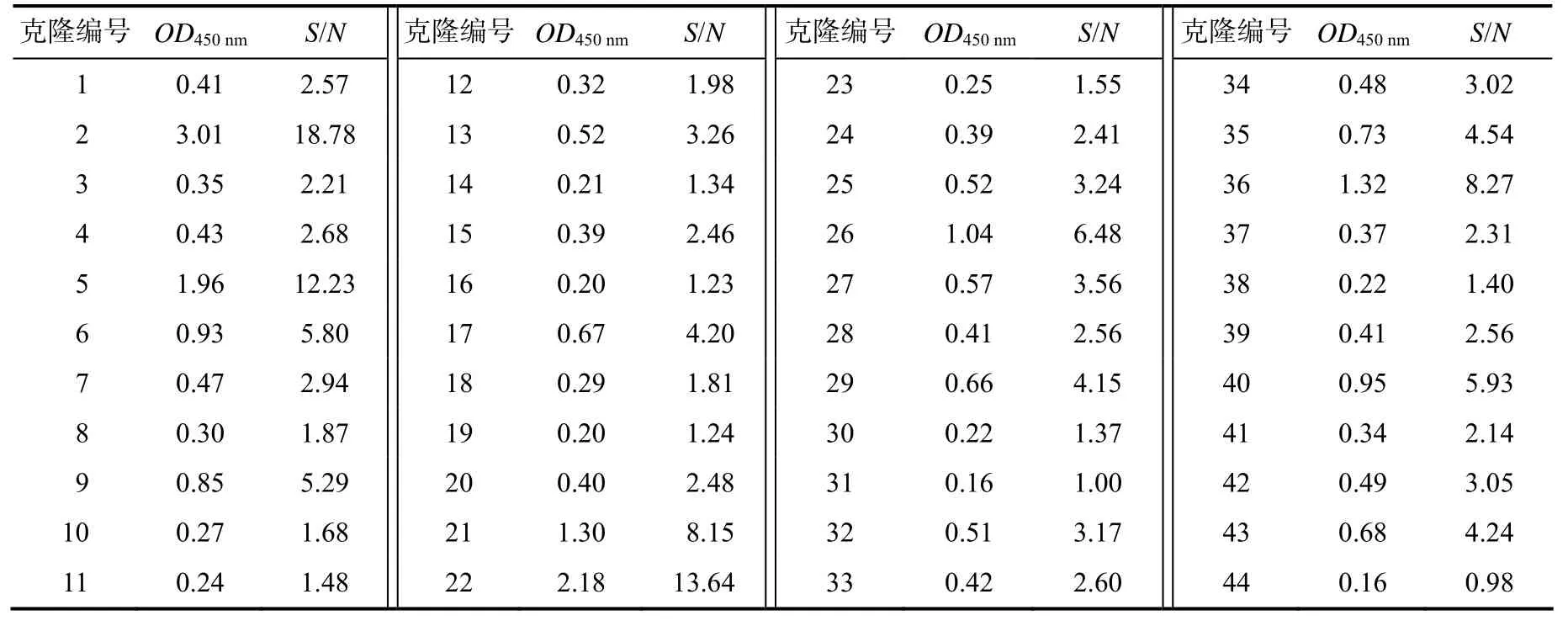
表3 phage–scFv的ELISA筛选结果Table 3 Screening the phage–scFv from rSpaA using ELISA
2.7 阳性噬菌体单链抗体的特异性验证结果
用不同抗原包被抗原板,以抗M13 MAb为酶标二抗,用phage–ELISA方法检测与抗原结合的scFv,验证8株具代表性的scFv的特异性,其结果见图5。结果表明,8株阳性scFv对rSpaA的亲和力明显高于其他重组蛋白,具有较好的特异性。

图5 不同包被抗原检测8株噬菌体scFv特异性的OD450nmFig.5 OD450nmrepresented the specificity of 8 strains phage scFv detected from different coating antigens
3 结论与讨论
SpaA是丹毒丝菌主要的表面抗原蛋白[15],在本试验的前期工作中对SpaA进行二级结构和抗原表位预测分析后,选择可能的B细胞表位富集区进行原核克隆和表达,获得了纯化的可溶性重组蛋白rSpaA。
能否筛选到高亲和力的单链抗体取决于所建单链抗体库的质量,其中抗体库的多样性和库容量是评价抗体库质量的重要指标。库的多样性取决于抗体基因的完整性。本试验在GeneBank中检索猪源抗体基因信息,共设计了多对含兼并碱基的抗体可变区基因扩增引物,较好地保证了抗体库的多样性。
库容量与筛选得到的scFv的亲和力呈正相关,库容越大,越容易筛选到高亲和力的抗体,因此,客容量也是影响抗体库质量的关键因素之一。制约库容量的关键是载体、宿主菌的转化效率。为提高转化效率,本试验中采用电转化方式将重组噬菌粒载体导入到宿主菌,同时采用相同转化条件下进行多次累积转化的方式,通过约22次相同的电转化试验,最终获得了总库容量约2.5×106的scFv库。由于本库为免疫倾向性抗体库,抗体基因在体内得到了选择克隆和分子重排,对免疫原具有倾向性,因此,该库的库容量基本符合抗体库亲和筛选获得特异性抗体的要求。
抗体库的筛选是获得特异性scFv的关键环节,优化的抗体库筛选策略能最大程度地发挥噬菌体scFv展示文库的筛选优势。本试验中以可溶性表达的纯化rSpaA蛋白作为靶抗原,采用固相免疫亲和筛选的方法,通过5轮“吸附—洗涤—洗脱—扩增”免疫亲和富集筛选,获得特异性scFv。该方式是最经典的亲和筛选方法,操作简捷,有利于筛选到高亲和力的scFv。后期的特异性试验结果显示,筛选得到的8株scFv具有较好的特异性和亲和力,初步达到了本研究的预期目标。
本研究中从免疫rSpaA的试验猪脾淋巴细胞中扩增得到抗体可变区基因,构建猪源噬菌体单链抗体展示文库。通过免疫亲和筛选,获得抗rSpaA噬菌体单链抗体富集库,经PCR和phage–ELISA检测鉴定,筛选到8株具有较高亲和力和特异性的噬菌体scFv克隆。本次研究为国内外首次制备抗猪丹毒丝菌SpaA的噬菌体scFv,研究结果可为猪丹毒的免疫检测和防控研究提供条件。在后期的研究中,拟选择3株scFv阳性克隆进行测序,对测序结果进行BLAST比对和分析,并用ExPASy(SWISS–MODEL)对这3株scFv的序列进行同源建模分析,以进一步研究和制备高亲和力的抗rSpaA单链抗体。
[1] Brooke C J,Riley T V.Erysipelothrix rhusiopathiae:bacteriology,epidemiology and clinical manifestations of an occupational pathogen[J].J Med Microbiol,1999,48(9):789–799.DOI:10.1099/00222615–48–9–789.
[2] Wood R L.Swine erysipelas review of prevalence and research[J].J Am Vet Med Assoc,1984,184(8):944– 949.
[3] Freeman M J.Effects of vaccination on the development of arthritis in swine with erysipelas:clinical,hematologic,and gross pathologic observations[J].Am J Vet Res,1964,25:589–598.
[4] Bender J S,Irwin C K,Shen H G,et al.Erysipelothrix spp.genotypes,serotypes,and surface protective antigen types associated with abattoir condemnations[J].J Vet Diagn Invest,2011,23(1):139–142.DOI:10.1177/1040 63871102300126.
[5] Zimmerman J J,Karriker L A,Ramirez A,et al.Diseases of Swine[M].10th Edition,Wiley,2012.
[6] Nagano K,Imai S,Mukai Y,et al.Rapid isolation of intrabody candidates by using an optimized non-immune phage antibody library[J].Pharmazie,2009,64(4):238–241.
[7] Azzazy H M,Highsmith W E Jr.Phage display technology:clinical applications and recent innovations[J]. Clin Biochem,2002,35(6):425–445.DOI:10.1016/s0009–9120(02)00343–0.
[8] Filpula D.Antibody engineering and modification technologies[J].Biomol Eng,2007,24(2):201–215. DOI:10.1016/j.bioeng.2007.03.004.
[9] 沈倍奋,陈志南,刘民培.重组抗体[M].北京:科学出版社,2005.
[10] Blazek D,Celer V.The production and application of single chain antibody fragments[J].Folia Microbiol (Praha),2003,48(5):687–698.DOI:10.1007/bf0299 3480.
[11] Hoogenboom H R.Overview of antibody phage display technology and its applications[J].Methods Mol Biol,2002,178:1–37.DOI:10.1385/1–59259–240–6:001.
[12] Ueberberg S,Schneider S.Phage library-screening:a powerful approach for generation of targeting-agents specific for normal pancreatic islet-cells and islet-cell carcinoma in vivo[J].Regul Pept,2010,160(1/3):1–8. DOI:10.1016/j.regpep.2009.11.017.
[13] Hust M,Dübel S.Mating antibody phage display with proteomics[J].Trends Biotechnol,2004,22(1): 8–14. DOI:10.1016/j.tibtech.2003.10.011.
[14] 王永娟,李碧春,沈明君,等.抗Ⅰ型鸭肝炎病毒RdRp蛋白噬菌体单链抗体库构建及单链抗体的淘选[J].中国预防兽医学报,2015,37(5):334–338.DOI:10.3969/j. issn.1008–0589.2015.05.03.
[15] To H,Nagai S.Genetic and antigenic diversity of the surface protective antigen proteins of Erysipelothrix rhusiopathiae[J].Clin Vaccine Immunol,2007,14(7):813–820.DOI:10.1128/CVI.00099–07.
责任编辑:王赛群
英文编辑:王 库
Construction of swine phage single-chain antibody variable fragment (scFv) library for recombinant SpaA protein (rSpaA)of erysipelothrix rhuriopathiae and specific scFv panning
Wang Rui, Ge Meng, Chen Yiwei, Fang Chao, Chai Qiangqiang, Li Runcheng, Yu Xinglong*
(College of Veterinary Medicine, Hunan Agriculture University, Changsha 410128, China)
The study was designed to identify and construct a library for swine phage single-chain antibody (scFv) rSpaA. Total RNA was extracted from splenic tissue and used to amplify fragments consisting of a variable heavy chain (VH) and a variable light chain (VL). After purification, VHand VLwere joined with a linker to produce scFv fragments by splicing-overlap-extension (SOE) PCR. The gene scFv was cloned in plasmid pComb3Xss, and the recombinant phagemids were transformed to susceptible E. coli XL1–Blue. After infection with the aid of phage M13K07, the library of phage antibody was constructed. The size of constructed antibody library was 2.5×106. By taking the purified recombinant protein rSpaA as target antigens, 8 strains of positive scFvs with binding affinity to rSpaA were identified after 5 rounds of procedure of ELISA: bind-elution-enrichment. In conclusion, the construction of rSpaA swine scFv library and the study for the preparation of recombinant antibodies could provide a new way and lay the foundation for the immunoassay of SE and comprehensive prevention and control to swine erysipelas.
swine antibody library; single-chain antibody (scFv); phage library display; erysipelothrix rhuriopathiae
S858.28
A
1007-1032(2016)06-0647-07
2016–01–22
2016–05–02
国家自然科学基金项目(31272652);现代农业产业技术体系建设专项(CARS–46–42)
王锐(1990—),男,湖南常德人,硕士研究生,主要从事预防兽医学研究,wrui10010@163.com;*通信作者,余兴龙,博士,教授,主要从事畜禽重要传染病诊断与防制研究,xly999@126.com
