1株番茄青枯病内生拮抗细菌的分离鉴定及盆栽防效
2016-12-19伍善东雷平郭照辉黄军程伟付祖姣单世平
伍善东,雷平,郭照辉,黄军,程伟,付祖姣,单世平
(湖南省微生物研究院,湖南 长沙 410009)
1株番茄青枯病内生拮抗细菌的分离鉴定及盆栽防效
伍善东,雷平,郭照辉,黄军,程伟,付祖姣,单世平*
(湖南省微生物研究院,湖南 长沙 410009)
从番茄植株分离得到内生细菌18株,其中2株对番茄青枯病病原菌(Ralstonia solanacearum)有较强的拮抗作用,菌株QGJ–6的拮抗圈直径最大,为20.2 mm,盆栽试验中对番茄青枯病的生防效果达82.4%。逐步诱导拮抗内生细菌QGJ–6对硫酸链霉素产生抗性,通过灌根接种的方法,验证了菌株QGJ–6能在番茄的根、茎、叶中定殖。基于菌株QGJ–6的形态特征、生理生化特征以及16S rDNA序列分析结果,将其鉴定为短短芽孢杆菌(Brevibacillus brevis)。
番茄青枯病病原菌;内生细菌;硫酸链霉素;生防效果;短短芽孢杆菌
投稿网址:http://xb.ijournal.cn
番茄青枯病是由茄科青枯劳尔氏菌(Ralstonia solanacearum)侵染引起的细菌性病害[1]。青枯劳尔氏菌可侵染44个科450多种植物,造成15%~100%的产量损失[2]。青枯病的防治主要依赖化学药剂,但长期施用易导致菌株产生抗药性,同时也会对环境造成污染,增加农产品有毒化学物质的残留量。王超等[3]研究发现,拮抗菌株R318、K18、R216对青枯病有较强的抑制作用;徐玲等[4]在番茄根际土壤筛选出的多粘类芽孢杆菌HY96–2对青枯菌有较好的拮抗作用。根际拮抗微生物易受环境的影响,对植物病害的防效并不稳定[5]。植物内生细菌由于定殖于植物体内,有稳定的生存空间,不易受环境因素的影响[6],有可能克服对植物病害防效不稳定的缺陷。笔者从番茄植株组织中分离得到1株对番茄青枯病有较强拮抗作用的内生细菌QGJ–6,盆栽试验中该菌株对番茄青枯病的防效为82.4%,采用抗生素标记的方法,分析了该菌株在番茄根、茎、叶中的定殖能力,结合该菌株的形态特征、生理生化特征和16S rDNA序列分析,将QGJ–6鉴定为短短芽孢杆菌。现将结果报道如下。
1 材料与方法
1.1 材料
从湖南长沙、邵阳番茄青枯病发病田块中,选取健壮植株的根、茎、叶,置于冰箱中保藏。
供试青枯病原菌(Ralstonia solanacarum)由湖南省微生物研究院提供。
NA培养基:牛肉膏3 g,酵母膏1 g,蛋白胨5 g,葡萄糖10 g,琼脂18 g,水1 000 mL,pH7.0。
LB培养基:胰蛋白胨10 g,氯化钠 10 g,酵母粉 5 g,琼脂18g,水1 000 mL,pH7.0。
1.2 方法
1.2.1 番茄内生细菌的分离和筛选
番茄内生细菌的分离参照文献[7]的方法进行,挑取长势好的菌落,划线纯化,重复5次,保藏于4 ℃冰箱中。
番茄青枯病病原菌用NA培养基活化后,挑一环于5 mL无菌水中,菌液浓度为2.1×106CFU/mL,振荡均匀,吸取0.1 mL加入到已凝固的5 mL NA培养基的平皿中,再倒入15 mL 45 ℃左右的NA培养基,混合均匀后,移入1个直径为5 mm浸泡过待测细菌培养液的滤纸片, 每处理3个重复,置于28 ℃恒温箱中培养2d,测定透明圈直径大小。
1.2.2 内生拮抗细菌的鉴定
菌株划线接种于LB培养基中,30 ℃恒温培养2d,记录菌落形状、颜色、大小、边缘特征、是否透明、隆起程度等。进行革兰氏染色,镜检。
菌株生理生化特征鉴定按照文献[8]的方法进行。
依据试剂盒说明书,提取菌株QGJ–6的DNA后,采用细菌通用引物27F/1492R进行16S rDNA的PCR扩增[9]。PCR产物通过电泳进行检测,由生工生物工程(上海)股份有限公司进行序列测定,将所得序列通过Blast程序与GenBank中数据进行比对分析,选择同源性高的序列使用MEGA5.1软件邻接法构建系统发育树。
1.2.3 抗300 μg/mL硫酸链霉素拮抗细菌突变株的筛选及其定殖能力测定
参照何红等[10]的方法,将拮抗细菌株逐步诱导至300 μg/mL硫酸链霉素的抗性菌株,连续培养5代,以获得稳定抗性的菌株。
将5叶期的番茄苗移种于花盆中,将上述菌株接种于50 mL含有300 μg/mL硫酸链霉素的LB液体培养基摇瓶中,30 ℃恒温振荡培养48 h,将发酵菌液稀释10倍,量取100 mL灌根处理。5d后浇灌第2次,对照浇等量清水,常规管理,15d后取根、茎、叶进行内生细菌的分离。
称取5 g植株样品,按文献[7]方法处理后,取0.2 mL稀释液涂于含有300 μg/mL硫酸链霉素的LB培养基中,30 ℃恒温培养2~3d,计算每克鲜质量组织中的细菌数(CFU/g)[11]。
1.2.4 盆栽防效试验
番茄种子播于育苗盆中,待幼苗长至20 cm高时,移栽至花盆中,每花盆种1株幼苗,每个处理20个重复,幼苗移栽成活后,使用该菌株的发酵液100 mL灌根处理,菌数约为6×107CFU/mL,每隔7d灌根处理1次,对照施等量清水,共3次。待第3次灌根处理3d后,利用伤根灌根法[12]接种青枯病原菌,接种病原菌25d后,按照Kempe(1983)提出的病级标准[13]记录病级数。
2 结果与分析
2.1 内生细菌的分离与内生拮抗细菌的筛选结果
从番茄样本中共分离得到内生细菌18株,其中8株来自于根部,4株来自于茎部,6株来自于叶片。经滤纸片法与青枯病原菌进行拮抗试验,仅有2株具有明显的拮抗性,菌株QGJ–6的拮抗圈直径为20.2 mm(图1),菌株QGJ–3的拮抗圈直径为12.5 mm。

图1 菌株QGJ–6的平皿抑菌效果Fig.1 The result of antibacterial experiment for strain QGJ–6
2.2 内生拮抗细菌的鉴定结果
选择内生拮抗细菌QGJ–6进行鉴定。
菌株QGJ–6在LB培养基上30 ℃培养48 h,菌落为圆形,表面光滑、平整,白色或稍带黄色,边缘整齐。革兰氏阳性菌,在光学显微镜下观察,菌体为杆状,有芽孢。
菌株QGJ–6能利用葡萄糖、甘露醇发酵产酸,不能利用木糖发酵产酸,50 ℃的温度不能生长,5%氯化钠不能生长,能使明胶液化,不能水解淀粉,不产生硫化氢,V–P试验阴性,接触酶试验阳性,吲哚试验阴性,氧化酶试验阳性。
菌株QGJ–6的16S rDNA的PCR扩增产物经测序分析,长度为1 505 bp, 将该序列提交至GenBank进行比对,选择相似性较高的序列构建系统发育树(图2)。根据菌株的形态学特征、生理生化特征和16S rDNA序列分析,鉴定菌株QGJ–6为短短芽孢杆菌(Brevibacillus brevis)。

图2 依据菌株QGJ–6的16S rDNA序列为基础构建的系统发育树Fig.2 The phylogenetic tree for strain QGJ–6 based on 16S rDNA sequence
2.3 菌株QGJ–6突变株及其定殖能力
将菌株QGJ–6逐步诱导至抗300 μg/mL硫酸链霉素,其发酵液对番茄进行灌根处理后,在含300 μg/mL硫酸链霉素的LB培养基中能分离到形态特征与原菌株一致的细菌,根中菌株的含量为8.3×104CFU/g,茎中菌株的含量为3.2×104CFU /g,叶片中菌株的含量为1.5×104CFU /g,清水对照中没有分离到形态特征与原菌株一致的细菌,表明菌株QGJ–6能在番茄植株体内定殖。
2.4 菌株QGJ–6发酵液的盆栽防效
用拮抗内生细菌QGJ–6发酵菌液处理番茄苗3次,采用伤根灌根法接种青枯病原菌,25d后,番茄苗的发病率、病情指数均低于对照,盆栽防效达82.4%(表1)。
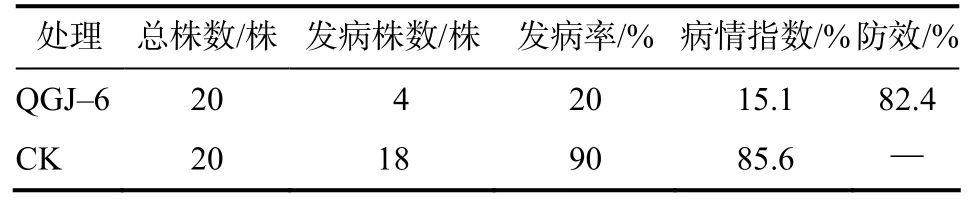
表1 拮抗内生细菌QGJ–6对番茄青枯病的防效Table 1 The biocontrol efficacy of strain QGJ–6 against Ralstonia solanacearum
3 讨论
用于防治青枯病的细菌有无致病力青枯菌、假单胞菌、芽孢杆菌等[14]。生防细菌的作用机理包括抗菌物质产生、诱导抗病性、种群竞争等[15]。利用内生细菌防治作物病害越来越受到重视,内生细菌对植物生长发育、抵抗不良外界环境、抵御病虫害等有广泛的生物学作用[16]。
本试验从番茄青枯病发病田块的健壮植株组织中分离得到18株内生细菌,进一步筛选得到2株对番茄青枯病有拮抗作用的细菌,其中菌株QGJ–6的拮抗圈直径最大,为20.2 mm,在盆栽防效试验中,对番茄青枯病的防治效果为82.4%,根据拮抗内生细菌QGJ–6的形态学特征、生理生化特征和16S rDNA序列分析,鉴定其为短短芽孢杆菌(Brevibacillus brevis)。
采用硫酸链霉素标记的方法证明QGJ–6能在番茄的根、茎、叶中定殖,表明其为内生细菌,但定殖能力随植株的器官不同而异,其在根部的定殖能力明显强于茎、叶,可能与根部是内生细菌进入植株体内的入口有关[17],这与龙良鲲等[18]研究内生细菌01–144在番茄根茎内定殖的结果相似。后续将对拮抗内生细菌QGJ–6的抗菌活性成分作进一步研究。
[1] 肖烨,洪艳云,易图永,等.番茄青枯病生物防治研究进展[J].植物保护,2007,33(2):15–20.
[2] 黎志坤,朱红惠.一株番茄青枯病生防菌的鉴定与防病、定殖能力[J].微生物学报,2010,50(3):342–349.
[3] 王超,申成美,郑丽,等.烟草青枯病生防细菌的筛选与生防效果研究[J].植物保护,2014(2):43–47.
[4] 徐玲,王伟,魏鸿刚,等.多粘类芽孢杆菌HY96–2对番茄青枯病的防治作用[J].中国生物防治,2006(3):216–220.
[5] Cook R J. Making greater use of introduced microorganism for biologicolical control of plant pathogens[J]. Annual Review of Phytopathology,1993,31:53–82.
[6] Kloepper J W,Beauchamp C J. A review of issues related to measuring colonization of plant roots by bacteria[J]. Can J Microbiol,1992,38:1219–1232.
[7] 黎起秦,罗宽,林纬,等.番茄青枯病内生拮抗细菌的筛选[J].植物病理学报,2003,33(4):364–367.
[8] 东秀珠,蔡妙英.常见细菌系统鉴定手册[K].北京:科学出版社,2001:370–398.
[9] 伍善东,刘冬华,郭照辉,等.1株高效解无机磷细菌JP–7的分离、鉴定及溶磷能力分析[J].江苏农业科学,2015,43(12):374–376.
[10] 何红,邱思鑫,蔡学清,等.辣椒内生细菌BS–1和BS–2在植物体内的定殖及鉴定[J].微生物学报,2004,44(1):13–17.
[11] 张志元,官春云.油菜无菌苗培养前的种子消毒技术[J].中国油料作物学报,2005,27(1):88–90.
[12] 赵凯,肖崇刚,孔德英.内生细菌对番茄青枯病的控病作用及抗菌谱[J].西南农业大学学报,2006,28(2):314–318.
[13] Xue Q Y,Chen Y,Li S M,et al. Evalation of the strains of Acinetobacter and Enterobacter as potential biocontrol agents Ralstonia wilt tomato[J]. Biological Contral,2009,48:252–258.
[14] 陈志龙,陈杰,许建平,等.番茄青枯病生物防治研究进展[J].江苏农业科学,2013,41(8):131–134.
[15] 刘邮洲,陈志谊,梁雪杰,等.番茄枯萎病和青枯病拮抗细菌的筛选、评价与鉴定[J].中国生物防治学报,2012,28(1):101–108.
[16] Sturz A V,Christie B R,Nowak J. Baterial endophytes:potential role in developing sustainable systems of crop production[J]. Critical Reviews in Plant Sciences,2000,19(1):1–30.
[17] 黎起秦,罗宽,林纬,等.内生菌B47的定殖能力及其对番茄青枯病的防治作用[J].植物保护学报,2006,33(4):363–368.
[18] 龙良鲲,肖崇刚.内生细菌01–144在番茄根茎内定殖的初步研究[J].微生物学通报,2003,30(5):53–56.
责任编辑:罗慧敏
英文编辑:罗 维
Isolation, identification and potted control efficacy of an endophytic bacerial against Ralstonia solanacearum
Wu Shandong, Lei Ping, Guo Zhaohui, Huang Jun, Cheng Wei, Fu Zujiao, Shan Shiping*
(Hunan Institute of Microbiology, Changsha 410009, China)
Eighteen strains of endophytic bacteria were isolated from tomato plants, and 2 of them had stronger antagonistic effect on tomato bacterial wilt pathogens (Ralstonia solanacearum). Among them, strain QGJ–6 has maximal inhibition zone diameter (20.2 mm) and the potted biocontrol efficacy was 82.4%. The resistance of strain QGJ–6 to streptomycin sulfate was gradually induced. Andstrain QGJ–6 with the streptomycin sulfate label can colonize in the root, stem and leaf of tomato using the method of filling-root injection. The endophytic bacteria strain QGJ–6 was identified as Brevibacillus brevis based on the morphological characteristics, physiological and biochemical characteristics and 16S rDNA sequence analysis.
Ralstonia solanacearum; endophytic bacteria; streptomycin sulfate; biocontrol efficacy; Brevibacillus brevis
S435.112
A
1007-1032(2016)06-0627-04
2016–08–24
2016–10–18
湖南省科学技术厅项目(2015NK3056);湖南省自然科学基金项目(13JJ2035)
伍善东(1978—),男, 湖南绥宁人, 工程师, 主要从事植物保护与微生物肥料研究,1059995305@qq.com;*通信作者,单世平,博士,副研究员,主要从事农田土壤重金属污染防控、土壤肥料发酵工艺研究,ssp312@hotmail.com
