针刺对脑缺血大鼠外周血miRNA-126和VEGF表达的干预作用*
2016-12-19张亚敏陈素辉王富明
徐 虹,张亚敏,孙 华,陈素辉,王富明,杨 杨
(中国医学科学院 北京协和医学院 北京协和医院,北京 100730)
实验研究
针刺对脑缺血大鼠外周血miRNA-126和VEGF表达的干预作用*
徐 虹,张亚敏,孙 华△,陈素辉,王富明,杨 杨
(中国医学科学院 北京协和医学院 北京协和医院,北京 100730)
目的:以脑缺血再灌注损伤后外周血清中血管再生相关信号的表达为切入点,观察针刺百会、足三里穴对脑缺血再灌注损伤大鼠外周血miRNA-126和血管内皮生长因子(VEGF)表达的影响。方法:随机数字表法将SD大鼠分为假手术组、模型组、针刺组和药物组,各组大鼠根据再灌注后时间随机分为1天、3天、5天和7天4个时间点。以右侧大脑中动脉线栓法制备脑缺血再灌注损伤模型。TTC法验证模型成功与否。针刺组为造模成功后在规定时间内针刺百会和左足三里穴;药物组为造模成功后腹腔注射依达拉奉。腹主动脉采血后,实时荧光定量PCR法检测血清miRNA-126的表达;ELISA法检测血清VEGF的表达情况。结果: 模型组miRNA-126和VEGF表达升高,3天时间点达高峰,高于同时间点的针刺组和药物组;除1天时间点外,针刺组miRNA-126和VEGF表达高于同时间点的药物组。结论: 针刺大鼠百会、足三里穴可能通过下调miRNA-126及VEGF的表达干预脑缺血再灌注损伤后血管再生。
针刺;脑缺血;miRNA-126;血管内皮生长因子
血管内皮生长因子(Vascular endothelial growth factor,VEGF)是一种刺激血管内皮生长促进血管再生的信号蛋白,当血液循环差或者氧供不足的情况下,血液中的VEGF增多,促进侧枝循环的建立。近年研究发现,VEGF增生的血管往往是不成熟的,有增加血管渗透性的风险[1]。在临床上,VEGF被证明与急性脑梗死病人脑梗死的严重程度正相关[2]。微小RNA(microRNA,miRNA)是一类高度保守的非编码小RNA, miRNAs在缺血性脑血管病的发生和发展过程中发挥着重要作用。如miRNA-126在内皮细胞中特异性表达并调控血管生成,对维持血管的完整性及血管生成方面有重要作用。近来研究表明,miRNA-126可正向调节VEGF受体-2或VEGF mRNA的表达[3-4],促进新生血管的形成。而且动物实验研究表明miRNA-126可能与脑缺血再灌注损伤动物的损伤严重程度正相关[5]。因此VEGF和miRNA-126可能是脑缺血再灌注损伤(Cerebral ischemia reperfusion injury, CIRI)后的和脑损伤程度相关的两个重要相关分子。本实验采用针刺百会、足三里穴,研究其对脑缺血再灌注损伤后大鼠外周血中血管再生相关因子VEGF和miRNA-126表达的影响。
1 实验材料与方法
1.1 实验试剂、材料和仪器
VEGF试剂盒(R&D公司 RRV00,美国 );RNAlater RNA Stabilization Reagent( Invitrogen,美国)、Trizol LS (Invitrogen 10296-010,美国);QuantiTect Reverse Transcription Kit(Qiagen 205310,德国);Rotor-Gene Multiplex PCR Kit (Qiagen 204772,德国);依达拉奉注射液(批注文号:国药准字H20050280,中国,南京先声东元制药有限公司)。主要试验仪器:荧光定量PCR检测系统(伯乐CFX96,美国);普通PCR仪(伯乐 C1000,美国);低温离心机等(ALC,意大利);标准规格酶标仪(THERMO Multiskan MK3,美国);长城牌KWD-808Ⅱ全能脉冲电疗仪(中国,常州);汉医牌一次性无菌针灸针(中国,天津)。
1.2 实验分组
根据随机数字表法将144只健康雄性SD大鼠分为假手术组(S)、模型组(M)、针刺组(A)和药物组(ED)4个大组,后3组先制作MCAO模型,然后根据再灌注时间又分为1天、3天、5天和7天组。假手术组1天、3天、5天、7天时间点设8只大鼠。根据以往实验数据,考虑造模动物死亡率,模型组、针刺组及药物组1天、3天、5天、7天时间点设为9只大鼠。最终各个时间点存活的模型组、电针组及药物组均为8只。
1.3 大脑中动脉线栓模型和脑缺血再灌注大鼠制备
参考Longa等[6]的线栓法制备大鼠大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型。术前大鼠禁食禁水(12h),10%水合氯醛腹腔注射麻醉后将大鼠固定于操作台,消毒后行颈部正中纵行切口,逐步分离颈部肌肉以及其他组织后暴露右侧颈总动脉,颈内动脉和颈外动脉,注意保护周围血管神经。分离大鼠右侧颈外动脉后结扎颈外动脉远心端,并用纤维剪在颈外动脉上剪一个口,将标有黑色记号的线栓插入颈外动脉。剪断颈外动脉后调整线栓方向直至线栓进入颈内动脉,遇到一定阻力后停止,阻断右侧大脑中动脉入口,线栓插入长度约为18cm。用细线固定线栓,缝合后让大鼠休息。脑缺血2h后缓慢拔出线栓直至看到线栓的黑色标记后剪掉线栓。大鼠清醒后自由接触食物和水。
1.4 实验处理
模型组:造模成功后,不做进一步治疗,仅每日给予抓取刺激1次。假手术组:模拟手术过程至分离颈内、颈外动脉后,不做进一步造模,直接缝合组织、皮肤。针刺组:造模成功后的SD大鼠,按照规定的时间点,常规消毒,选用一次性无菌针灸针,针刺百会穴和左侧足三里穴,接脉冲治疗仪,采用疏密波,频率2Hz,强度2mA,以局部肌肉出现收缩为度,每日1次,每次20min。药物组:造模成功后,腹腔注射依达拉奉3mg/kg,每日1次。
1.5 血清样品的提供
实验大鼠用10%水合氯醛腹腔注射麻醉,腹主动脉取血于室温下静置2h,离心(3500rpm,20min),分离血清;将血清分装,于-80℃冰箱存放备用。后室温冰盒上融解备用。
1.6 免疫吸附法(ELISA)测定大鼠外周血VEGF的水平
稀释标准品后,室温温育2h,洗涤4次,加入抗-VEGF抗体100μl,室温温育1h,加链酶亲和素100μl。后加底物100μl 37℃避光显色15min。加终止液100μl,终止反应。450nm波长依序测量各孔的吸光度(OD值)。根据标准品的浓度及对应的OD值计算出标准曲线的直线回归方程,再根据样品的OD值在回归方程上计算出对应的样品浓度。
1.7 实时荧光定量PCR法检测脑缺血大鼠外周血清中miRNA-126的表达
用Trizol LS提取血清组织样本中总RNA,然后茎环引物还是反转录成cDNA,反向引物和通用引物扩增后,以U6为内参基因,伯乐CFX96荧光定量PCR检测系统检测miRNA-126在血清中的表达。实时荧光定量PCR扩增反应条件:95℃RNA酶失活5min,95℃变性30s,72℃延伸30s,循环42次。用Primer premier 5等引物设计软件设计引物。miRNA-126引物设计序列如下:Sequence 9-CAUUAUUACUUUUGGUACGCG-29CGCGTAC茎环反向引物:GTCGTATCCAGCTCAGGTCG AGGTGATCACTGGATACGACCGCGTAC上游正向引物:ACACTCAGCTGGCATTATTACTTTTGG 27bp 64.7通用反向引物:TCCAGCTCAGGTCGAGGTGATC 22bp 63.7。
1.8 统计学方法

2 实验结果
2.1 TTC染色情况
假手术组大鼠(A)双侧脑组织呈鲜红色,未见缺血性改变;脑缺血再灌注损伤大鼠(B)右侧脑组织大脑中动脉供血区域,可见到白色的梗死灶,与鲜红色的正常脑组织形成对比。验证模型成功。见封三彩图1。
2.2 实验各组大鼠不同时间点外周血清miRNA-126表达情况
假手术组大鼠各个时间点外周血清miRNA-126少量表达;除1天时间点外,脑缺血各组(模型组、针刺组、药物组)大鼠各个时间点外周血清中miRNA-126表达显著升高,针刺组和药物组的表达显著低于模型组(P<0.05),但是针刺组miRNA-126的表达高于药物组(P<0.05);模型组、针刺组和药物组的峰值时间均在3天时间点。见表1、图2。
2.3 实验各组大鼠不同时间点外周血清VEGF表达情况
假手术组大鼠各个时间点外周血清VEGF少量表达;模型组大鼠各个时间点外周血清中VEGF表达显著升高,针刺组和药物组的表达显著低于模型组(P<0.05);药物组各个时间点的表达显著低于针刺组(P<0.05);模型组、针刺组和药物组的峰值时间均在3天时间点。见表2、图3。

表1 各组大鼠不同时间点血清miRNA -126表达相对定量

表2 各组大鼠脑缺血再灌注不同时间点血清VEGF表达变化
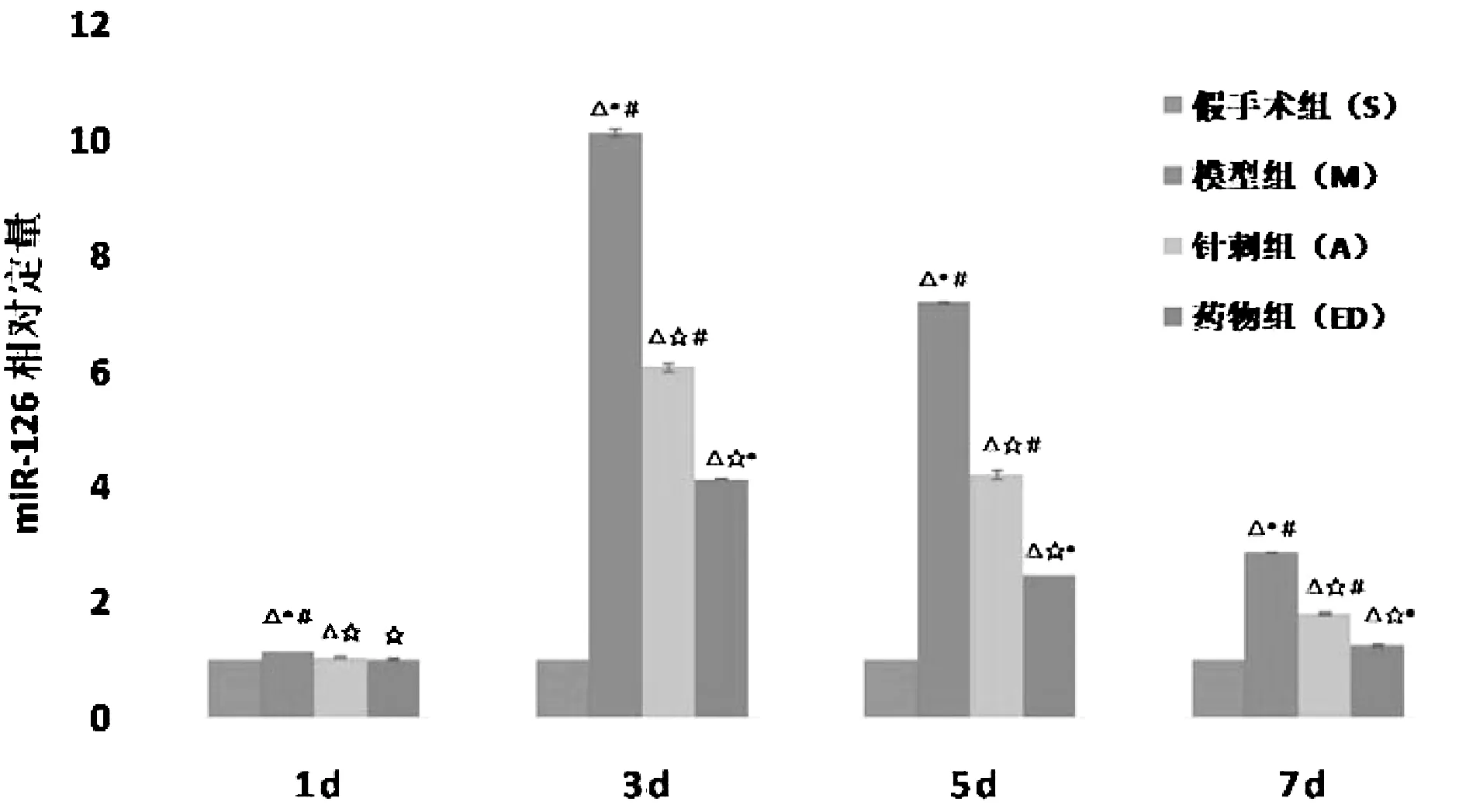
图2 各组大鼠不同时间点外周血清miRNA-126表达情况

图3 各组大鼠不同时间点外周血清VEGF的表达情况
3 讨论
正常情况下VEGF受体基因仅在正常血管内皮细胞中表达VEGF受体,且水平甚低,脑缺血、缺氧可激活VEGF/VEGF 受体系统,促使半暗带血管内皮生长因子及其受体表达明显上调。其表达在实验性动物模型中脑缺血早期(12~24h)[7-8]或者更早(数分钟内)[9]参与了血管生成和内皮细胞的增值过程,并且持续到之后的几周[7,10]。VEGF是强有力的促血管生长因子之一。一般来说,脑缺血再灌注损伤后血管的增生范围及程度与缺血边缘区血流的改善直接相关,有利于侧支循环的形成,最终影响着神经元的修复。但是目前研究认为VEGF在急性期诱导的新生血管系统往往不成熟,VEGF剂量依赖的渗透性增加可能消减早期VEGF的脑保护作用,并有导致脑水肿和加重脑损伤的风险,从而使人对VEGF的脑保护作用产生了质疑。近来研究显示,血清VEGF水平与脑梗死面积有关,血清VEGF水平愈高,脑梗死面积愈大[11]。Slevin等[2]观察了急性脑梗死患者血清不同时相(在梗死后1、3、7、14天)VEGF的表达,发现每一个时相患者血清VEGF水平均显著高于正常对照组。其中大面积脑梗死(面积>4cm2)患者各时相血清VEGF含量为最高,小面积脑梗死(面积<1.5cm2)各时相血清VEGF含量为最低,说明了外周血清VEGF的表达可反映脑缺血损伤情况。
miRNA-126是在内皮细胞特异性表达的一种促进血管新生的miRNA,可以调控血管生成、发育和再生,是目前报道的与血管内皮细胞及血管功能密切相关的microRNA[12],且大量表达于哺乳动物脑中[13]。出芽相关蛋白-1(Sprouty-related protein-1,SPRED-1)和磷酸肌醇3激酶调节亚单位(Phospho-inositol-3kinase regulatory subunit 2,PIK3R2)为miRNA-126的两个作用靶点,miRNA-126可直接作用于SPRED-1和PIK3R2,抑制SPRED-1和PIK3R2的表达,分别表现为通过靶向SPRED-1影响RAS/ERK信号通路,靶向PIK3R2影响 PI3K/AKT信号通路,以增强VEGF的生成[14-16]。此外,研究表明如芯指转录因子(Kruppel-like transcription factors,klf2a)能诱导内皮细胞表达miRNA-126,激活VEGF依赖的信号通路[17]。通过以上途径miRNA-126发挥其对VEGF干预血管形成和保持完整性的信号通路的促进作用。有研究表明,外周血中的miRNA-126可能与脑缺血再灌注损伤动物的严重程度正相关[3]。
依达拉奉(Edaravone)已被证实为一种脑保护剂,可清除自由基,抑制脂质过氧化作用,从而抑制脑细胞、血管内皮细胞及神经细胞的氧化损伤,减轻脑缺血引起的水肿及组织损伤[18]。此外,实验研究还发现急性期依达拉奉与重组组织型纤维蛋白酶原激活剂(rtPA)溶栓治疗联合应用可通过减轻氧化应激、减少炎性细胞因子及基质金属蛋白酶的表达来减缓超早期溶栓治疗引起的再灌注损伤,促进神经修复[19-20]。因此选用该药作为阳性对照药物。
针灸作为补充和替代治疗脑血管病的手段之一,广泛应用于临床。针灸具有疏通经络、调和阴阳、扶正祛邪的作用。针刺可以改善脑缺血再灌注损伤大鼠的神经功能[21]。根据针灸经络理论,百会穴是督脉上的要穴,为督脉与足太阳经的交会穴,总督一身之阳,位于头部巅顶,“头者神之居”为“精明之府”,具有开窍醒神之功。督脉行于脊里,上行入脑,与肝脉交巅,并从脊里分出,属肾,因此把脑、肝、肾三脏联络起来,“病变在脑,首取督脉”为治疗脑缺血疾病的首选。足三里穴为足阳明经要穴,阳明经多气多血,又“主润宗筋”,宗筋约束骨骼,利于关节运动,对中风之肢体痿痹不用尤为适宜。同时胃经与足太阴脾经互为表里关系。针刺足三里穴可以调理脾胃、补中益气、通经活络、扶正祛邪之效。 脑缺血后机体正气不足,属于积损正衰,百会和足三里穴对于缺血性脑血管病有正向调节作用[22-24]。
本研究结果显示,模型组、针刺组、药物组大鼠外周血清VEGF值高于假手术组,提示脑缺血缺氧可促进VEGF的表达上调,大鼠脑缺血再灌注损伤(CIRI)后1天外周血清VEGF开始升高,3天达高峰,与Marti等[8]研究的脑组织表达基本一致,进一步说明了脑缺血后3天可能为脑组织损伤最严重的时间点。同时经研究证实与急性脑缺血正性相关的外周血miRNA-126也同步升高。本实验显示针刺组大鼠VEGF及miRNA-126表达较假手术组升高,较模型组降低,说明针刺治疗可能通过降低VEGF及miRNA-126表达,减少VEGF剂量依赖增高的血管渗透性,从而缓解CIRI后脑组织的损伤而保护脑组织。但是其治疗效果又不如传统的脑保护作用药物依达拉奉;但是针刺具有操作简便、费用低廉、无毒副作用等特点。选取针刺百会和足三里这两个穴位,可通过下调外周血中VEGF及miRNA-126表达减缓脑缺血再灌注损伤。脑缺血再灌注损伤后,VEGF和其调控基因miR-126诱导了不成熟新生血管,血管渗透性增加加重了脑水肿,加重了脑组织损伤,而针刺治疗可以有效缓解该损伤,因此为临床治疗缺血性脑血管病进一步提供实验依据。
[1] Ergul A, Alhusban A,Fagan SC.Angiogenesis:a harmonized target for recovery after stroke[J].Stroke,2012,43(8):2270-2274
[2] Slevin M,Krupinski J,Slowik A,et al.Serial measurement of vascular endothelial growth factor and transforming growth factor-beta1in serum of patients with acute ischemic stroke[J].Stroke,2000,31(8):1863-1870
[3] Hansen TF,Andersen CL,Nielsen BS,et al.Elevated microRNA-126is associated with high vascular endothelial growth factor receptor 2expression levels and high microvessel density in colorectal cancer[J].Oncol Lett,2011,2(6):1101-1106
[4] Hong F,Li Y,Xu Y.Decreased placental miR-126expression and vascular endothelial growth factor levels in patients with pre-eclampsia[J].J Int Med Res,2014,42(6):1243-1251
[5] Chen F,Du Y,Esposito E,et al.Effects of Focal Cerebral Ischemia on Exosomal Versus Serum miR126[J].Transl Stroke Res,2015,6(6):478-484
[6] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91
[7] Liman TG,Endres M.New vessels after stroke: postischemic neovascularization and regeneration[J].Cerebrovasc Dis,2012,33(5):492-499
[8] Marti HJ,Bernaudin M,Bellail A,et al.Hypoxia-induced vascular endothelial growth factor expression precedes neovascularization after cerebral ischemia[J].AmJ Pathol,2000,156(3):965-976
[9] Hayashi T,Noshita N,Sugawara T,et al.Temporal profile of angiogenesis and expression of related genes in the brain after ischemia[J].J Cereb Blood Flow Metab,2003,23(2):166-180
[10] Egervari K,Potter G,Guzman-Hernandez ML,et al.Astrocytes spatially restrict VEGF signaling by polarized secretion and incorporation of VEGF into the actively assembling extracellular matrix[J].Glia,2016,64(3):440-456
[11] 王翠兰,石秋艳,孙原,等.急性脑梗死患者血清VEGF与bFGF水平的动态变化[J].中风与神经疾病杂志,2014(4):292-294
[12] Kuehbacher A,Urbich C,Dimmeler S.Targeting microRNA expression to regulate angiogenesis[J].Trends Pharmacol Sci,2008,29(1):12-15
[13] Landgraf P,Rusu M,Sheridan R,et al.A mammalian microRNA expression atlas based on small RNA library sequencing[J].Cell,2007,129(7):1401-1414
[14] Fish JE,Santoro MM,Morton SU,et al.miR-126regulates angiogenic signaling and vascular integrity[J].Dev Cell,2008,15(2):272-284
[15] Guo C,Sah JF,Beard L,et al.The noncoding RNA,miR-126,suppresses the growth of neoplastic cells by targeting phosphatidylinositol 3-kinase signaling and is frequently lost in colon cancers[J].Genes Chromosomes Cancer,2008,47(11):939-946
[16] Wang S,Aurora AB,Johnson BA,et al.The endothelial-specific microRNA miR-126governs vascular integrity and angiogenesis[J].Dev Cell,2008,15(2):261-271
[17] Nicoli S,Standley C,Walker P,et al.MicroRNA-mediated integration of haemodynamics and Vegf signalling during angiogenesis[J].Nature,2010,464(7292):1196-1200
[18] Li W,Xu H,Hu Y,et al.Edaravone protected human brain microvascular endothelial cells from methylglyoxal-induced injury by inhibiting AGEs/RAGE/oxidative stress[J].PLoS One,2013,8(9):e76025
[19] Sun YY,Morozov YM,Yang D,et al.Synergy of combined tPA-edaravone therapy in experimental thrombotic stroke[J].PLoS One,2014,9(6):e98807
[20] Yagi K,Kitazato KT,Uno M,et al.Edaravone,a free radical scavenger, inhibits MMP-9-related brain hemorrhage in rats treated with tissue plasminogen activator[J].Stroke,2009,40(2):626-631
[21] Luo D,Fan X,Ma C,et al.A Study on the Effect of Neurogenesis and Regulation of GSK3beta/PP2A Expression in Acupuncture Treatment of Neural Functional Damage Caused by Focal Ischemia in MCAO Rats[J].Evid Based Complement Alternat Med,2014,2014:962343
[22] Tian GH,Sun K,Huang P,et al.Long-Term Stimulation with Electroacupuncture at DU20and ST36Rescues Hippocampal Neuron through Attenuating Cerebral Blood Flow in Spontaneously Hypertensive Rats[J].Evid Based Complement Alternat Med,2013,2013:482947
[23] Dong H,Fan YH,Zhang W,et al.Repeated electroacupuncture preconditioning attenuates matrix metalloproteinase-9expression and activity after focal cerebral ischemia in rats[J].Neurol Res,2009,31(8):853-858
[24] Tao J,Xue XH,Chen LD,et al.Electroacupuncture improves neurological deficits and enhancesproliferation and differentiation of endogenous nerve stem cells in rats with focal cerebral ischemia[J].Neurol Res,2010,32(2):198-204
Effect of Acupuncture on Peripheral Serum Expression of miRNA-126and Vascular Endothelial Growth Factor in Rats with Cerebral Ischemia
XU Hong,ZHANG Ya-min,SUN Hua△,CHEN Su-hui,WANG Fu-ming,YANG Yang
(ChineseAcademyofMedicalSciences,PekingUnionMedicalCollege,PekingUnionMedicalCollegeHospital,Beijing100730,China)
Objective:To explore the effect of acupuncture at “Baihui” (GV20) and “Zusanli” (ST36) on the peripheral serum expression of miRNA-126and VEGF in rats with CIRI. Methods:Healthy male Sprague-Dawley rats were randomized into a sham-operated group(S), a model group (M), an acupuncture group(A) and an edaravone group (ED) by using the random digit table. Each group was further randomly divided into 1d, 3d, 5d and 7d subgroups based on the reperfusion times according to the random digit table. In the group (M) and the group (A), CIRI was induced by using the thread occlusion method. TTC staining was used to evaluate the success of models. Electroacupuncture stimulation was applied daily to GV20and left ST36for 20min at the indicated time points after successful operation. Edaravone was given at the indicated time points after successful operation once a day. Serum was sampled for detecting VEGF protein via enzyme-linked immunosorbent assay, and serum miRNA-126was examined by using quantitative PCR.Results:The serum level of miRNA-126and VEGF increased significantly, and the peak expression of the group (M) and the group (A) occurred on the 3rd day. The expression of miRNA-126and VEGF in the group (A) and the group (ED) was lower than that in the group(M) at the same time point (P<0.05), and the expression of miRNA-126and VEGF in group (A) was higher than that in the group(ED) for the time points of 3d, 5d and 7d (P<0.05).Conclusion:Acupuncture therapy has a better effect on alleviating CIRI.The mechanism is related to down-regulating the expression of miRNA-126and VEGF.
Acupuncture;Cerebral ischemia;miRNA-126;Vascular endothelial growth factor
国家自然科学基金委项目,编号:81574054,81403459。
徐虹(1984-),女,住院医师,2014级中西医结合临床专业博士研究生,研究方向:针刺对脑血管病的研究。
△通讯作者:孙华(1957-),女,主任医师,博士研究生导师,主要从事针刺对脑血管病临床与实验研究。
R246.6
A
1005-0779(2016)10-0080-04
2016-05-15
