帕金森病、多系统萎缩和特发性震颤患者131碘-间碘苄胍心肌显像研究
2016-12-19杨团峰焦劲松郭淮莲
杨团峰, 王 丽, 程 敏, 李 原, 焦劲松, 王 茜, 郭淮莲
帕金森病、多系统萎缩和特发性震颤患者131碘-间碘苄胍心肌显像研究
杨团峰1, 王 丽2, 程 敏1, 李 原3, 焦劲松2, 王 茜3, 郭淮莲1
目的 采用131碘-间碘苄胍(131I-MIBG)心肌显像方法评估帕金森病(PD)、多系统萎缩(MSA)及特发性震颤(ET)患者的心脏交感神经功能,以期为上述疾病的鉴别探索新的方法。方法 收集PD患者25例,MSA患者18例,ET患者11例和正常对照者10例,所有受试者均行131I-MIBG心肌显像,分别测定计算15 min和4 h两个时间点的心脏/纵膈(H/M)放射性计数比值,作为131I-MIBG心肌摄取率。结果 PD组15 min和4 h两个时间点的H/M值分别为1.65±0.36和1.50±0.43,MSA组分别为1.97±0.36和2.08±0.57,ET组分别为2.34±0.34和2.46±0.51,对照组分别为2.41±0.26和2.66±0.47。两两比较,PD组两个时间点的H/M值均低于MSA组、ET组和对照组相应值(均P<0.05),MSA组两个时间点的H/M值均低于对照组相应值(均P<0.05),ET组与对照组两个时间点的H/M值差异均无统计学意义(均P>0.05)。结论 PD、MSA患者均可发生心脏交感神经功能损害,且PD患者损害更著,而ET患者心脏交感神经功能无明显改变。131I-MIBG心肌显像可能有助于PD、MSA及ET的鉴别诊断。
帕金森病; 多系统萎缩; 特发性震颤; 间碘苄胍; 交感神经系统
帕金森病(PD)、多系统萎缩(MSA)、特发性震颤(ET)均为锥体外系疾病,且治疗原则各异,但有时临床鉴别困难,尤其在疾病早期。间碘苄胍(MIBG)是去甲肾上腺素(NE)功能类似物,可被体内交感神经末梢摄取,其摄取、储存和释放机制与NE相同,MIBG心肌显像可以直观且定量的观察心脏交感神经完整性及功能状态,成为评估心脏交感神经功能的敏感指标[1~4]。本研究采用131碘标记的MIBG(131I-MIBG)心肌显像方法评估PD、MSA及ET患者的心脏交感神经功能,并比较其131I-MIBG心肌摄取率,以期为上述疾病的鉴别探索新的方法。
1 资料和方法
1.1 研究对象 选取2013年1月-2015年7月就诊于北京大学人民医院和中日友好医院神经内科的PD患者25例,MSA患者18例,ET患者11例和正常对照者10例。入组标准:PD组符合1992年英国脑库PD诊断标准[5],MSA组符合2008年Gilman等制定的第二版MSA诊断标准[6],ET组诊断标准参照1998年国际运动障碍协会制定的震颤共识[7],对照组:性别和年龄与病例组相匹配,神经系统查体无异常的健康志愿者。排除标准:(1)脑卒中、脑外伤、脑炎、颅内肿瘤等中枢神经系统疾病;(2)心肌梗死、心肌病、心律失常、充血性心力衰竭等心脏疾病;(3)正在服用影响131I-MIBG摄取的药物[8],包括利血平、拉贝洛尔、钙通道阻滞剂、三环类抗抑郁药、可卡因、麻黄碱、苯丙胺等;(4)甲状腺疾病、碘过敏史。向所有受试者详细告知本研究的目的和流程,并签署知情同意书。
1.2 研究方法
1.2.1 基线资料采集 记录所有受试者的基本特征(年龄、性别),由神经科专科医师对其进行病史采集,详细询问病史,包括起病年龄、病程、首发及主要症状、病情进展顺序、诊疗经过,既往是否有中枢神经系统、心脏等病史,特殊药物服用、毒物接触等病史,家族史等,仔细阅读头部CT或MRI,并进行详细的神经系统查体。采用Hoehn-Yahr(H-Y)分级[9]对PD患者进行病情评估。
1.2.2131I-MIBG心肌显像
(1)受试者于检查前3 d开始口服复方碘溶液0.3~0.5 ml 3次/日以封闭甲状腺,并持续至检查后1 w。(2)受试者在静脉注射131I-MIBG 3 mCi后,使用PHILIPS Precedence6 SPECT/CT成像仪,分别于15 min和4 h采集胸部前位平面像,通过勾画感兴趣区(ROI),计算心脏/纵膈(heart/mediastinum,H/M)放射性计数比值,以此作为131I-MIBG心肌摄取率。
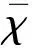
2 结 果
2.1 组间基线资料比较 PD组共25例(其中H-YⅠ级8例,Ⅱ级11例,Ⅲ级4例,Ⅳ级1级,Ⅴ级1例),男14例,女11例,年龄43~80岁,平均65.40±9.18岁;MSA组共18例,男12例,女6例,年龄48~80岁,平均62.50±8.73岁;ET组共11例,男5例,女6例,年龄53~81岁,平均66.64±9.64岁;对照组共10例,男2例,女8例,年龄43~76岁,平均59.00±9.06岁(见表1)。4组间在性别(P>0.05,χ2检验)和年龄(P>0.05,单因素方差分析)上相匹配。
2.2 组间131I-MIBG心肌摄取率(H/M值)比较 PD组15 min和4 h两个时间点的H/M值分别为1.65±0.36和1.50±0.43,MSA组分别为1.97±0.36和2.08±0.57,ET组分别为2.34±0.34和2.46±0.51,对照组分别为2.41±0.26和2.66±0.47(见表2、图1、图2、图3、图4)。两两比较,PD组两个时间点的H/M值均显著低于MSA组、ET组和对照组相应值(均P<0.05),MSA组两个时间点的H/M值均显著低于对照组相应值(均P<0.05),ET组与对照组两个时间点的H/M值差异均无统计学意义(均P>0.05)。

表1 组间临床资料比较

表2 组间131I-MIBG心肌摄取率(H/M值)比较
采用LSD-t检验,与对照组相比*P<0.05;与MSA组相比#P<0.05;与ET组相比◇P<0.05;与对照组相比△P>0.05
A:15 min像;B:4 h像,各时间点心肌显影浅淡,131I-MIBG摄取减少
图1 PD患者131I-MIBG心肌显像图,圆形区域代表心脏(H),矩形区域代表纵膈(M)
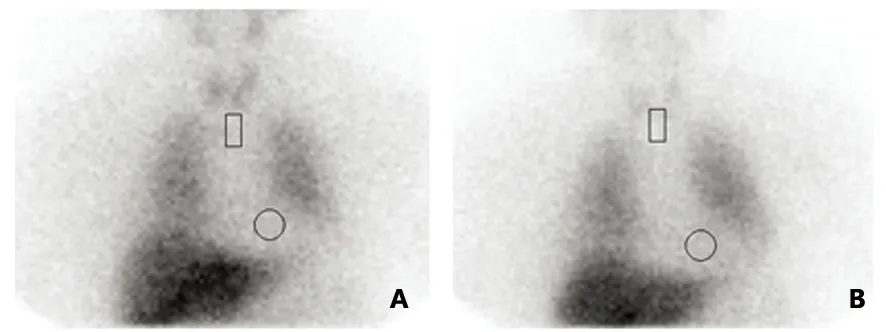
A:15 min像;B:4 h像,各时间点心肌显影浅淡,131 I-MIBG摄取减少
图2 MSA患者131I-MIBG心肌显像图,圆形区域代表心脏(H),矩形区域代表纵膈(M)

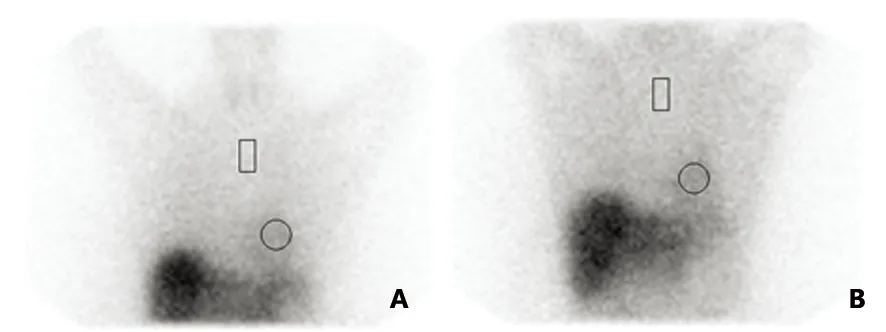
A:15 min像;B :4 h像,各时间点心肌显影良好,放射性分布均匀
图3 ET患者131I-MIBG心肌显像图,圆形区域代表心脏(H),矩形区域代表纵膈(M)
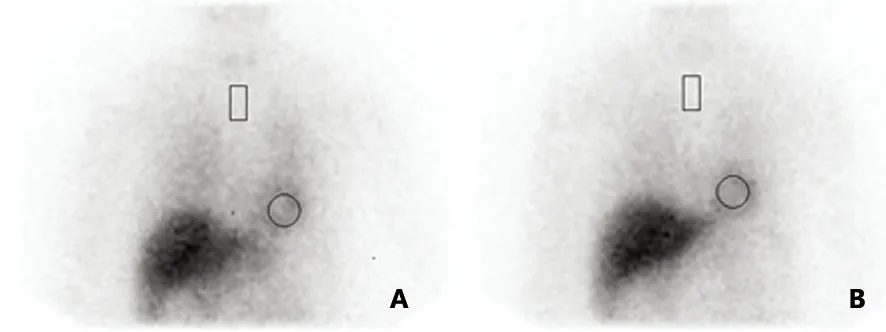
A:15 min像;B:4 h像,各时间点心肌显影良好,放射性分布均匀
图4 正常对照者131I-MIBG心肌显像图,圆形区域代表心脏(H),矩形区域代表纵膈(M)
3 讨 论
MIBG是NE的功能类似物,MIBG的摄取主要包括Ⅰ型摄取(神经摄取)和Ⅱ型摄取(非神经摄取)两种机制,Ⅰ型摄取需依赖去甲肾上腺素转运体(NET),Ⅱ型摄取为被动扩散机制。通常采集早期(15 min)与延迟期(4 h)两次显像,计算H/M值,以此作为MIBG心肌摄取率。早期显像主要反映突触前心脏交感神经末梢的密度,大约3~4 h后,非神经摄取部分几乎完全被清除,而神经摄取部分清除率较低,因此延迟期显像可同时反映心脏交感神经的功能活性,更能准确的评估心脏交感神经功能[1~4]。
本研究发现,PD患者MIBG心肌摄取率较MSA组、ET组、对照组均显著下降,与国外研究结果相似[2~4,10~13]。既往研究同时提示,PD早期即可出现MIBG心肌摄取率下降,本研究纳入PD患者25例,其中早期PD(H-Y Ⅰ级和Ⅱ级)共19例,似乎支持上述观点。目前认为,PD、路易体痴呆(DLB)、纯自主神经功能衰竭(PAF)等疾病存在相同的病理特征[14,15],神经元内均有α-突触核蛋白及路易小体形成,统称为路易小体疾病(LBD)。PD患者自主神经系统受累广泛,在下丘脑、交感神经系统(胸髓中间外侧柱、交感神经节)、副交感神经系统(动眼神经E-W核、泌涎核、迷走神经背核、副交感神经节)、心脏神经丛、消化道、盆神经丛、肾上腺髓质等部位均有路易小体发现[16~18]。尸检已证实,PD患者心脏中酪氨酸羟化酶(TH)免疫反应阳性交感神经轴索数目降低[16~18]。近期一项研究纳入了23例LBD患者,所有患者的诊断均经尸检病理证实,且生前均曾行MIBG心肌显像,收集患者心肌组织行免疫组化染色,研究显示早期和延迟期分别有90.9%和95.7%的患者H/M值下降,心肌中TH免疫反应阳性轴索面积、神经微丝蛋白(NF)免疫反应阳性轴索面积与早期及延迟期H/M值均显著相关(均P<0.05),该研究首次确认LBD患者MIBG心肌摄取率下降与心脏交感神经轴索缺失存在紧密关联[19]。以上提示PD发病时,心脏交感神经系统可受累,心脏节后交感神经末梢密度降低,PD患者MIBG心肌摄取率下降与心脏交感失神经密切相关。
对于鉴别PD与MSA,Braune等[20]通过meta分析发现,MIBG心肌显像的灵敏度和特异度分别可达89.7%和94.6%。Orimo等[3]发现,MIBG心肌显像鉴别PD与MSA的灵敏度和特异度分别可达90.2%和81.9%。Tregla等[2]对19项研究、共计1972例患者进行meta分析,发现MIBG心肌显像鉴别PD与其他帕金森综合征的灵敏度和特异度分别为88%和85%。Orimo等[3]对13项研究、共计845例患者进行meta分析,发现延迟期H/M值鉴别PD与其他伴帕金森综合征的神经系统变性疾病的灵敏度和特异度分别为89.7%和82.6%,若将PD患者限定在病情早期(H-Y Ⅰ级和Ⅱ级),延迟期H/M值用于PD诊断的灵敏度和特异度分别可达94.1%和80.2%。以上提示,MIBG心肌显像对PD的诊断及鉴别诊断有较高的灵敏度和特异度,对于早期PD患者,其灵敏度更高。
传统观点认为,PD主要为周围节后交感神经受累,而MSA主要为中枢节前交感神经受累,其节后交感神经通常幸免[21,22]。然而本研究发现,MSA患者MIBG心肌摄取率较对照组下降,与既往部分研究结果一致[12,23,24],提示MSA患者心脏节后交感神经也可同时受累。Orimo等[25]对15例经病理证实的MSA患者尸检发现,6例病程较长的患者心脏中TH免疫反应阳性轴索数目轻度下降。Druschky等[12]提出,可能由于跨突触效应的作用,导致MSA患者节后交感神经功能受损,影响心肌MIBG的摄取,且MIBG心肌摄取率可能与病程相关。
ET是一种以姿势性或动作性震颤为主要特点的运动障碍性疾病,随着研究的深入,发现18.8%的ET患者可出现静止性震颤[26],而PD患者也可伴姿势性震颤,二者有时鉴别困难。本研究显示,ET患者MIBG心肌摄取率与对照组相比,差异无统计学意义。在Orimo等[11]、Lee等[27]的研究中,均有同样的发现。Rajput等[28]收集了9例ET尸检病例,未发现ET患者存在与PD相一致的病理改变。以上提示,ET患者心脏交感神经功能无明显受累。
本研究显示,PD、MSA患者均可发生心脏交感神经功能损害,且PD患者损害更著,而ET患者心脏交感神经功能无明显改变。131I-MIBG心肌显像可能有助于PD、MSA及ET的鉴别诊断。下一步还需要进一步扩大样本量,并对患者进行长期随访,以不断完善该研究。
[1]Yamashina S,Yamazaki J. Neuronal imaging using SPECT[J]. Eur J Nucl Med Mol Imaging,2007,34(6):939-950.
[2]Treglia G,Cason E,Stefanelli A,et al. MIBG scintigraphy in differential diagnosis of Parkinsonism:a meta-analysis[J]. Clin Auton Res,2012,22(1):43-55.
[3]Orimo S,Suzuki M,Inaba A,et al. 123I-MIBG myocardial scintigraphy for differentiating Parkinson’s disease from other neurodegenerative parkinsonism:a systematic review and meta-analysis[J]. Parkinsonism Relat Disord,2012,18(5):494-500.
[4]Lucio CG,Vincenzo C,Antonio R,et al. Neurological applications for myocardial MIBG scintigraphy[J]. Nucl Med Rev Cent East Eur,2013,16(1):35-41.
[5]Hughes AJ,Daniel SE,Kilford L,et al. Accuracy of clinical diagnosis of idiopathic Parkinson’s disease:a clinico-pathological study of 100 cases[J]. J Neurol Neurosurg Psychiatry,1992,55(3):181-184.
[6]Gilman S,Wenning GK,Low PA,et al. Second consensus statement on the diagnosis of multiple system atrophy[J]. Neurology,2008,71(9):670-676.
[7]Deuschl G,Bain P,Brin M. Consensus statement of the Movement Disorder Society on Tremor. Ad Hoc Scientific Committee[J]. Mov Disord,1998,13(Suppl 3):2-23.
[8]Solanki KK,Bomanji J,Moyes J,et al. A pharmacological guide to medicines which interfere with the biodistribution of radiolabelled meta-iodobenzylguanidine(MIBG)[J]. Nucl Med Commun,1992,13(7):513-521.
[9]Hoehn MM,Yahr MD. Parkinsonism:onset,progression,and mortality[J]. Neurology,1967,17(5):427-442.
[10]Yoshita M. Differentiation of idiopathic Parkinson’s disease from striatonigral degeneration and progressive supranuclear palsy using iodine-123 meta-iodobenzylguanidine myocardial scintigraphy[J]. J Neurol Sci,1998,155(1):60-67.
[11]Orimo S,Ozawa E,Nakade S,et al.123I-metaiodobenzylguanidine myocardial scintigraphy in Parkinson’s disease[J]. J Neurol Neurosurg Psychiatry,1999,67(2):189-194.
[12]Druschky A,Hilz MJ,Platsch G,et al. Differentiation of Parkinson’s disease and multiple system atrophy in early disease stages by means of I-123-MIBG-SPECT[J]. J Neurol Sci,2000,175(1):3-12.
[13]Saiki S,Hirose G,Sakai K,et al. Cardiac123I-MIBG scintigraphy can assess the disease severity and phenotype of PD[J]. J Neurol Sci,2004,220(1-2):105-111.
[14]Nakajima K,Yoshita M,Matsuo S,et al. Iodine-123-MIBG sympathetic imaging in Lewy-body diseases and related movement disorders[J]. Q J Nucl Med Mol Imaging,2008,52(4):378-387.
[15]Hishikawa N,Hashizume Y,Yoshida M,et al. Clinical and neuropathological correlates of Lewy body disease[J]. Acta Neuropathol,2003,105(4):341-350.
[16]Orimo S,Uchihara T,Nakamura A,et al. Axonal α-synuclein aggregates herald centripetal degeneration of cardiac sympathetic nerve in Parkinson’s disease[J]. Brain,2008,131(Pt 3):642-650.
[17]Wakabayashi K,Takahashi H. Neuropathology of autonomic nervous system in Parkinson’s disease[J]. Eur Neurol,1997,38 (Suppl 2):2-7.
[18]Iwanaga K,Wakabayashi K,Yoshimoto M,et al. Lewy body-type degeneration in cardiac plexus in Parkinson’s and incidental Lewy body diseases[J]. Neurology,1999,52(6):1269-1271.
[19]Takahashi M,Ikemura M,Oka T,et al. Quantitative correlation between cardiac MIBG uptake and remaining axons in the cardiac sympathetic nerve in Lewy body disease[J]. J Neurol Neurosurg Psychiatry,2015,86(9):939-944.
[20]Braune S. The role of cardiac metaiodobenzylguanidine uptake in the differential diagnosis of parkinsonian syndromes[J]. Clin Auton Res,2001,11(6):351-355.
[21]Orimo S,Oka T,Miura H,et al. Sympathetic cardiac denervation in Parkinson’s disease and pure autonomic failure but not in multiple system atrophy[J]. J Neurol Neurosurg Psychiat,2002,73(6):776-777.
[22]Daniel SE. The neuropathology and neurochemistry of multiple system atrophy[A]. In:Bannister R,Mathias CJ. Autonomic failure. A textbook of clinical disorders of the autonomic nervous system[M]. 4th ed. Oxford:Oxford Medical Publications,1999. 321-328.
[23]Chung EJ,Lee WY,Yoon WT,et al. MIBG scintigraphy for differentiating Parkinson’s disease with autonomic dysfunction from Parkinsonism-predominant multiple system atrophy[J]. Mov Disord,2009,24(11):1650-1655.
[24]Nagayama H,Ueda M,Yamazaki M,et al. Abnormal cardiac [(123)I]-meta-iodobenzylguanidine uptake in multiple system atrophy[J]. Mov Disord,2010,25(11):1744-1747.
[25]Orimo S,Kanazawa T,Nakamura A,et al. Degeneration of cardiac sympathetic nerve can occur in multiple system atrophy[J]. Acta Neuropathol,2007,113(1):81-86.
[26]Cohen O,Pullman S,Jurewicz E,et al. Rest tremor in patients with essential tremor:prevalence,clinical correlates,and electrophysiologic characteristics[J]. Arch Neurol,2003,60(3):405-410.
[27]Lee PH,Kim JW,Bang OY,et al. Cardiac 123I-MIBG scintigraphy in patients with essential tremor [J]. Mov Disord,2006,21(8):1235-1238.
[28]Rajput AH,Rozdilsky B,Ang L,et al. Significance of parkinsonian manifestations in essential tremor[J]. Can J Neurol Sci,1993,20(2):114-117.
131I-MIBG myocardial scintigraphy in patients with Parkinson’s disease,multiple system atrophy and essential tremor
YANG Tuanfeng,WANG Li,CHENG Min,et al.
(Department of Neurology,Peking University People’s Hospital,Beijing 100044,China)
Objective The present study is to assess the cardiac sympathetic nerve function in patients with Parkinson’s disease (PD),multiple system atrophy(MSA) and essential tremor(ET) using131I-MIBG myocardial scintigraphy and to explore a new method for differential diagnosis among them with expectation. Methods Twenty-five PD,eighteen MSA,eleven ET and ten normal controls were enrolled.131I-MIBG myocardial scintigraphy was performed on each subject and then heart to mediastinum (H/M) ratios were calculated at two sampled time (15 min and 4 h),which represented the131I-MIBG myocardial uptake ratios. Results The H/M ratios at two sampled time (15 min and 4 h) in the PD group were 1.65±0.36 and 1.50±0.43,and those of the MSA group were 1.97±0.36 and 2.08±0.57,the ET group were 2.34±0.34 and 2.46±0.51,and the control group were 2.41±0.26 and 2.66±0.47. The H/M ratios at two sampled time in the PD group were lower than those of the MSA,ET and control group respectively,with statistical significance (allP<0.05). The H/M ratios at two sampled time in the MSA group were significantly lower than those of the control group respectively (allP<0.05). There was no significant difference in H/M ratios at two sampled time between the ET and control groups (allP>0.05). Conclusion Cardiac sympathetic dysfunction could occur in both PD and MSA patients,especially in PD patients. In contrast,cardiac sympathetic function remains in ET patients. Above all,131I-MIBG myocardial scintigraphy may help realize differential diagnosis among PD,MSA and ET patients.
Parkinson’s disease; Multiple system atrophy; Essential tremor; Metaiodobenzylguanidine (MIBG); Sympathetic nervous system
1003-2754(2016)03-0215-04
2015-09-16;
2016-03-07
(1.北京大学人民医院神经内科,北京 100044;2.中日友好医院神经内科,北京 100029;3.北京大学人民医院核医学科,北京 100044)
郭淮莲,E-mail:guoh@bjmu.edu.cn
R742.5
A
