Nec-1在小鼠脑出血中通过抑制程序性坏死发挥神经保护作用
2016-12-19张明阳朱妙章张学策赵海康单海燕
常 盼, 于 军, 张明阳, 朱妙章, 铁 茹, 张学策, 赵海康, 单海燕
Nec-1在小鼠脑出血中通过抑制程序性坏死发挥神经保护作用
常 盼1,3, 于 军1, 张明阳2, 朱妙章3, 铁 茹1, 张学策1, 赵海康4, 单海燕5
目的 研究程序性坏死的特异性抑制剂Nec-1对小鼠脑出血神经功能的保护作用,并探讨其机制。方法 选取健康雄性ICR小鼠,体重25~30 g,采用在纹状体部位注射胶原酶Ⅳ或生理盐水的方法建立小鼠脑出血组或者脑出血对照组,在脑出血前15 min 分别在侧脑室注射Nec-1溶液或vehicle溶液。将实验随机分为:对照组、脑出血+vehicle处理组、脑出血+ Nec-1处理组。分别利用干湿重法测定脑水肿程度,神经功能评分检测神经运动功能,Western blotting检测cleaved caspase-3,Bcl-2蛋白表达情况。结果 脑出血加剧脑水肿程度,而 Nec-1处理组减轻脑水肿程度(P<0.05)。经Nec-1处理后,可以提高小鼠脑出血神经运动功能(P<0.05)。脑出血可以增加cleaved caspase-3蛋白表达,抑制Bcl-2蛋白表达,经 Nec-1处理后,抑制cleaved caspase-3的表达水平(P<0.05),增加Bcl-2的表达 (P<0.05)。结论 Nec-1对脑出血发挥重要神经保护作用,这种保护作用可能是通过抑制凋亡通路实现的,提示程序性坏死在脑出血中具有重要作用,将为脑出血的治疗提供新的思路。
Nec-1; 脑出血; 程序性坏死; cleaved caspase-3; Bcl-2
脑出血(intracerebral hemorrhage,ICH)是一个严重危害人类健康的公共卫生问题,占所有住院脑卒中患者的10%~30%,具有很高的病死率和致残率,6 m的病死率达30%~50%[1,2]。脑出血后的脑损伤机制很复杂,目前脑出血的治疗没有突破性进展。程序性坏死作为一种程序性细胞死亡方式,参与多种神经损伤疾病中,但在脑出血中的作用仍不清楚。有研究者发现程序性坏死的特异性抑制剂Nec-1可以减少脑缺血中脑组织梗死体积[3,4],除此之外,Nec-1能够减小脑外伤后的细胞损伤数,甚至可以改善脑外伤引起的神经功能障碍[5],但Nec-1对脑出血的作用仍不清楚,且Nec-1发挥神经作用的机制仍未见报道。
为此,本研究拟通过检测Nec-1对小鼠脑出血神经功能的影响,以及其对凋亡的影响,研究Nec-1对小鼠脑出血神经作用及其相关机制,旨在为进一步研究脑出血的治疗方案提供新靶点,以期为脑出血的生理病理机制提供新思路。
1 材料和方法
1.1 主要材料和试剂 ICR小鼠由西安交通大学医学部动物实验中心提供。胶原酶IV(collagenase IV)、caspase-3、Bcl-2购于美国Sigma-Aldrich公司。
1.2 脑出血模型建立 小鼠称重后麻醉,参照Wang等人 方法,剥离右侧颅顶骨膜,固定于小鼠脑立体定位仪上,用颅骨钻刺一小孔,微量进样器于左侧纹状体内注射胶原酶IV,深度为3.5 mm,于5 min内均匀注入后,留针5 min,然后拔针。
1.3 实验分组 6~8 w龄ICR小鼠(25~30 g)随机分成未处理组,处理组(Veh组、Nec-1组),处理组每组分为24 h和72 h,每组6只,于出血前侧脑室分别注射DMSO溶剂或者Nec-1溶剂。
1.4 脑水肿的测定 脑水肿的程度可以用脑组织含水量来表示。小鼠出血后分别在24 h和72 h断头取脑后,迅速取出脑组织,去除嗅球和脑干,放于水平面,然后沿正中线切开,分离脑皮质和纹状体。小脑作为参考标准也予以测重。分离得到5部分脑组织:伤侧及对侧脑皮质,伤侧及对侧纹状体,小脑。迅速将脑组织放到电子精密天平上称重得到脑组织的湿重,并记录,随后,将脑组织放入100 ℃的烘箱内,24 h后取出脑组织并测量干重。脑组织含水量(%)的计算方法如下:(湿重-干重)/湿重×100。
1.5 神经运动功能的检测 运动功能在出血前1 d及出血后1~7 d 进行检测。将实验小鼠的尾巴用手抓住,让它的两个前爪抓住线的中间,每只小鼠从前部、左侧及右侧3个不同的方向重复操作3次,按照评分标准,记录分数,并计算平均分。
1.6 脑组织中caspase-3、Bcl-2蛋白表达量的测定 分别在脑出血后24 h 和72 h,将各组小鼠用水合氯醛麻醉,断头取脑,在脑模中按统一标准取出血脑组织,加入组织裂解液,超声细胞破碎仪低温匀浆,抽取上清,BCA法测蛋白含量后,进行Western blotting实验。
2 结 果
2.1 Nec-1对脑出血后脑水肿的影响 在脑出血24 h后,Nec-1组与vehicle组相比,可以减少出血侧皮质和基底节脑水肿的程度(P<0.05),而对侧皮质和基底节脑水肿程度无差异,小脑的水肿程度也未改变。表明经Nec-1处理后可以减轻脑出血后的脑水肿程度(见图1)。
2.2 Nec-1对脑出血后神经运动功能的影响 脑出血后1 w内小鼠运动功能减退,Nec-1处理后有助于提高出血后神经运动功能的恢复(P<0.05)。表明经Nec-1处理有助于提高脑出血后神经运动功能的恢复(见图2)。
2.3 Nec-1对脑出血后cleaved caspase-3(CC3)表达的影响 脑出血24 h和48 h后CC3表达增加(P<0.05),Nec-1处理后降低CC3的表达(P<0.05),表明Nec-1可以降低脑出血后CC3的表达(见图3)。
2.4 Nec-1对脑出血后Bcl-2表达的影响 脑出血24 h 和48 h后抗凋亡蛋白Bcl-2表达降低(P<0.05),而Nec-1处理组可以增加Bcl-2蛋白的表达量(P<0.05),表明Nec-1可以增加脑出血后Bcl-2蛋白的表达(见图4)。
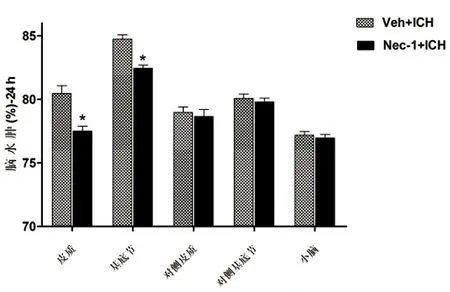
与同部位Veh组比较*P<0.05
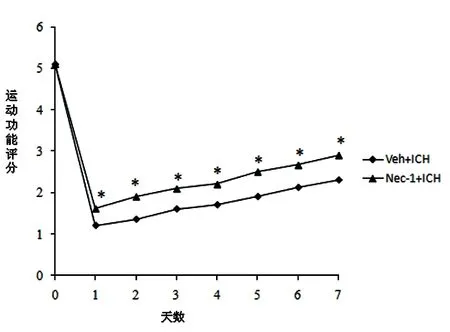
与Con组比较#P<0.05;与Veh组比较*P<0.05

与同部位Veh组比较*P<0.05
图3 Nec-1对脑出血后cleaved caspase-3(CC3)蛋白表达的影响

与Con组比较#P<0.05;与Veh组比较*P<0.05
3 讨 论
随着我国社会人口老龄化加快,脑出血已成为危害我国中老年人身体健康和生命的主要疾病之一。尽管有关脑出血后神经细胞死亡的机制得到深入研究,但迄今为止,临床上脑出血的治疗没有突破性进展。脑出血后的脑损伤机制很复杂,其中包括最初的物理损伤和血肿的占位效应所引起的原发性损伤,以及继发性损伤如血脑屏障的破坏、脑水肿、炎症反应和神经细胞的死亡等[1,6]。现已证实,多种细胞死亡方式都存在于脑出血的损伤中,但是具体机制仍不清楚。为了提供新的有效的治疗方法,探究脑出血后诱导的大脑损伤的病理机制尤其是细胞死亡方式十分重要。
在细胞的生命周期中,死亡是一个不可避免而又极其重要的环节。细胞的增殖和死亡之间的动态平衡对于多细胞生物的发育,以及内环境稳定的维持都是非常重要的,一旦这种平衡被打破,就会导致胚胎发育异常、癌症、自身免疫性疾病和退行性疾病等疾病的发生。因此,多细胞生物在进化过程中逐渐形成了一套复杂而精密的调节机制来维持这种平衡。细胞死亡不仅是细胞的最终命运,而且它如同细胞分裂、增殖一样,在整个机体的生长、发育中具有不可替代的作用。随着对细胞死亡机制的深入研究,细胞死亡的方式有多种,关于细胞死亡的分类目前并不统一,但普遍将受基因调控、高度有序、主动的细胞死亡方式称为程序性细胞死亡(programmed cell death,PCD)。越来越多的证明表明,部分细胞坏死也是程序性细胞死亡方式中重要的一种[7]。
细胞坏死是机体免疫抵御的重要组成部分,也是机体应对损伤时用于清理损伤细胞的重要方式,细胞坏死途径会通过激活炎性反应来清除受损细胞和细胞内容物。但过量的细胞坏死会使得炎性反应不断扩大,从而造成不可逆转的组织损伤甚至导致机体的死亡。人们对坏死的认识不断出现新证据,不仅表明细胞坏死不同于细胞凋亡,而且可以由信号途径介导。2005年哈佛大学医学院袁均英教授的课题组,发现一种小分子物质Nec-1,可以特异性的抑制细胞坏死,并将这一种细胞死亡方式命名为程序性坏死(necroptosis)[8]。研究发现程序性坏死是一种受基因调控、高度有序、主动的细胞死亡形式,受体相互作用蛋白激酶1( receptor interaction protein kinase 1,RIP 1)和受体相互作用蛋白激酶3(receptor interaction protein kinase 3,RIP 3 )是其关键的调控因子[7,9]。更重要的是越来越多的证据,不仅表明细胞坏死可以由信号途径介导,而且还被发现参与到缺血性心脑血管疾病和神经退行性等疾病的病理过程。例如,有研究者发现,程序性坏死的特异性抑制剂Nec-1可以减少脑缺血中脑组织梗死体积[3,4]。除此之外,Nec-1能够可以减小脑外伤后的细胞损伤数[5],甚至可以改善脑外伤引起的神经功能障碍,这些结果提示,程序性坏死的特异性抑制剂Nec-1对神经细胞的损伤具有保护作用。可见,程序性坏死这种细胞死亡方式在各种原因引起的神经细胞损伤中具有重要的作用,抑制程序性坏死对神经系统疾病及神经损伤起到保护作用。因此,阐明程序性坏死的分子机制以及研发有效的抑制剂是非常必要的,为制定有效的治疗策略提供强有力的科学依据。
在本研究中,通过在纹状体注射胶原酶IV建立脑出血模型,由于脑出血后的机制非常复杂,其中血肿周边的脑水肿是脑出血后最严重的继发性损伤之一,它的发生和发展是导致脑出血病情发展和恶化的重要原因之一[10,11]。因此本研究首先检测Nec-1对脑出血后脑水肿程度的影响,通过观察脑出血24 h后Nec-1给药组和DMSO溶剂对照组脑水肿的变化,发现Nec-1可以减少脑水肿程度。为了进一步研究Nec-1对脑出血后的作用,我们应用行为学实验方法,检测Nec-1对脑出血后神经功能的影响,结果发现Nec-1有助于脑出血后神经功能的恢复。这些结果提示,Nec-1对脑出血具有神经保护作用,有助于脑出血后神经功能的恢复。
然而,程序性坏死的特异性抑制剂Nec-1对神经系统疾病尤其是脑出血的作用机制仍不清楚,为了研究Nec-1对脑出血的作用及机制,在本次研究中,我们通过检测凋亡蛋白CC3和抗凋亡蛋白Bcl-2。结果显示脑出血后CC3蛋白表达上升,Bcl-2蛋白水平降低,而Nec-1处理后抑制脑出血后CC3的蛋白表达的上升,而且上调Bcl-2的表达量。凋亡作为一种很重要的程序性细胞死亡方式,已经有文章报道,凋亡发生于脑出血中[12,13],部分研究也证明抑制凋亡在脑出血中发挥保护性作用[14,15],说明细胞凋亡现象在脑出血的病理学过程中发挥着重要作用,Bcl-2蛋白可以促使细胞色素C释放进入胞浆,启动caspase级联反应,从而导致细胞凋亡[16,17]。细胞内虽然存在多种信号传导途径,不同的凋亡信号的刺激可激活多种caspase,但最终都能导致caspase-3的激活,从而引起细胞凋亡。结合以上结果,提示Nec-1可能通过抑制凋亡的发生,而发挥其对脑出血的保护作用。同时,也说明在脑出血损伤中,程序性坏死是不同于凋亡的另一种重要细胞死亡方式。
综上所述,我们发现在脑出血中,程序性坏死的特异性抑制剂Nec-1可以减少脑出血后脑水肿程度,而且可以提高神经运动功能,同时Nec-1抑制凋亡蛋白CC3的表达,而增加抗凋亡蛋白Bcl-2。这些结果强烈提示Nec-1对脑出血具有重要的神经保护作用,多种细胞死亡方式参与脑出血的损伤机制中,抗凋亡途径可能是Nec-1在脑出血中发挥保护作用的机制之一,而且程序性坏死可能存在于凋亡的上游,因此其作为一种重要的细胞死亡方式,参与脑出血损伤中。程序性坏死的特异性抑制剂Nec-1具有广泛的应用前景,不仅有助于进一步阐明程序性坏死的分子机制,而且对于神经损伤性疾病新治疗策略的发展都有着极其重要的意义。
本研究发现程序性坏死细胞死亡途径,不仅发生在脑出血中,而且是可以被调控的。进一步我们推测程序性坏死可能是脑出血细胞死亡类型中重要方式之一,程序性坏死可能存在于细胞凋亡的上游,抑制程序性坏死可能成为脑出血防治的重要途径,抗凋亡有可能成为治疗脑出血的一种方法。另一方面,发展有效的抑制剂不仅有利于研究此信号途径的调控机制,而且将为脑出血等疾病的治疗提供新的方案,还可能将揭示细胞程序性死亡途径中新的作用蛋白。更重要的是,化学抑制剂都是潜在的药物,进一步的机制研究和改良以及在动物疾病模型上的深入探讨都有可能帮助其发展成为临床药物,这将为脑出血等疾病提供新的治疗手段。
[1]Keep RF,Hua Y,Xi G. Intracerebral haemorrhage:mechanisms of injury and therapeutic targets [J]. Lancet Neurol,2012,11(8):720-731.
[2]Balami JS,Buchan AM. Complicationsof intracerebral haemorrhage[J]. Lancet Neurol,2012,11(1):101-118.
[3]Yin B,Xu Y,Wei RL,et al. Inhibition of receptor-interacting protein 3 upregulation and nuclear translocation involved in Necrostatin-1 protection against hippocampal neuronal programmed necrosis induced by ischemia/reperfusion injury[J]. Brain Res,2015,1609:63-71.
[4]Linkermann A,Bräsen JH,Himmerkus N,et al. Rip1 (receptor-interacting protein kinase 1) mediates necroptosis and contributes to renal ischemia/reperfusioninjury[J]. Kidney Int,2012,81(8):751-761.
[5]Wang YQ,Wang L,Zhang MY,et al. Necrostatin-1 suppresses autophagy and apoptosis in mice traumatic brain injury model[J]. Neurochem Res,2012,37(9):1849-1858.
[6]Chen S,Yang Q,Chen G,et al. An update on inflammation in the acute phase of intracerebral hemorrhage[J]. Transl Stroke Res,2015,6(1):4-8.
[7]Linkermann A,Green DR. Necroptosis[J]. N Engl J Med,2014,70(5):455-465.
[8]Degterev A,Huang Z,Boyce M,et al. Chemical inhibitor of nonapoptotic cell death with therapeutic potential for ischemic brain injury[J]. Nat Chem Biol,2005,1(2):112-119.
[9]Feoktistova M,Leverkus M. Programmed necrosis and necroptosis signalling[J]. FEBS J,2015,282(1):19-31.
[10]Adeoye O,Clark JF,Khatri P,et al. Do current animal models of intracerebral hemorrhage mirror the human pathology[J]. Translational Stroke Research,2011,2(1):17-25.
[11]Keep RF,Zhou N,Xiang J,et al. Vascular disruption and blood-brain barrier dysfunction in intracerebral hemorrhage[J]. Fluids Barriers CNS,2014,10:11-18.
[12]LoPresti MA,Bruce SS,Camacho E,et al. Hematoma volume as the major determinant of outcomes after intracerebral hemorrhage[J]. J Neurol Sci,2014,345(1/2):3-7.
[13]Chen JC. The effects of acupuncture and traditional Chinese medicines on apoptosis of brain tissue in a rat intracerebral hemorrhage model[J]. Physiol Behav,2015,151:421-425.
[14]Wang T,Huang Y,Zhang M,et al. [Gly14]-Humanin offers neuroprotection through glycogen synthase kinase-3beta inhibition in a mouse model of intracerebral hemorrhage[J]. Behav Brain Res,2013,247:132-139.
[15]Sun H,Tang Y,Li L,et al. Effects of local hypothermia on neuronal cell apoptosis after intracerebral hemorrhage in rats[J]. J Nutr Health Aging,2015,19(3):291-298.
[16]Serasinghe MN,Missert DJ,Asciolla JJ,et al. Anti-apoptotic BCL-2 proteins govern cellular outcome following B-RAF(V600E) inhibition and can be targeted to reduce resistance[J]. Oncogene,2015,34(7):857-867.
[17]Chipuk JE. BCL-2 proteins:melanoma lives on the edge [J]. Oncoscience,2015,2(9):729-730.
The role and mechanism of Nec-1 after intracerebral hemorrhage in mice
CHANG Pan,YU Jun,ZHANG Mingyang,et al.
(Central Laboratory,Second Affiliated Hospital of Xi’an Medical College,Xi’an 710038,China)
Objective To investigate the influence of Nec-1,a specific necroptosis inhibitor,on neurofunction after intracerebral hemorrhage and underlying mechanism. Methods Male ICR mice (25~30g) received an infusion of collagenase type IV to induce ICH (intracerebral hemorrhage) or saline as control into the left striatum. Nec-1 and vehicle were pretreated with a single intracerebroventricular (i. c. v. ) injection into the ipsilateral ventricle 15 min before ICH,respectively. Those mice were randomizes into three groups,control group,ICH and vehicle group,ICH and Nec-1 group. Then brain water content and neurological test were assessed. Meanwhile,the protein of cleaved caspase-3 and Bcl-2 were detected by Western blotting. Results Nec-1-treated group attenuated the brain water content and improved neurological function compared with vehicle group after ICH. Nec-1-treated group inhibited the cleaved caspase-3 and enhanced the Bcl-2 protein expression compared with vehicle group after ICH. Conclusion Nec-1 plays neuroprotection role via inhibition of apoptosis after ICH. Meanwhile,it shows that necroptosis has an important role after ICH,which also provides a new way for treating ICH.
Nec-1; Necroptosis; Intracerebral hemorrhage; Cleaved caspase-3; Bcl-2
1003-2754(2016)03-0196-04
2015-11-20;
2016-02-06
国家自然科学基金(No. 81301039);中国博士后科学基金(No. 152865);陕西省教育厅专项科研资助项目(No. 15JK1617);苏州市科技发展计划项目(No. SYSD2015119)
(1.西安医学院第二附属医院中心实验室,陕西 西安 710038;2.苏州大学医学部法医系,江苏 苏州 215123;3.第四军医大学生理学教研室,陕西 西安 710032;4.西安医学院第二附属医院神经外科,陕西 西安 710038;5.苏州市立医院北区妇产科,江苏 苏州 215008)
于 军,E-mail:pclamper@163.com
R743.34
A
