氯虫苯甲酰胺在果蔗及其土壤中残留分析方法
2016-12-17杨玉霞莫仁甫周其峰王天顺劳水兵
杨玉霞,莫仁甫,周其峰 ,王天顺,劳水兵*
(1.广西农业科学院农产品质量安全与检测技术研究所,广西 南宁 530007;2农业部甘蔗品质监督检验测试中心,广西 南宁 530007)
氯虫苯甲酰胺在果蔗及其土壤中残留分析方法
杨玉霞1,2,莫仁甫1,2,周其峰1,2,王天顺1,2,劳水兵1,2*
(1.广西农业科学院农产品质量安全与检测技术研究所,广西 南宁 530007;2农业部甘蔗品质监督检验测试中心,广西 南宁 530007)
建立氯虫苯甲酰胺在果蔗及其土壤中残留的气相色谱检测方法。样品经乙腈提取后,转化为IN-EQW78,经萃取Florisil固相萃取柱净化,GC-μECD检测。结果表明:氯虫苯甲酰胺在0.01~1.00 μg/mL浓度范围内与峰面积有良好的线性关系,相关系数为0.9999。在添加浓度为0.02~2.00 mg/kg时,蔗茎氯虫苯甲酰胺回收率为83.36 %~111.63 %,相对标准偏差为6.57 %~8.77 %;蔗叶回收率为88.33 %~113.10 %,相对标准偏差为5.38 %~7.83 %;土壤回收率为91.04 %~97.84 %,相对标准偏差为3.67 %~7.75 %。氯虫苯甲酰胺在3种基质中的最小检出量 (LOD) 均为1.083×10-12g,最低检测浓度 (LOQ) 均为0.003 mg/kg。该方法灵敏度高,精密度和回收率好,杂质干扰少,成本低,满足农药残留测定方法要求。
果蔗;土壤;氯虫苯甲酰胺;气相色谱法;农药残留
氯虫苯甲酰胺(chlorantraniliprole)商品名康宽,是由美国杜邦公司开发的首个具有新型邻酰胺基苯甲酰胺类化学结构的广谱杀虫剂,已在中国获准登记并广泛用于蔬菜、水果和粮食作物的虫害防治[1]。该药对稻纵卷叶螟、二化螟、三化螟、大螟,小菜蛾、斜纹夜蛾、甜菜夜蛾、豆荚螟、玉米螟、稻象甲、稻水象甲有很好的防治效果,且该药对鱼虾、蜜蜂及害虫天敌等基本没有伤害[2]。目前关于氯虫苯甲酰胺的检测分析方法主要有高效液相色谱法[3-6]和液-质联用法[7-12]。印度的Ramasubramanian等[13]及Sharma等[14]报道了氯虫苯甲酰胺在甘蔗中的残留液相色谱-串联质谱检测方法,并对其使用后的安全性进行了评价,但其前处理方法过于繁琐,且液相色谱-串联质谱为大型昂贵仪器,其中高效液相色谱法需消耗大量有机溶剂,且耗时长。尚未见关于氯虫苯甲酰胺在果蔗及其土壤中残留的气相色谱分析方法公开报道。本研究采用乙腈浸泡提取,经二氯甲烷液-液萃取后,样品进行转化即将氯虫苯甲酰胺转化为可气相色谱μECD检测的代谢物IN-EQW78(即氯虫苯甲酰胺脱去羟基),之后再萃取,最后用Florisil小柱净化后供GC-μECD进行定量测定,应用本方法对200 g/L氯虫苯甲酰胺悬浮剂在广西南宁果蔗和土壤的田间试验样品(2014年)进行了测定。该方法具有灵敏度高、重复性好,杂质干扰少,成本低的特点,所使用仪器为气相色谱仪,可为果蔗及其土壤中氯虫苯甲酰胺的残留检测提供重要的方法参考。
1 材料与方法
1.1 仪器设备
气相色谱仪:Agilent 7890A GC,Agilent 7693自动进样器,带EPC控制的微电子捕获检测器(μECD);HY-5型直供回旋式振荡器(金坛宏凯仪器厂),RE-52AA型旋转蒸发器(上海亚荣生化仪器厂),SE812J型氮吹仪带数控恒温水浴锅(北京帅恩科技有限责任公司),LD5-2A型低速离心机(北京京立离心机有限公司);DS-1型高速组织捣碎机(上海标本模型厂);VORTEX-5型涡旋混合器(海门市其林贝尔仪器制造有限公司);KQ3200DB型数控超声清洗器(昆山市超声仪器有限公司);固相萃取仪VISIPREPTMDL(SUPELCO),Florisil固相萃取柱(1000 mg/6mL)(上海安谱科学仪器公司)。
1.2 试验材料
供试农药:200 g/L氯虫苯甲酰胺悬浮剂(美国杜邦贸易上海有限公司);试验作物:黑皮果蔗(Badila)(广西农科院甘蔗研究所试验场);化学试剂:正己烷,乙酸乙酯,二氯甲烷,正己烷,乙腈,以上溶剂均为分析纯且经重蒸处理;冰醋酸;无水硫酸镁;饱和氯化钠水溶液;洗脱液正己烷:乙酸乙酯=3∶1(v/v);二次蒸馏水;无水硫酸镁、无水硫酸钠 (分析纯,650 ℃烘烤4 h,于干燥器中保存备用)。标准品:氯虫苯甲酰胺标准品:纯度99.5 %(德国Dr. Ehrenstorfer GmbH公司);IN-EQW78标准品:纯度99.7 %(美国杜邦贸易上海有限公司)。
1.3 方法
1.3.1 样品前处理 ①植株样品提取。准确称取待测植物样品(蔗茎、蔗叶)10.0 g置于250 mL具塞三角瓶中,加入乙腈40 mL,加塞机械振荡浸泡过夜后,加入2.0 g NaCl机械振荡30 min,取上清加入无水MgSO41.0 g继续摇振荡30 min。吸取20 mL乙腈至100 mL聚四氟乙烯离心管,加入60 mL蒸馏水,5 mL 饱和醋酸铅,摇匀后静置30 min,待色素沉淀完全后加入5 mL 5 %冰乙酸,平衡后以3500 r/min离心5 min,将上清液转移到250 mL分液漏斗。向离心管继续加20 mL蒸馏水,用玻棒搅拌贴壁沉淀,超声处理5 min,以3500 r/min离心5 min,合并上清液于250 mL分液漏斗中,然后用二氯甲烷30、20、20 mL 3次萃取,弃去水相,有机层经少量无水硫酸钠脱水后合并。40 ℃下在旋转蒸发器上减压浓缩干,待转化。②植株样品转化。向浓缩干的圆底烧瓶中加入1 mL乙腈,5 mL 0.15 %氨水,在75 ℃水浴锅中转化2.5 h,期间每隔半小时摇晃一次,自然冷却后,将转化液倒入20 mL具塞试管,并加入1 mL饱和NaCl,取9 mL乙酸乙酯分3次转移,转移液于试管。涡旋3 min后,静置分层,用滴管小心移出上层乙酸乙酯于圆底烧瓶中,继续向试管加入8 mL乙酸乙酯,分两次加入试管,涡旋3 min,移出上层乙酸乙酯于圆底烧瓶中,在旋转蒸发仪上50 ℃浓缩至4 mL左右,氮气吹至2 mL。③植株样品净化。用6 mL洗脱液、6 mL正己烷预淋洗Frolisil柱。 将浓缩液上至Frolisil柱上,弃去流出溶液。 加入2 mL正己烷、6 mL洗脱液冲洗圆底烧瓶并淋洗小柱,将淋洗液接收至试管中。氮气吹干,用乙腈定容至2.5 mL,待气相色谱进行检测。④土壤样品的提取。称土壤样品10.0 g置于250 mL具塞三角烧瓶中,加入乙腈40 mL,加塞后机械振荡浸泡过夜,之后吸取上清液20mL于150 mL三角瓶,浓缩干后进行转化。⑤土壤样品的转化和净化。土壤样品转化及净化的方法同植株②和③。
1.3.2 色谱条件 检测器:μECD,色谱柱:HP-5MS,15 m ×0.32 mm ×0.25 μm 石英毛细管柱。柱温:初温180 ℃,保持1 min,以20 ℃/min 的速率升至270 ℃, 保持0 min,以10 ℃/min 的速率升至300 ℃,保持5 min;载气(N2) 流速:2.5 mL/min。进样口温度:300 ℃,压力:9.6805 psi;检测器温度:300 ℃,尾吹(N2)流速:25 mL/min;进样方式:不分流进样;进样体积:1 μl;定量方式:外标法峰面积标准曲线定量;氯虫苯甲酰胺代谢物(IN-EQW78)相对保留时间为8.27~8.35 min。
1.4 田间试验方法
1.4.1 田间试验设计 按 NY/T 788-2004《农药残留试验准则》要求设计试验小区,在广西南宁进行消解动态试验。试验均设空白对照区、消解动态试验区,每个处理设 3 次重复。
1.4.2 消解动态试验 土壤消解动态试验。小区面积30 m2,每个处理设3个平行小区,另设30 m2空白对照。施药剂量:150 gai/hm2(制剂0.3 kg/666.7m2)。施药方式为将参试药剂稀释液于与果蔗生长初期同期地面均匀喷雾, 共喷施1次,采用一次施药多次采样的方法,采样距施药间隔期设为药后2 h、1、3、7、14、21、30、60、90、120、150、180 d。在随机的8个以上采样点用土钻取0~10 cm的地表土2 kg以上,在不锈钢盆中除去碎石、杂草和植物根茎等杂物,将采集的土壤残留样本装入样本容器中包扎妥当贴好标签。
作物消解动态试验。小区面积30 m2,每个处理设3个平行小区,另设30 m2空白对照。施药剂量120 gai/hm2(制剂0.3 kg/666.7m2),方式为叶面喷施,采用一次施药多次采样的方法,采样距施药间隔期设为药后2 h、1、3、7、14、21、30、60、90、120、150、180 d。在作物消解动态试验小区中采用五点取样法截取距土表20 cm以上果蔗植株,取蔗茎(上中下部位各取1节切碎)约1 kg,样品采集后包扎妥当贴好标签。
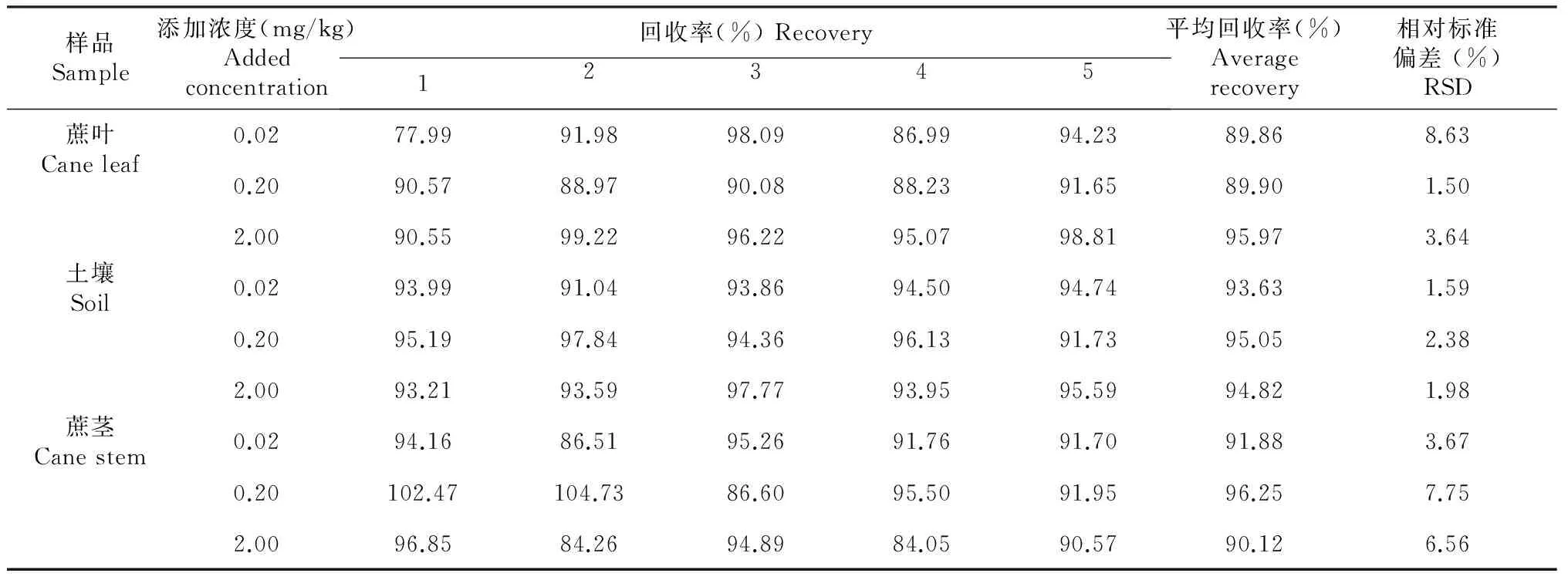
表1 氯虫苯甲酰胺在蔗茎和蔗叶中的添加浓度及回收率
2 结果与分析
2.1 分析方法的线性及相关性
从IN-EQW78 1.0 mg/mL标准乙腈贮备液,用乙腈配成0.01、0.05、0.10、0.50、1.00 μg/mL的标准系列在色谱仪上进样1 μl,得各浓度对应的峰面积,由峰面积(Y)对标样的质量(X)作相关曲线,其线性回归方程为Y=154348X-191.35,相关系数R2=0.9999,线性范围1.0×10-12~1.0×10-9g。
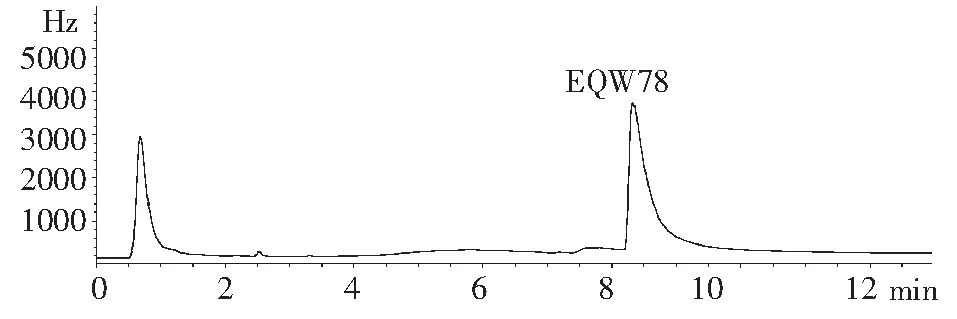
图1 IN-EWQ78标样色谱图Fig.1 Gas chromatograph of in IN-EWQ78 standard sample
2.2 分析方法的准确度和精密度
准确称取空白样品(果蔗植株,土壤)10.0 g,分别添加0.02、0.20、2.00 mg/kg的氯虫苯甲酰胺3个浓度,每档浓度重复5次,3个空白对照,按以上方法检测,结果见表1。测定结果表明:当添加浓度为0.02~2.00 mg/kg时,蔗叶回收率为77.99 %~99.22 %,相对标准偏差为1.50 %~8.63 %;蔗茎回收率为84.05 %~104.73 %,相对标准偏差为3.67 %~7.75 %;土壤回收率为91.04 %~97.84 %,相对标准偏差为3.67 %~7.75 %。准确度和精确度均符合农药残留分析的要求。相关谱图见图1~7。
2.3 方法的最小检出量和样品最低检出浓度
本方法的最小检出限以仪器基线噪3倍所对应的浓度值计算,最低检出浓度以仪器基线噪声10倍所对应的浓度值计算。最小检出量:1.083×10-12g;最低检测浓度:氯虫苯甲酰胺在果蔗植株最低检测浓度为0.003 mg/kg。
2.4 样品检测
采用本方法对200 g/L氯虫苯甲酰胺悬浮剂在广西南宁果蔗上的残留田间试验样品(2014年)进行了测定。在消解动态试验小区,施药1次,以制剂120 gai/hm2喷施于果蔗叶面,于施药后不同时间(0~180 d)采样,另设空白对照[15]。

图2 IN-EWQ78蔗叶空白样品色谱图Fig.2 Gas chromatograms of a blank chewing cane leaf sample
图3 IN-EWQ78蔗叶添加样品色谱图Fig.3 Gas chromatograph of IN-EWQ78 in added chewing cane leaf sample

图4 IN-EWQ78蔗茎空白样品色谱图Fig.4 Gas chromatograph of a blank chewing cane stem sample

图5 IN-EWQ78蔗茎添加样品色谱图Fig.5 Gas chromatograph of IN-EWQ78 in added chewing cane stem sample
蔗茎中氯虫苯甲酰胺未检出,即氯虫苯甲酰胺的检出量均低于其检出限0.001 mg/kg。蔗叶和土壤中氯虫苯甲酰胺消解动态符合化学反应一级动力学方程:C=Coe-kt。氯虫苯甲酰胺悬浮剂2014年广西南宁在蔗叶中的原始沉积量为5.879 mg/kg, 消解方程为C=2.9718e-0.0486t,半衰期为14.3 d,相关系数为0.8750,药后150 d降解率为99.91 %;土壤中的原始沉积量为1.072 mg/kg, 消解方程为C=0.5385e-0.0199t,半衰期为34.8 d,相关系数为0.8109,药后150 d降解率为93.29 %。
3 结论与讨论
本研究建立了果蔗及其土壤中氯虫苯甲酰胺残留气相色谱检测方法。采用乙腈浸泡提取,经二氯甲烷液-液萃取后,样品进行转化即将氯虫苯甲酰胺转化为可气相色谱μECD检测的代谢物IN-EQW78,之后再萃取,最后用Florisil小柱净化后供GC-μECD进行定量测定,并运用本方法对200 g/L 氯虫苯甲酰胺悬浮剂在广西南宁果蔗和土壤田间试验样品(2014年)进行了测定。该方法氯虫苯甲酰胺在3种基质中的最小检出量 (LOD) 均为1.083×10-12g,最低检测浓度 (LOQ) 均为0.003 mg/kg,具有分离效果好,检测用时短,检测的灵敏度和准确度高的特点,能满足国内外相关农药残留分析的要求,能够满足我国制定的甘蔗上氯虫苯甲酰胺临时的最大残留限量值0.05 mg/kg[16]的要求,也达到美国环保署规定氯虫苯甲酰胺在甘蔗中的残留许可限量制定的最大残留限量值0.2 mg/kg 和日本的14 mg/kg的要求[17]。
图6 IN-EWQ78土壤空白样品色谱图Fig.6 Gas chromatograph of a blank soil sample
图7 IN-EWQ78土壤空白样品加标色谱图Fig.7 Gas chromatograph of IN-EWQ78 in added soil sample
[1]郑雪松,赖添财,时立波,等.双酰胺类杀虫剂应用现状[J]. 农药,2012,51(8):554-557,580.
[2]杨世常,夏银果, 陈寿宏, 等.20%康宽悬浮剂防治甘蔗螟虫田间药效试验总结[J].甘蔗糖业,2010,7(2):14-19.
[3]Kar A,Mandal K,Singh B.Decontamination of Chlorantraniliprole Residues on Cabbage and Cauliflower through Household Processing Methods[J]. Bull Environ Contam Toxicol,2012,88:501-506.
[4]秦冬梅,秦 旭,徐应明,等.土壤和番茄中氯虫苯甲酰胺的残留检测与消解动态研究[J]. 农业环境科学学报,2010,29 (5):858-863.
[5]XU Pengjun,REN Yue,ZHOU Zhiguang, et al. Determination of chlorantraniliprole in vegetables, fruits and grains by SPE clean-up and LC-UV[J]. Chromatographia,2010, 72(7-8):763-766.
[6]Malhat F M.Determination of Chlorantraniliprole Residues in Grape by High-Performance Liquid Chromatography[J]. Food Anal. Methods ,2012(5):1492-1496.
[7]陈小军,王 萌,范淑琴,等. QuEChERS 前处理结合UPLC-MS /MS 法分析氯虫苯甲酰胺在甘蓝和土壤中的残留[J]. 中国农业科学,2012,45(13):2636-2647.
[8]朱建华,赵 莉. 液相色谱串联质谱法测定果蔬中的唑虫酰胺、氟啶虫酰胺、氯虫苯甲酰胺及氟虫双酰胺残留[J]. 分析测试学报,2011,30(6):646-650.
[9]SCHWARZ T,SNOW T A,SANTEE C J,et al. QuEChERS multiresidue method validation and mass spectrometric assessment for the novel anthranilic diamide insecticides chlorantraniliprole and cyantraniliprole[J].J Agric Food Chem,2011,59(3):814-821.
[10]钱鸣蓉,章 虎,吴俐勤,等.高效液相色谱-串联质谱法测定蔬菜中氯虫苯甲酰胺和氟虫双酰胺残留[J]. 分析化学,2010,38(5):702-706.
[11]CABONI P,SARAIS G,ANGIONI A, et al.Liquid chromatographytandem mass spectrometric ion-switching determination of chlorantraniliprole and flubendiamide in fruits and vegetable [J].Agric Food Chem,2008,56(17):7696-7699.
[12]DONG Fengshou,XU Jun,LIU Xingang,et al. Determination of chlorantraniliprole residues in corn and soil by UPLC-ESI-MS /MS and its application to a pharmacokinetic study [J].Chromatographia, 2011,74(5-6):399-406.
[13]RAMASUBRAMANIAN T, PARAMASIVAM M, SALIN K P, e tal. Dissipation kinetics of chlorantraniliprole in soils of sugarcane ecosystem [J]. Bull Environ Contam Toxicol, 2012, 89(6):1268-1271.
[14]GRANT J. 2006 Stability of DPX-E2Y45 in representative cropsstored frozen. E. I. du Pont de Nemours and Company. DuPont Report No. Du Pont-12985 [DB/OL](2010-01-28)[2015-10-25]. //MACLACHLAN D. Chlorantraniliprole (230).
[15]中华人民共和国农业部. 农药残留试验准则:NY/T 788-2004[S]. 北京:中国农业出版社, 2004.
[16]中华人民共和国卫生部. GB 2763-2014. 食品中农药最大残留限量[S]. 北京:中国标准出版社, 2014.
[17]Notice of Filing of a Pesticide Petition for the Establishment of Tolerances for Residues of Chlorantraniliprole in or on Food Commodities AGENCY:Environmental Protection Agency (EPA), 2008 .
(责任编辑 温国泉)
Analytical Method of Chlorantraniliprole Residues in Chewing Cane and Soil
YANG Yu-xia1,2,MO Ren-fu1,2, ZHOU Qi-feng1,2, WANG Tian-shun1,2, LAO Shui-bing1,2*
(1. Research Institute of Agro-products Quality Safety and Testing Technology, Guangxi Academy of Agriculture Sciences,Guangxi Nanning 530007,China; 2. Quality Supervision and Testing center for Sugarcane, China Ministry of Agriculture, Guangxi Nanning 530007,China)
An analytical method for determining chlorantraniliprole residues in chewing cane and soil by gas chromatography-μ electron capture detector (GC-μECD) was established. Samples were extracted with acetonitrile, and transformation to IN-EQW78, cleaned up with florisil column and then determined by GC-μECD. The results showed that the pea area with concentration of chlorantraniliprole had good linear relationship in the range of 0.01-1.00 μg/mL with the correlation coefficients 0.9999. The recovery spike at 3 levels from 0.02 to 2.00 mg/kg in chewing cane stem, leaf and soil were ranged from 83.36 % to 111.63 %, with coefficients of variation from 3.67 % to 8.77 %. The limit of detection (LOD) of the method was 1.083×10-12g and the limit of quantification (LOQ) was 0.003 mg/kg for all these matrices. The method was sensitive, accurate, the demand for epuipment and reliable to determinate the residue of chlorantraniliprole residues in chewing cane and soil.
Chewing cane; Soil; Chlorantraniliprole; Gas chromatography; Residue
1001-4829(2016)11-2643-05
10.16213/j.cnki.scjas.2016.11.024
2016-08-03
广西农科院科技发展基金青年专项(桂农科2014JQ 16);广西农科院基本科研业务费重点项目(桂农科2014YZ25);广西农科院基本科研业务费团队项目(桂农科 2015YZ93);国家自然科学基金地区面上项目(21567007);广西农科院科技发展基金重点项目(桂农科 2016JZ12)
杨玉霞(1981-),女,河南商丘人,助理研究员,硕士,主要从事农药残留分析及其安全评价工作,*为通讯作者,E-mail:shuibinglao@163.com。
S566.1
A
