晚期非小细胞肺癌自体T细胞过继免疫治疗后T细胞受体变化
2016-12-17吕晓鹏黄京子
冯 燕 吕晓鹏 黄京子 冯 刚
(吉化集团公司总医院 北华大学第二附属医院肿瘤内科,吉林 吉林 132022)
·肿 瘤·
晚期非小细胞肺癌自体T细胞过继免疫治疗后T细胞受体变化
冯 燕 吕晓鹏 黄京子 冯 刚1
(吉化集团公司总医院 北华大学第二附属医院肿瘤内科,吉林 吉林 132022)
目的 探讨肺癌患者经自体T细胞过继在治疗后T细胞受体(TCR)的变化特征及临床意义。方法 用分子生物学方法对晚期非小细胞肺癌放化疗结合细胞治疗的患者,免疫细胞治疗前和治疗3个疗程结束后检测TCR表达的变化分析。结果 21例患者中的12例在CD4+TCR基因家族中产生克隆化改变,而这种改变发生在CD8+TCR基因家族有16例。结论 外周血TCR克隆化分析可能成为自体T细胞过继免疫治疗的疗效评价指标。
肺癌;T细胞过继免疫治疗;T细胞受体
虽然近年自体T细胞过继免疫治疗技术取得了长足的发展,但由于缺乏客观评价方法,导致体外培养的细胞不能被有效地质控监测,回输至患者体内后疗效又不能被准确和及时地评价,从而阻碍了这项新技术规范化与标准化的实施。本文拟通过观察晚期非小细胞肺癌(NSCLC)患者接受自体T细胞过继免疫治疗前后T细胞受体(TCR)克隆化变化,探讨肺癌患者自体T细胞过继免疫治疗后的疗效。
1 材料与方法
1.1 一般资料 选取2013年3月至2015年8月在我院接受化放疗的晚期(NSCLC)患者43例,男32例,女11例,年龄48~76岁,中位年龄66岁,腺癌25例,鳞癌18例,卡氏评分(KPS)≥60分。所有病人治疗前综合免疫功能分析与评价,按照免疫功能分两组,治疗组21例,予化放疗+细胞治疗;对照组22例,予化放疗。
1.2 治疗方法 化、放疗均按NCCN指南要求规范进行,化疗:采用DP方案。放疗:ⅢB期病人于化疗前施行,采用CT模拟定位,以95%PTV作为处方剂量线,60 Gy/30次。细胞治疗:于化疗前采血,距前一个周期化疗间隔2 w及以上,每例患者接受3个疗程的细胞免疫治疗,所有患者在接受自体T细胞过继免疫治疗前和3个疗程结束后2 w进行T淋巴细胞亚群及TCRVβ 克隆化定性及定量检测。
1.3 仪器设备及方法
1.3.1 外周血单个核细胞的分离 采集患者静脉血80 ml,用聚蔗糖400(Lympholyte-H,Cedarlane产品)分离单个核细胞(PBMCs),经生理盐水洗涤细胞3次后备用。
1.3.2 DC细胞的分离及体外培养 PBMCs悬浮于DC培养基后,在培养皿内37℃ 贴壁培养3 h,悬浮细胞用于T细胞培养,贴壁细胞培养于DC培养基中并添加GM-CSF 1 000 U/ml和白细胞介素(IL)-4 1 000 U/ml,培养第4天添加相应肿瘤抗原提取物,培养第5天添加肿瘤坏死因子(TNF)-α1 ng/ml,培养第7天后对DC细胞表型(CD80/CD83/CD86/HLA-DR)进行检测,微生物及内毒素检验合格后收集DC,按方案回输至患者皮下。
1.3.3 T细胞的体外培养和扩增 将贴壁处理后的悬浮细胞用T细胞培养基悬浮并调细胞密度为2×106/ml,添加IL-2 1 000 U/ml、CD3McAb 50 ng/ml。此后每2 d计数细胞并适当补充新鲜培养基。分别在培养的第10、12、14天进行细胞表型、微生物及内毒素检测,各项指标符合要求后收集T细胞、洗涤,按方案回输至患者静脉内。
1.3.4 细胞表型及淋巴细胞亚群分析 采用流式细胞术分析DC细胞及淋巴细胞表型,所有荧光标记的流式细胞抗体均购自美国BD公司,细胞表面标记分析和细胞内标记分析按说明书操作。
1.4 TCR多样性分析 采集静脉血5 ml,常规法分离PBMC,用磁珠法(invitrogen)分选CD4+和CD8+T细胞,分别提取总RNA (Qiangen),将各总RNA按TCR检测Kit(北京爱根生物科技公司)说明书分别进行RT-PCR和巢式PCR扩增,采用ABI3730 DNA 分析仪(美国ABI公司)分析扩增产物的长度多样性,以GeneMapper软件做可视化数据分析。
1.5 统计学分析 采用SPSS17.0软件行单因素分析。
2 结 果
2.1 临床指标变化 治疗组中位无进展生存(PFS)为6.8个月,明显高于对照组4.5个月(P<0.05)。治疗组1年生存率(85%),明显高于对照组(50%,P<0.05)。
2.2 T淋巴细胞亚群变化 治疗组治疗后总T淋巴细胞普遍升高,升高比率为76.2%,CD4+T淋巴细胞升高比率为71.4%,CD8+T淋巴细胞亚群比率升高者66.7%,与对照组比较均有统计学意义。
2.3 TCR Vβ表达变化
2.3.1 TCR Vβ多态性的恢复 在治疗组21例患者中,14例病人TCR Vβ出现多态性的恢复,典型的TCRVβ多态性的恢复如图1、图2所示。

图1 病人001接受自体T细胞过继治疗后TCRVβ多样化渐变
2.3.2 TCR Vβ克隆化产生 12例CD4TCRVβ在治疗后发生克隆化保持或渐变,其中67%(8/12)CD4TCRVβ克隆化发生在14、16亚家族,16例CD8TCRVβ在治疗后发生克隆化保持或渐变,而75%(12/16)CD8TCRVβ克隆化发生在1、4、7、11、17亚家族。典型的TCRVβ克隆化渐变,见图3、图4。

图2 病人002接受自体T细胞过继治疗后TCRVβ多样化渐变
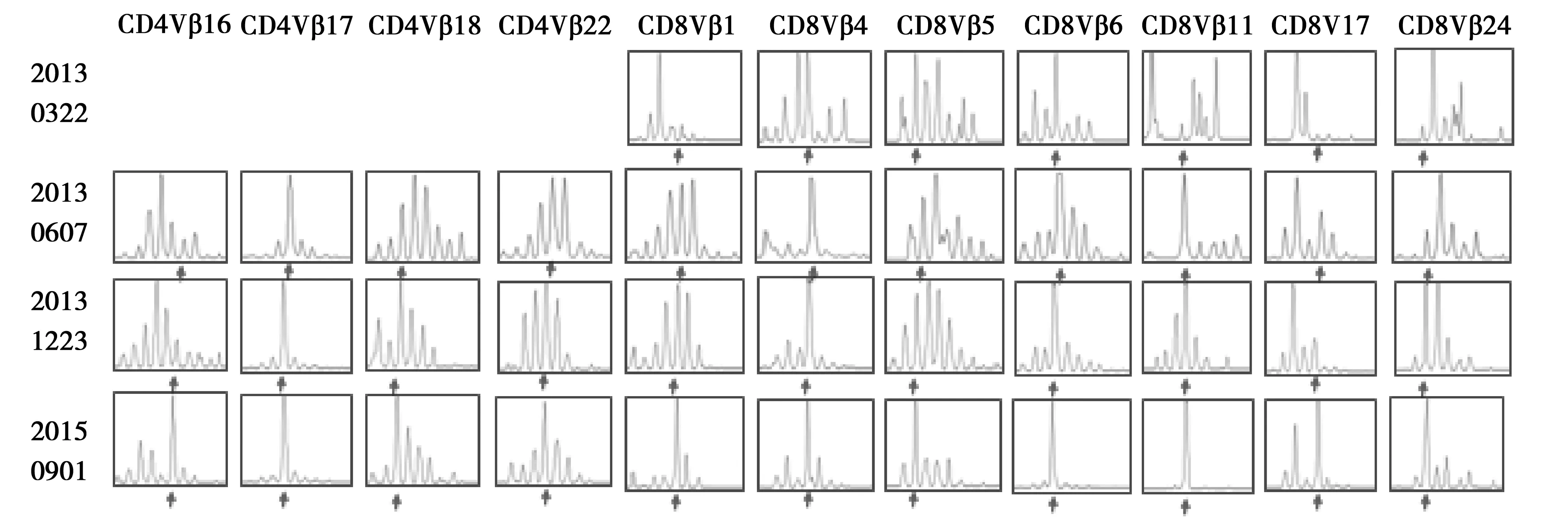
图3 病人003接受自体T细胞过继治疗后TCRVβ克隆化渐变

图4 病人004接受自体T细胞过继治疗后TCRVβ克隆化渐变
3 讨 论
肿瘤的发生发展与免疫相关,但病人体内肿瘤的减小或消失,并不是简单由T细胞的免疫活性高低或免疫应答反应的强弱来决定的,而与复杂的分子免疫学因素有关。多项最新研究发现:T细胞免疫治疗引起人体内肿瘤的减小或消失的主要因素是克隆化的TCR。英国伦敦大学在2007年发表一篇综述文章题为“单克隆T细胞受体基因:新的癌症治疗试剂”,此文章重点阐述了克隆化的TCR在免疫治疗中的作用。美国西雅图Fred Hutchinson 癌症研究中心 2008年在新英格兰医学杂志 (NEMJ)发表了一篇“肿瘤自体免疫细胞治疗”的文章指出,在T细胞免疫治疗中起主导作用的是那些克隆化的T细胞。研究还发现,TCR克隆化的程度和这些克隆T细胞在病人体内存留的时间长短,也是免疫治疗成败的关键〔1〕。
TCR是T细胞表面识别并结合抗原的分子。95%的TCR 是由α和β多肽链组成的异二聚体〔2〕。TCR多样性检测技术是基于TCRβ链CDR3区序列长度的多态性,利用RT-PCR技术和GeneScan扫描技术从RNA水平研究TCRβ链CDR3(TCR Vβ)谱型进而分析T细胞克隆组分的方法,通过分析不同峰图可以了解T细胞在不同疾病、同一种疾病的不同阶段,或不同因素作用后克隆增生的动态变化趋势。在正常人,TCR Vβ谱型多呈近似正态Gaussian分布,而在一些感染性疾病、自身免疫病及肿瘤等状态下,由于抗原持续的刺激导致其TCRVβ谱型发生明显变化〔3〕。本研究结果说明,自体T细胞过继治疗可以提高患者的肿瘤抗原特异性T细胞克隆化,而肿瘤抗原特异性T细胞克隆化增殖的程度越高患者的生存就越长〔4~7〕。另外,本研究中许多Vβ出现多样化渐变,说明成功的免疫治疗以后可引起TCR多态性的恢复,达到免疫重建的效果〔8,9〕。
过继性免疫治疗是肿瘤生物治疗的方法之一。本研究结果提示,T淋巴细胞亚群比例以及TCRVβ克隆化、多样化动态分析可以用于自体T细胞过继免疫治疗的多个环节,但只是对自体细胞免疫治疗评价方法的初级体验,如何确立和科学运用这些评价方法等还需深入研究。
1 Hunden NN,Wallen H,Cao J,etal.Treatment of metastatic melanoma with autologous CD4+ T cells against NY-ESO-1〔J〕.New Engl J Med,2008;358(25):2698-703.
2 姜 明,周则卫,张 浩,等.T细胞受体多态性与疾病的关系〔J〕.现代免疫学,2013;33(3):247-51.
3 Iwauchi T,Tanaka H,Yamazoe S,etal.Identification of HLA-A*2402-restricted epitope peptide derived from ERas oncogene expressed in human scirrhous gastric cancer〔J〕.Cancer Sci,2011;102(4):683-9.
4 Chapuis AG,Thompson JA,Margolin KA,etal.Transferred melanoma-specific CD8+ T cells persist,mediate tumor regression,and acquire central memory phenotype〔J〕.Proc Natl Acad USA,2012;109(12):4592-7.
5 Dudley ME.Cancer regression and autoimmunity in patients after clonal repopulation with antitumor lymphocytes〔J〕.Science,2002;298(5594):850-4.
6 Stauss HJ,Cesco-Gaspere M,Thomas S,etal.Monoclonal T-cell receptors:new reagents for cancer therapy〔J〕.Mol Ther,2007;15(10):1744-50.
7 Muranski M,Restifo NP.Adoptive immunotherapy of cancer using CD4+ T cells〔J〕.Curr Opin Immunol,2009;21(2):200-8.
8 Kou ZC,Puhr JS,Wu SS,etal.Combination antiretroviral therapy results in a rapid increase in T cell receptor variable region beta repertoire diversity within CD45RA CD8 T cells in human immunodeficiency virus-infected children〔J〕.J Infect Dis,2003;187(3):385-97.
9 Luo W,Liao WJ,Huang YT,etal.Normalization of T cell recept repertoire diversity in patients with advanced colorectal cancer who responded to chemotherapy〔J〕.Cancer Sci,2011;102(4):706-12.
〔2015-12-17修回〕
(编辑 袁左鸣)
吉林省卫生计生委卫生科研课题立项计划(2013Z085)
冯 刚(1960-),男,副主任技师,主要从事肿瘤检测技术研究。
冯 燕(1970-),女,主任医师,硕士,主要从事肿瘤内科治疗及细胞免疫治疗研究。
R730.3;R734.2
A
1005-9202(2016)22-5606-03;
10.3969/j.issn.1005-9202.2016.22.050
1 吉化集团公司总医院 北华大学第二附属医院检验科
