藜蒿黄酮对SMMC7721生长抑制作用及其与缺氧诱导因子-1α表达的关系
2016-12-17王丽丽谢荣辉邬亚华张义平殷嫦嫦
王丽丽 谢荣辉 邬亚华 张义平 曹 俊 殷嫦嫦
(九江学院基础医学院,江西 九江 332000)
藜蒿黄酮对SMMC7721生长抑制作用及其与缺氧诱导因子-1α表达的关系
王丽丽 谢荣辉1邬亚华 张义平 曹 俊 殷嫦嫦
(九江学院基础医学院,江西 九江 332000)
目的 探讨藜蒿黄酮对人肝癌细胞株SMMC7721的抑制作用,并观察其与缺氧诱导因子(HIF)-1α表达的关系。方法 实验分组:阴性对照组、槲皮素组、藜蒿黄酮组;CCK-8法检测各组细胞的生长抑制作用;用流式细胞仪检测各组细胞凋亡情况;RT-PCR检测各组HIF-1α表达。结果 与阴性对照组比较,藜蒿黄酮能明显抑制SMMC7721细胞的生长、诱导细胞凋亡,呈时间、剂量依赖性(P<0.05),IC50为345 μg/ml;RT-PCR结果显示藜蒿黄酮组HIF-α表达明显下调。结论 藜蒿黄酮能抑制SMMC7721细胞的生长、诱导其凋亡,其机制可能与HIF-1α表达下调有关。
藜蒿黄酮;SMMC7721;缺氧诱导因子;细胞凋亡
缺氧是实体肿瘤微环境的基本特征之一〔1〕,能够引起肿瘤细胞的一些基因表达发生改变,导致组织供血、供氧和供能的增加,促进肿瘤的生长、血管形成、转移。而这些基因表达的改变是由缺氧诱导因子(HIF)-1α这种在缺氧条件下广泛存在于哺乳动物及人体的一种转录因子所调控的〔2,3〕。因此,在抗肿瘤治疗及其辅助治疗中,寻找HIF-1α的抑制性物质是当前研究的热点。生长于鄱阳湖畔的藜蒿是一种草本植物,其鲜嫩茎杆和肉质茎均为本地百姓“饭桌上的宝”,藜蒿中含有黄酮化合物,研究表明植物黄酮具有多种生物活性〔4〕,如降血糖血脂、抗心律失常、抗人类获得性免疫缺陷病毒(HIV)、抗自由基、抗氧化、抗抑郁、抗肿瘤〔5~10〕等。我们前期研究证实:藜蒿黄酮粗提物对肝癌细胞株SMMC7721的生长有抑制作用〔11〕,为了进一步研究藜蒿黄酮对肝癌细胞的作用,我们将藜蒿黄酮粗提物进行了初步纯化,将纯化后的黄酮作用于SMMC7721,观察其抑制SMMC7721作用及与HIF-1α表达的关系。
1 材料与方法
1.1 药物、试剂及仪器 肝癌细胞株SMMC7721(南昌大学第一附属医院江西省消化疾病研究所);人正常肝细胞L-02(南京凯基生物科技发展有限公司);藜蒿(采摘于鄱阳湖畔);二甲基亚砜(DMSO)、0.25%胰蛋白酶、Annexin V-FITC凋亡检测试剂盒(Solarbio公司);缓冲液培养基(DMEM,Gbico公司);总RNA提取试剂盒(北京庄盟国际生物基因科技有限公司);胎牛血清、RT-PCR试剂(TransGen公司);流式细胞仪(BD公司);倒置相差显微镜(Nikon公司);CO2细胞培养箱、凝胶自动成像系统(SIM公司),超净工作台(苏州净化设备有限公司);引物由南京金斯瑞生物科技有限公司合成,HIF-1α上游引物:5'-TGCATCTCCATCTCCTACCC-3',下游引物:5'-TGGTCAGCTGTGGTAATCCA-3';GAPDH基因上游引物:5'-TGCATCTCCATCTCCTACCC-3',下游引物:5'-TGGTCAGCTGTGGTAATCCA-3'。
1.2 细胞增殖活力检测(CCK-8实验) 超声波辅助法提取藜蒿黄酮〔12,13〕,以聚酰胺纯化,并通过盐酸-镁粉还原反应进行鉴定后,选对数期生长的肝细胞(L-02)和肝癌SMMC7721细胞,以4 000/孔的浓度接种于96孔板中,常规培养,待细胞贴壁且生长良好。实验分L-02细胞和SMMC7721细胞两部分,各分3大组:阴性对照组、阳性对照组(终浓度为400 nmol/L的槲皮素)、藜蒿黄酮组(终浓度分别为62.5、125、250、500、1 000 μg/ml),每个浓度的药物均设药物空白对照孔。培养24 h,弃培养基,以PBS轻柔冲洗2次,每孔加入新鲜培养基200、10 μl CCK-8,分别培养2、4 h,以酶标仪检测450 nm处吸光度值A450,以仅加入培养基的培养孔作为空白孔进行调零,计算不同浓度藜蒿黄酮作用的增殖抑制率及半数抑制浓度(IC50)。
1.3 细胞凋亡流式检测 24孔培养板常规培养肝癌SMMC7721细胞,待生长良好后分4组:空白组、阴性对照组、阳性对照组(槲皮素组)及终浓度为345 μg/ml(即IC50浓度)的藜蒿黄酮组。于CO2培养箱培养24 h,消化细胞,调整细胞浓度为6×105/ml,取1 ml细胞悬液1 000 r/min,4℃离心10 min,弃上清;加入1 ml冷PBS重悬,同上操作并重复2次;再重悬于200 μl上样缓冲液中,加入10 μl Annexin V-FITC,避光室温反应15 min,加入10 μl PI和300 μl上样缓冲液。并快速用流式细胞仪进行结果分析。在检测时,我们将整个界面分为4个亚群:机械性损伤细胞、正常细胞、凋亡细胞和继发性坏死细胞。
1.4 RT-PCR检测HIF-1α 6孔培养板常规培养肝癌SMMC7721细胞,待生长良好后如上分四组,于CO2培养箱培养24 h,按RNA快速提取试剂盒说明提取RNA,并进行RNA纯度、完整性鉴定后,逆转录为cDNA,再经PCR扩增(内参为GAPDH基因)。使用SIM凝胶成像系统扫描分析并行相关基因相对于管家基因GAPDH的相对表达率半定量分析。
1.5 统计学方法 采用SPSS17.0软件进行单因素方差分析。
2 结 果
2.1 细胞增殖活力检测 利用CCK-8法检测不同浓度(62.5、125、250、500、1 000 μg/ml)藜蒿黄酮对肝L-02细胞、肝癌SMMC7721细胞的影响,见表1,各浓度藜蒿黄酮作用下的肝L-02细胞正常生长(P>0.05),无统计学意义;而肝癌SMMC7721细胞增殖活性均有所降低,且随作用浓度的增加,降低程度也有所增加,呈剂量-效应关系,500、1 000 μg/ml组与阴性对照组相比差异显著(P<0.01),250 μg/ml组与阴性对照组相比有统计学意义(P<0.05)。藜蒿黄酮作用24 h的半数抑制浓度(IC50)为345 μg/ml。
2.2 显微镜下可见 阴性对照组肝癌SMMC7721细胞生长明显增殖;各组正常肝细胞于加藜蒿黄酮前后无变化,细胞正常生长;各浓度组肝癌细胞的生长都出现抑制现象,呈浓度依赖性。500 μg/ml藜蒿黄酮在作用24 h,肝癌细胞生长出现明显抑制、细胞收缩变圆,还有一些细胞裂解,48 h,多数细胞已看不见完整的结构,周围出现细胞碎片;阳性对照组肝癌细胞在24 h细胞略有收缩,但不甚明显,48 h细胞大量变圆、裂解死亡,见图1。
2.3 藜蒿黄酮作用SMMC7721细胞24 h细胞收缩变圆,继而细胞裂解,整个过程未出现细胞体积变大和溶解,据此可初步说明藜蒿黄酮可诱导SMMC7721细胞凋亡。药物作用48 h藜蒿黄酮组(4.001)凋亡率为95.73%,阴性对照组(2.001)凋亡率为1.67%,而槲皮素组(3.001)凋亡细胞占28.37%,该结果进一步说明藜蒿黄酮有促进SMMC7721细胞凋亡的作用。
2.4 RT-PCR检测HIF-1α 实验各组RNA提取后,OD260/OD280为1.83,纯度较好;完整性鉴定的琼脂糖凝胶电泳结果可明显见两条带(28S、18S),逆转录后各组PCR电泳结果如图2。经琼脂糖电泳后,以HIF-1α与内参的灰度比求得各组相关mRNA相对表达量,可见藜蒿黄酮组(0.052 9±0.002 9)、阳性对照组(0.134 9±0.011 5)与阴性对照组(0.214 9±0.005 4)之间差异较大(P<0.05),说明藜蒿黄酮与槲皮素对HIF-1α的表达有抑制作用。空白组为0.217 7±0.008 2。
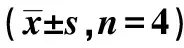
表1 藜蒿黄酮作用L-02、SMMC7721细胞24 h CCK-8检测吸光度(A值)比较
与阴性对照组比较:1)P<0.05,2)P<0.01

A:24 h SMCC7721;B:48 h SMCC7721;C:24 h L-02(500 μg/ml藜蒿黄酮);D:48 h L-02(500 μg/ml藜蒿黄酮);E:24 h SMMC7721(500 μg/ml藜蒿黄酮);F:48 h SMMC7721(500 μg/ml藜蒿黄酮);G:24 h SMMC7721(400 nmol/L槲皮素);H:48 h SMMC7721(400 nmol/L槲皮素)图1 藜蒿黄酮作用L-02、SMMC7721细胞24 h和48 h细胞形态学变化

M:Marker,1~4:藜蒿黄酮组、阳性对照组、阴性对照组、空白组图2 RT-PCR检测各组细胞HIF-1α mRNA表达
3 讨 论
MTT法是检测细胞增殖活性的常规方法〔14,15〕,但用该法检测藜蒿黄酮对SMMC7721增殖活性过程中,我们发现:藜蒿黄酮的吸光度波长峰值与MTT检测法的波长接近,再者MTT实验过程要完全弃去上清液,因此无法通过增设药物空白消除藜蒿黄酮本底的干扰,因此我们改用CCK-8法检测细胞增殖活性,该方法通过设置药物空白对照可消除药物本底的干扰。因此我们认为在研究黄酮对细胞增殖活性最好选用CCK-8方法或其他可设置药物空白实验方法。本研究结果显示:藜蒿黄酮能抑制肝癌SMMC7721细胞的增殖活性,呈时间、浓度依赖性,而对人正常肝细胞的生长有轻度抑制作用,但无统计学意义。
细胞凋亡是一种多基因严格控制的基本生物学现象,是细胞自主、有序的死亡,其常由单个细胞开始,先出现细胞体积的缩小、与周围细胞分离,然后细胞质聚集、细胞膜的通透性增加,但整个过程中,细胞膜的完整性很好,其与细胞坏死是有本质的区别的。坏死是一种无序变化的死亡,主要表现为细胞体积胀大、细胞膜破裂、内容物外溢,引起局部严重的炎症反应。本文结果可初步说明藜蒿黄酮可诱导及促进SMMC7721细胞凋亡,但仅从这两方面还不能完全说明藜蒿黄酮诱导SMMC7721细胞凋亡,在以后的研究中,我们将进行荧光染色观察细胞凋亡、DNA电泳、线粒体电位测定等方法进一步观察藜蒿黄酮诱导SMMC7721细胞凋亡作用。
HIF-1是一种转录因子,在肿瘤组织中广泛表达,能与缺氧反应元件结合,促进多种基因表达上调〔16〕,对维持肿瘤细胞的能量代谢、新生血管形成〔17,18〕、肿瘤侵袭和转移起到非常重要的作用〔19,20〕。HIF-1α作为HIF-1的一个重要亚基,其突出地位无可取代。本研究说明藜蒿黄酮及槲皮素能在转录水平抑制肝癌细胞株SMMC7721中HIF-1α基因表达,与相关文献报道相似〔21〕。HIF-1除了在肿瘤细胞耐受缺氧方面起重要作用外,还能调节肿瘤的凋亡〔22,23〕。有研究表明,HIF-1影响Survivin、bcl-2 mRNA及bax蛋白的表达,故推测,藜蒿黄酮可能通过抑制HIF-1α的表达,使Survivin和bcl-2 mRNA和蛋白质表达减少,而bax蛋白表达增高,进而达到抑制肝癌细胞增殖、促进其凋亡的目的。
尽管体外的细胞水平研究结果支持藜蒿黄酮具有抑制肝癌细胞增殖的作用,但其进入体内代谢后是否能保留其生物学活性,即在体内是否具有防治肝癌的作用还需通过血清药理学及建立肝癌动物模型进行进一步的研究。
1 Jean M.How cells endure low oxygen〔J〕?Science,2004;303(2):1454-6.
2 Knocke TH,Weitmann HD,Feldmann HJ,etal.Intratumoral pO2-measurements as predictive assay in the treatment of carcinoma of the uterine cervix〔J〕.Radiother Oncol,1999;53(2):99-104.
3 Vaupel Thews O,Kelleher DK,Konerding MA.O(2)extraction is a key parameter deternining the oxygenation status of malignant tumors and normal tissues〔J〕.Int J Oncol,2003;22(4):795-8.
4 邓丹雯,郑功源.藜蒿的营养保健功能及其产品开发〔J〕.江西食品工业,2001;3(3):18-9.
5 王开金,陈列忠,李 宁,等.加拿大一枝黄花黄酮类成分及抗氧化与自由基消除活性的研究〔J〕.中国药学杂志,2006;41(7):493-7.
6 Samir KS,Firoj A,Takashi Ohtsuki,etal.Flavonoids from sonnemtia easeolaris〔J〕.J Nat Med,2006;60(3):264-5.
7 黄富远,高 明,棱云雁.黄酮类化合物的研究概况〔J〕.中华中医药学刊,2007;25(8):1730-2.
8 李沛波,王永刚,吴钉红,等.田基黄中三个黄酮类化合物保肝退黄作用的实验研究〔J〕.中山大学学报(医学科学版),2007;28(1):40-3.
9 杜崇民,刘春宇.黄酮类化合物抗肿瘤研究进展〔J〕.中国野生植物资源,2007;26(3):4-7.
10 年进兴,董俊兴.抗HIV活性天然黄酮类化合物研究进展〔J〕.中国药学杂志,2005;加(8):571-3.
11 曹 俊,周许峰,刘可越,等.藜蒿黄酮粗提物对肝癌SMMC7721细胞生长的影响〔J〕.中国现代医药学杂志,2001;21(36):4497.
12 盛科女,王丽丽,殷嫦嫦,等超声波辅助法提取藜蒿黄酮研究〔J〕.九江学院学报,2012;27(1):62-3.
13 赖毅勤,周宏兵.近年来黄酮类化合物提取和分离方法研究进展〔J〕.食品与药品,2007;9(4A):54-8.
14 Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays〔J〕.J Immunol Methods,1983;65(1-2):55-63.
15 Engin Ulukaya,Mukaddes Colakogullari,Edward J.Interference by anti-cancer chemotherapeutic agents in the MTT-tumor chemosensitivity assay〔J〕.Chemotherapy,2004;50(1):43-50.
16 Semanza GL.Hypoxia-inducible factor 1:oxygen homeostasis and disease pathophysiology〔J〕.Trends Mol Med,2001;7(8):345-50.
17 Turuo T,Naito M,Tomida A,etal.Molecular targeting therapy of cancer:drug resistance,apoptosis and survival signal〔J〕.Cancer Sci,2003;94(1):15-21.
18 Matteucci E,Modora S,Simone Metal.Hepatocyte growth factor induces apoptosis through the extrinsic pathway in hepatoma cells:favouring role of hypoxia-inducible factor-1 deficiency〔J〕.Oncogene,2003;22(26):4062-73.
19 Zhon J,Tobias S,Steffen S,etal.Tumor hypoxia and cancer progression〔J〕.Cancer Lett,2006;237(1):10-21.
20 田水刚,许 军.缺氧诱导因子在肿瘤生长中的作用〔J〕 国外医学外科学分册,2005;32(2):133-6.
21 Anastasia Triantafyllou,Ilias Mylonis,George Simos,etal.Flavonoids induce HIF-1α but impair its nuclear accumulation and activity〔J〕.Free Radical Biol Med,2008;44(4):657-70.
22 王 晗,韩忠朝.缺氧诱导因子-1与细胞凋亡〔J〕.国外医学生理、病理科学与临床分册,2005;25(2):52-5.
23 Piret TJP,Minet E,Cosse JP,etal.Hypoxia-inducible factor-l-dependent overexpression of myeloid cell factor-1 protects hypoxic cells against tert-butyl hydroperoxide:induced apotosis〔J〕.Biol Chem,2005;280(10):9336-44.
〔2015-02-19修回〕
(编辑 苑云杰/曹梦园)
江西省教育厅青年基金项目(GJJ10265)
殷嫦嫦(1960-),女,教授,博士,硕士生导师,主要从事生物化学与分子生物学研究。
王丽丽(1979-),女,讲师,硕士,主要从事生物化学与分子生物学研究。
R966
A
1005-9202(2016)22-5521-03;
10.3969/j.issn.1005-9202.2016.22.012
1 九江市第一人民医院
