摇蚊幼虫生物扰动对富营养化湖泊内源磷释放的影响
2016-12-16杨艳青陈沐松燕文明邢西刚王昊天
杨艳青,刘 凌,陈沐松,燕文明,邢西刚,王昊天,刘 唱
(1. 河海大学水文水资源学院,江苏 南京 210098;2. 河海大学水文水资源与水利工程科学国家重点实验室,江苏 南京 210098)
摇蚊幼虫生物扰动对富营养化湖泊内源磷释放的影响
杨艳青1,刘 凌1,陈沐松1,燕文明2,邢西刚1,王昊天1,刘 唱1
(1. 河海大学水文水资源学院,江苏 南京 210098;2. 河海大学水文水资源与水利工程科学国家重点实验室,江苏 南京 210098)
利用高分辨率的薄膜扩散梯度技术(Diffusive Gradients in Thin Films, DGT)和微电极技术,从微界面的角度研究了摇蚊扰动对沉积物中溶解氧(DO)、活性磷(Labile P)、活性铁(Labile Fe)及Labile P扩散通量的影响。研究发现摇蚊幼虫扰动增加了沉积物中溶解氧的渗透深度,降低了Labile P和Labile Fe的浓度,同时抑制了Labile P向上覆水中的释放。由于Labile P与Labile Fe显著相关(对照组R=0.672,P<0.001;摇蚊组R=0.810,P<0.001),可知Labile P的变化受DO和Labile Fe控制,即Labile Fe被氧化生成三价Fe(OOH),同时吸附Labile P,使得Labile P和Labile Fe同时降低。
生物扰动;内源磷释放;DGT;微电极;摇蚊幼虫
在淡水系统中,磷是构成初级生产力和食物链最重要的生源要素,同时也是水体富营养化的主要限制因子[1]。一直以来,外源磷的大量输入,造成了湖泊富营养化等严重的环境问题。近年来,随着外源磷污染治理力度的不断加大,外源磷污染已得到初步控制,而内源磷污染强度呈现增加趋势并在湖泊污染中的贡献比例逐渐增大[2]。因此,研究内源磷的释放机制对控制湖泊富营养化问题、维持湖泊健康具有重要意义。目前,关于内源磷污染的形成,普遍认为沉积物中的铁在控制内源磷释放中起到关键作用,在缺氧或厌氧条件下,氧化铁被还原,使得铁结合态磷向沉积物间隙水中释放和向上迁移,从而造成二次污染[2]。这种铁结合态磷被认为是沉积物中重要的可移动性磷[3],其迁移转化受氧气、pH、氧化还原电位(Eh)、微生物活性等环境因素的影响[4-5]。此外,生物扰动作为在沉积物中经常发生的生物过程,其对磷从沉积物向上覆水中的释放也有重要影响[6-8]。
湖泊沉积物中的底栖动物通过挖穴、摄食、通风、排泄等活动影响沉积物-水界面磷等化学组分的物质交换,同时加强间隙水与上覆水的交换作用[6]。摇蚊作为富营养化湖泊中底栖动物的典型代表,其幼虫在沉积物中构筑U形廊道,通过将上覆水引灌进洞穴向沉积物中输入溶解氧同时实现间隙水中磷等营养盐向上覆水中的扩散[9-10]。然而在摇蚊扰动对磷向上覆水中释放的研究中仍存在分歧,例如:Gallepp[11]和Fukuhara等[12]的研究指出摇蚊扰动促进了沉积物中磷的释放; Lewandowski等[13]和Reitzel等[14]及Zhang等[15]却发现摇蚊扰动会抑制沉积物中磷的释放;也有少量的研究者认为摇蚊扰动对磷的释放没有影响[16]。存在分歧的原因可能是由于摇蚊的个体比较小,在毫米级,对其在生物扰动过程中的采样技术往往要求高分辨率,传统的压榨法、离心法和透析法破坏了沉积物原有的结构,Peeper(9 mm×9 mm)和Rhizon技术虽保证了原位性分辨率却不够高。为此,为了能准确地研究摇蚊扰动对沉积物中磷释放的影响,迫切需要一种高分辨率的间隙水原位采样技术。
本文使用高分辨率(可达毫米级)的DGT技术[17-19]进行原位采样分析。利用DGT技术测定摇蚊幼虫廊道周围Labile Fe和Labile P的浓度并辅以溶解氧微电极测定微界面附近DO的含量,分析其变化规律,意在为准确揭示摇蚊扰动对沉积物中磷释放的影响这一科学命题提供更多依据。
1 材料与方法
1.1 DGT的准备
本试验DGT固定膜采用Xu等[20]发明的同时固定Labile P和Labile Fe的ZrO-Chelex膜。组装时,将ZrO-Chelex膜、滤膜(whatman, 0.45 μm孔径)依次放在DGT装置底板上,盖上盖板,用鱼线(justron,0.33 mm直径)穿孔将其绑紧。将组装好的DGT装置放入0.03 mol/L的NaNO3溶液中冲氮去氧至少16 h并密封保存留着备用。
1.2 试验设计
采样点选在富营养化程度较高的太湖藻型湖区梅梁湾(31°30′31″ N, 120°10′30″ E)。利用大口径重力采样器(直径110 mm×500 mm)在该采样点采集沉积物柱样,沉积物深度不少于20 cm,同时在该处取几桶湖水用于室内模拟培养试验。另用彼得森采样器采集少量沉积物,过2 mm筛后从中挑选4龄期摇蚊幼虫,将收集到的摇蚊幼虫在有3cm厚沉积物的玻璃缸中好氧5 ℃暂养[21]。所有样品采集后立即运回实验室。
培养试验在实验室内进行。将采集的沉积物按2 cm分层,同层沉积物收集在一起,过筛(60目)后依次填充到10根有机玻璃管(长40 cm,直径11 cm)中,用虹吸法小心注入采集的湖水,制成沉积物高15 cm,上覆水高5 cm的沉积物柱样。将10根沉积物柱样每5根放入一个聚乙烯塑料桶(深45 cm)中,往桶中缓慢加入湖水淹没培养,并用微孔曝气头曝气,水温控制在25 ℃,预培养16 d以使沉积物达到稳定。稳定16 d后挑选采集的4龄期摇蚊幼虫195条均分引入到一个桶的5根柱样中设置为摇蚊组(每根柱子39条,生物量为38.50 g/m2,采样点现场生物量为4.34 g/m2)[22-23],另外一个桶中的5根柱子不加任何东西设置为对照组。整个试验过程中控制每天光照培养12 h,黑暗培养12 h。
1.3 样品采集
试验引入摇蚊幼虫后分4个时段(7 d、46 d、116 d、140 d)进行样品采集:从摇蚊组和对照组各取一根柱样,用溶解氧微电极(OX-100, Unisense, Denmark)测其沉积物-水界面处的DO浓度,摇蚊试验组微电极针要对着摇蚊洞穴孔插入。DO测定结束后取2个DGT装置,将其垂直缓慢分别插入2根柱样的沉积物中,保留3~5 cm在上覆水中,稳定24 h后拔出DGT装置,冲洗干净后沿着DGT盖板边缘划开,取出ZrO-Chelex膜。用切片刀将ZrO-Chelex膜切成长条状,逐一挑入离心管中。然后依次加入1 mol/L的HNO3和1 mol/L的NaOH提取液分别提取被固定的Labile Fe和Labile P各24 h,将得到的提取液冷藏待分析。
1.4 样品分析
Labile P的测定采用钼锑抗比色法[24];Labile Fe的测定采用改进的菲罗啉比色方法[25]。
1.5 数据处理
根据式(1)计算与DGT接触的外界间隙水中Labile P和Labile Fe的浓度:
(1)
式中:M——固定膜上待测离子累积量,μg; Δg——扩散层厚度,cm;D——离子的扩散速率,cm2/s(可通过表格查得);A——DGT与外界接触面积,cm2;t——扩散时间,s;CDGT——时间t内待测离子的平均质量浓度,mg/L。
由DGT测得的一维Labile P的垂向浓度可计算其从沉积物向上覆水的扩散通量[26]。根据Fick定律由式(2)计算:
(2)
式中:Js——离子从沉积物向上覆水的扩散通量,ng/(cm2·d)(正值表示离子从沉积物向上覆水中扩散,负值反之);φ——表层5 mm沉积物的含水率(取0.9[27]);Ds——离子在沉积物中的扩散系数(可由离子在水中的扩散系数和φ3(φ≥0.7)算得[28-29])。
2 结果与讨论
2.1 DO剖面变化
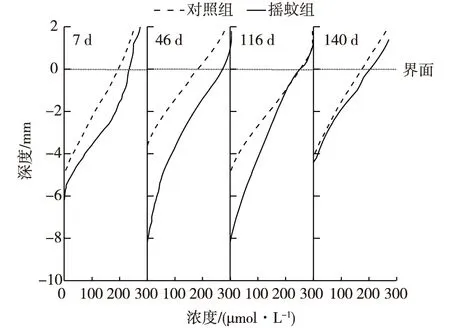
图1 4个时段沉积物-水界面附近的DO剖面变化Fig. 1 Variation of DO profiles near sediment-water interface in four periods
在引入摇蚊幼虫的1 h 内,摇蚊幼虫全部往沉积物里钻,筑造洞穴。摇蚊幼虫的洞穴是U形(试验中可观察到),摇蚊幼虫不断地将上覆水引灌入洞穴,滤食上覆水中的浮游植物和呼吸上覆水中的氧气[10]。随着富含氧气的上覆水被引灌进入洞穴中,增加了洞穴中氧气的含量。通过溶解氧(DO)微电极观测不同处理组沉积物氧气的渗透深度可知:在前3个采样期间,摇蚊幼虫扰动明显地增加了沉积物中氧气的渗透深度(图1)。在第7天、第46天、第116天和第140天摇蚊组的DO渗透深度分别为5.5 mm、8 mm、8 mm和4.4 mm,然而对照组的DO渗透深度仅为4.5 mm、3.5 mm、5 mm和4.2 mm(0 mm代表界面)。相比对照组分别增加了1 mm、4.5 mm、3 mm和0.2 mm。最大DO渗透深度变化发生在第46天,说明在第46天摇蚊的扰动作用最激烈,在第46天之后,扰动作用逐渐减弱。在第140天,扰动作用消失,摇蚊组和对照组沉积物中DO的渗透深度无明显变化。在前人的研究中,也发现了摇蚊幼虫扰动明显增加了沉积物中DO的渗透深度[22]。
2.2 磷、铁剖面变化
以摇蚊扰动作用最强烈的第46天组为例,分析Labile P和Labile Fe的变化规律。由于摇蚊的扰动,摇蚊组中Labile P浓度和Labile Fe浓度较对照组明显减小,尤其在界面下1~6 cm最为突出(图2):对照组和摇蚊组Labile P浓度均值分别为0.040 7 mg/L和0.013 6 mg/L,摇蚊组均值比对照组减小了0.0271 mg/L,相对减小66.6%,摇蚊组与对照组方差差异性概率P=0.000(小于0.05),T检验显著性概率P=0.000(小于0.05),表明对照组与摇蚊组Labile P浓度存在差异且差异显著;对照组与摇蚊组Labile Fe浓度均值分别为1.586 4 mg/L和0.551 2 mg/L,摇蚊组均值比对照组减小了1.035 2 mg/L,相对减小65.3%,摇蚊组与对照组方差差异性概率P=0.000(小于0.05),T检验显著性概率P=0.000(小于0.05),表明对照组与摇蚊组Labile Fe浓度存在差异且差异显著。同时由二者的变化趋势可知Labile P和Labile Fe存在相关性,经SPSS计算对照组和摇蚊组Labile P和Labile Fe的相关性分别为0.672(P<0.001)和0.810(P<0.001),显著相关。摇蚊扰动对Labile P和Labile Fe的影响范围在界面下1~6 cm,这与McCall等[30]发现的摇蚊主要取食范围在沉积物上层2~8 cm相一致。另外摇蚊扰动导致P和Fe含量同步降低的现象在Lewandowski等[9]和Zhang等[15]的研究中也有报道。
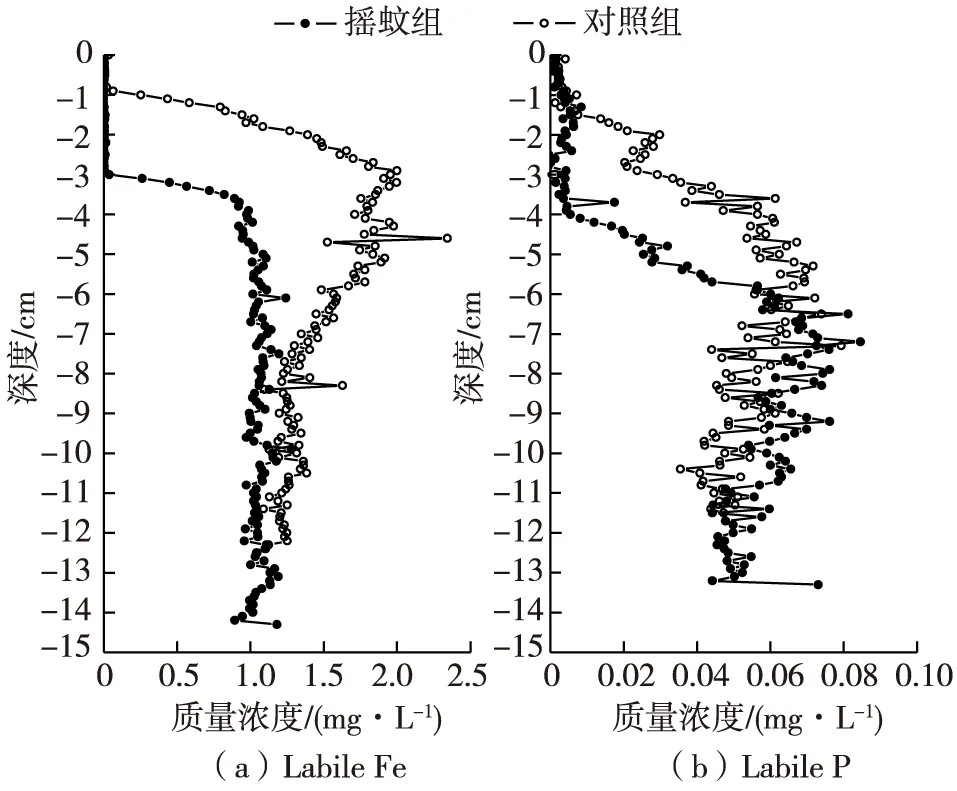
图2 46 d沉积物间隙水中Labile Fe和Labile P浓度剖面Fig. 2 Labile Fe and Labile P profiles in pore water on day 46
沉积物-水界面下5 mm附近的DGT垂向浓度与深度呈现了很好的线性关系(如46 d组:摇蚊组y=-0.001 4x+0.012 1,R2=0.95;对照组y=-0.004 2x+0.003 1,R2=0.91;x为深度,y为垂向浓度),说明DGT的高分辨率可用以定义界面附近Labile P的浓度梯度[31]。通过对各组界面附近Labile P向上覆水的释放通量的计算可知:在前3个采样期间,摇蚊幼虫扰动明显减小了Labile P的释放通量(图3)。在第7天、第46天、第116天和第140天对照组的释放通量分别为14.00 ng/(cm2·d)、32.74 ng/(cm2·d)、10.03 ng/(cm2·d)和2.80 ng/(cm2·d),而摇蚊组分别为9.33 ng/(cm2·d)、10.89 ng/(cm2·d)、7.78 ng/(cm2·d)和2.49 ng/(cm2·d),分别相对减小了33.4%、66.7%、22.5%和11.1%。在第46天减小幅度最大,表明第46天摇蚊扰动作用最强烈,在第46天之后扰动作用逐渐减弱。在第140天,扰动消失,摇蚊组与对照组的释放通量差异较小。在以往的研究中,Lewandowski等[9]、 Zhang等[15]和Chen等[23]都是通过监测上覆水中SRP浓度变化来计算通量,这里首次使用由DGT测得的 Labile P垂向浓度来计算通量,方法虽不同所得结论却相似,即摇蚊扰动抑制了磷从沉积物向上覆水中的释放。
2.4 摇蚊幼虫扰动对沉积物中磷释放的影响
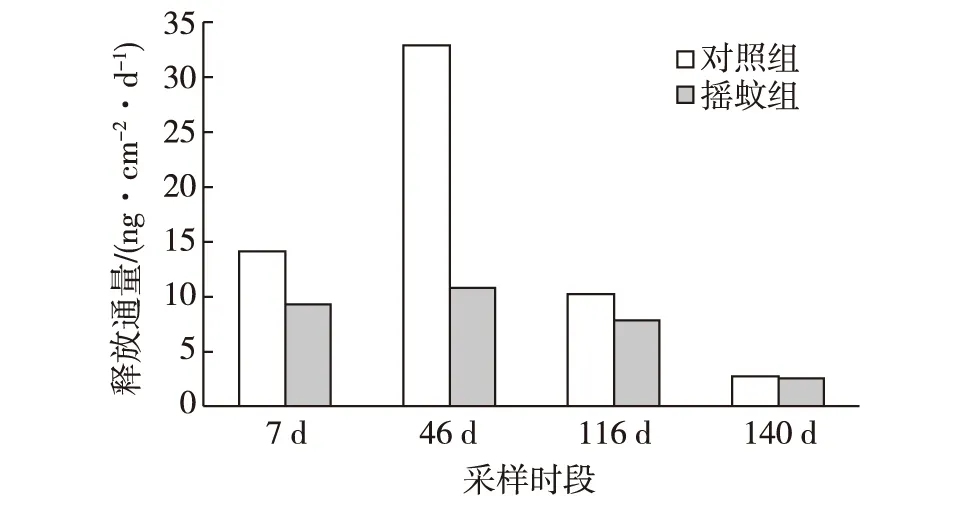
图3 4个时段微界面处沉积物向上覆水磷的释放通量Fig. 3 Release fluxes of phosphorus across sediment-water interface from sediment to overlying water in four periods
根据试验结果可得如下结论:湖泊沉积物中磷的释放受Fe氧化所控制。摇蚊将上覆水引灌进入沉积物,增加了沉积物中溶解氧渗透深度(图1)[22]。渗透下来的氧气改变了沉积物的氧化还原条件,为沉积物中氧化还原反应提供了丰富的电子受体(O2)[6]。因而沉积物中Labile Fe(Ⅱ)被氧化,沉积物中Labile Fe(Ⅱ)的浓度显著降低(图2)[9, 15]。被氧化的Labile Fe(Ⅱ)生产的三价Fe(OOH)会同时吸附沉积物中的Labile P,导致了沉积物中Labile P浓度的减小(图2)[9, 15]。Labile P浓度的减小又会削弱界面附近Labile P的浓度梯度,进而导致了Labile P从沉积物向上覆水扩散通量的减小(图3)[9, 15, 23]。通过对Labile P和Labile Fe(Ⅱ)大量数据的分析,显示二者存在显著相关性;且二者的变化均发生在界面下1~6 cm,空间上具有同步性,表明磷的释放受Fe(Ⅱ)氧化所控制。
摇蚊扰动的存在显然改变了沉积物的氧化还原条件,导致Labile Fe(Ⅱ)被氧化,生成的三价Fe(OOH)吸附沉积物和上覆水中的Labile P,最终抑制了界面处磷向上覆水中的释放。这在一定程度上减轻了湖泊的内源磷污染,抑制了湖泊的富营养化。
3 结 论
引入摇蚊后,摇蚊组的Labile P浓度比对照组明显降低,且在界面下1~6 cm变化最明显,在这个范围内摇蚊组Labile P平均浓度比对照组减小了66.6%;随摇蚊洞穴的开拓,上覆水被引灌进沉积物中,使得沉积物中溶解氧的渗透深度明显增加,摇蚊组中溶解氧渗透深度最深至界面下8 mm;同样在界面下1~6 cm沉积物中Labile Fe(Ⅱ)被O2氧化,生成了三价Fe(OOH)吸附Labile P,致其浓度明显降低并抑制了界面处Labile P的释放;摇蚊扰动在一定程度上抑制了湖泊的富营养化。
[1] 时丹,丁士明,许笛,等. 利用薄膜扩散平衡技术分析沉积物间隙水溶解态反应性磷 [J].湖泊科学,2009, 21(6): 768-774.(SHI Dan, DING Shiming, XU Di, et al. Determination of soluble reactive phosphorus in porewaters of sediments using the technique of diffusive equilibration in thin films [J].Journal of Lake Sciences, 2009, 21(6): 768-774. (in Chinese))
[2] 王燕,朱春刚,许笛,等. 一种大批量测定沉积物微量间隙水样品中溶解态磷和铁含量的方法[J].环境科学,2014, 35(4): 1271-1277.(WANG Yan, ZHU Chungang, XU Di,et al. Development of a method for measuring dissolved reactive phosphorus (DRP) and dissolved ferrous Iron in large batch in Pore water Samples of sediments with micro-volumes [J]. Environmental Science, 2014,35(4):1271-1277. (in Chinese))
[3] JENSEN H S,THAMDRUP B.Iron-bound phosphorus in marine sediments as measured by bicarbonate-dithionite extraction [J].Hydrobiologia,1993, 253(1-3): 47-59.
[4] CHRISTOPHORIDIS C, FYTIANOS K. Conditions affecting the release of phosphorus from surface lake sediments [J].Journal of Environmental Quality, 2006, 35(4): 1181-1192.
[5] HOLDREN G C, ARMSTRONG D E. Factors affecting phosphorus release from intact lake sediment cores [J].Environmental Science & Technology, 1980,14(1): 79-87.
[6] 张雷.生物扰动下湖泊沉积物-水界面特征变化与磷的迁移转化[D].南京: 中国科学院南京地理与湖泊研究所, 2010.
[7] TEAL L R, BULLING M T, PARKER E R, et al. Global patterns of bioturbation intensity and mixed depth of marine soft sediments [J].Aquatic Biology, 2008, 2(3): 207-218.
[8] CHEN M, DING S, LIU L, et al. Kinetics of phosphorus release from sediments and its relationship with iron speciation influenced by the mussel (Corbicula fluminea) bioturbation[J].Science of the Total Environment, 2016, 542: 833-840.
[9] LEWANDOWSKI J, LASKOV C, HUPFER M. The relationship between Chironomus plumosus burrows and the spatial distribution of pore-water phosphate, iron and ammonium in lake sediments [J].Freshwater Biology, 2007, 52(2): 331-343.
[10] WALSHE B M. Feeding mechanisms of Chironomus larvae [J].Nature,1947, 160(4066): 474.
[11] GALLEPP G W. Chironomid Influence on phosphorus release in sediment-water microcosms.[J].Ecology, 1979, 60(3): 547-556.
[12] FUKUHARA H, SAKAMOTO M.Enhancement of inorganic nitrogen and phosphate release from lake sediment by tubificid worms and chironomid larvae[J].Oikos,1987, 48(3): 312-320.
[13] LEWANDOWSKI J, HUPFER M. Effect of macrozoobenthos on two-dimensional small-scale heterogeneity of pore water phosphorus concentrations in lake sediments: a laboratory study[J].Limnology and Oceanography, 2005,50(4): 1106-1118.
[14] REITZEL K, LOTTER S, DUBKE M, et al.Effects of phoslock treatment and chironomids on the exchange of nutrients between sediment and water[J].Hydrobiologia, 2013, 703(1): 189-202.
[15] ZHANG L, GU X, FAN C, et al. Impact of different benthic animals on phosphorus dynamics across the sediment-water interface [J].Journal of Environmental Science (China),2010, 22(11): 1674-1682.
[16] MATISOFF G, FISHER J B, MATIS S. Effects of benthic macroinvertebrates on the exchange of solutes between sediments and freshwater [J].Hydrobiologia,1985, 122(1): 19-33.
[17] DING S, XU D, SUN Q, et al.Measurement of dissolved reactive phosphorus using the diffusive gradients in thin films technique with a high-capacity binding phase[J].Environmental Science & Technology,2010, 44(21): 8169-8174.
[18] DING S, SUN Q, XU D, et al. High-resolution simultaneous measurements of dissolved reactive phosphorus and dissolved sulfide: the first observation of their simultaneous release in sediments[J].Environmental Science & Technology, 2012, 46(15): 8297-8304.
[19] DING S, WANG Y, XU D, et al. Gel-based coloration technique for the submillimeter-scale imaging of labile phosphorus in sediments and soils with diffusive gradients in thin films[J].Environmental Science & Technology, 2013, 47(14): 7821-7829.
[20] XU D, CHEN Y, DING S, et al. Diffusive gradients in thin films technique equipped with a mixed binding gel for simultaneous measurements of dissolved reactive phosphorus and dissolved iron[J].Environmental Science & Technology, 2013, 47(18): 10477-10484.
[21] HANSEN K, MOURIDSEN S, KRISTENSEN E. The impact of Chironomus plumosus larvae on organic matter decay and nutrient (N, P) exchange in a shallow eutrophic lake sediment following a phytoplankton sedimentation [J].Hydrobiologia, 1997, 364(1): 65-74.
[22] 商景阁,张路,王建军,等.中国长足摇蚊幼虫和霍普水丝蚓扰动下沉积物氧气特征分析[J].水生生物学报, 2011, 35(4): 610-615.(SHANG Jingge, ZHANG Lu, WANG Jianjun, et al. Bioturbation effects of tanypus chinensis and limnodrilus hoffmeisteri on penetration and distribution of sediment oxygen[J].Acta Hydrobiologica Sinica,2011, 35(4): 610-615. (in Chinese))
[23] CHEN M, DING S, LIU L, et al. Iron-coupled inactivation of phosphorus in sediments by macrozoobenthos (chironomid larvae) bioturbation: evidences from high-resolution dynamic measurements[J].Environmental Pollution, 2015, 204: 241-247.
[24] 魏复盛. 水和废水检测分析方法[M]. 北京: 中国环境科学出版社, 2002: 243-285.
[25] TAMURA H, GOTO K, NAGAYAMA M, et al. Spectrophotometric determination of iron (II) with 1, 10-phenanthroline in the presence of large amounts of iron (III) [J].Talanta, 1974, 21(4): 314-318.
[26] DING S, HAN C, WANG Y, et al.In situ, high-resolution imaging of labile phosphorus in sediments of a large eutrophic lake[J]. Water Research, 2015, 74: 100-109.
[27] GAO Y, LESVEN L, GILLAN D, et al.Geochemical behavior of trace elements in sub-tidal marine sediments of the Belgian coast [J].Marine Chemistry, 2009, 117(1/2/3/4): 88-96.
[28] ULLMAN W J, ALLER R C.Diffusion coefficients in nearshore marine sediments[J].Limnology and Oceanography, 1982, 27(3): 552-556.
[29] YUAN-HUI L, GREGORY S.Diffusion of ions in sea water and in deep-sea sediments[J].Geochimica Eet cosmochimica Acta, 1974, 38(5): 703-714.
[30] MCCALL P L, TEVESZ M J. Animal-sediment relations [M].New York: Springer Science+Business Media, 1982: 105-176.
[31] XU D, DING S, SUN Q, et al. Evaluation of in situ capping with clean soils to control phosphate release from sediments[J].Science of the Total Environment, 2012, 438: 334-341.
Effect of chironomid larvae bioturbation on release of internal phosphorus in eutrophic lake
YANG Yanqing1, LIU Ling1, CHEN Musong1, YAN Wenming2, XING Xigang1, WANG Haotian1, LIU Chang1
(1.CollegeofHydrologyandWaterResources,HohaiUniversity,Nanjing210098,China;2.StateKeyLaboratoryofHydrology-WaterResourcesandHydraulicEngineering,HohaiUniversity,Nanjing210098,China)
The effects of chironomid larvae bioturbation on the concentrations of dissolved oxygen (DO), labile phosphorus (Labile P), and labile iron (Labile Fe), as well as the diffusion flux of Labile P across the sediment-water interface in eutrophic lakes were examined using high-resolution diffusive gradients in thin films (DGT) and microelectrode techniques. The results show that chironomid larvae bioturbation increases the depth of penetration of DO in the sediments, decreases the concentrations of Labile P and Labile Fe, and inhibits the release of Labile P from sediments to the overlying water. Because Labile P is significantly correlated with Labile Fe (R=0.672 andP<0.001 for the control group, andR=0.810 andP< 0.001 for the chironomid group), it can be inferred that the change of Labile P is controlled by DO and Labile Fe according to the following process: Labile Fe is oxidized to produce the ferric hydration Fe(OOH), which can adsorb Labile P, and this leads to the decrease of the Labile Fe and Labile P concentrations.
bioturbation; release of internal phosphorus; DGT; microelectrode; chironomid larvae
10.3876/j.issn.1000-1980.2016.06.003
2016-01-25
国家自然科学基金(51279060,41301531)
杨艳青(1992—),男,河南商丘人,硕士研究生,主要从事水环境治理及生态修复研究。E-mail:yqyanghhu@163.com
刘凌,教授。E-mail:lingliu_hhu@163.com
X524
A
1000-1980(2016)06-0485-06
