沙蜇蛋白酶解物类蛋白反应修饰及其生物活性
2016-12-16石晓梅,车丽辉,董秀芳,孙美玲,付颖寰
石 晓 梅, 车 丽 辉, 董 秀 芳, 孙 美 玲, 付 颖 寰
( 1.大连工业大学 国家海洋食品工程技术研究中心, 辽宁 大连 116034;2.大连工业大学 食品学院, 辽宁 大连 116034;3.大连工业大学 生物工程学院, 辽宁 大连 116034;4.大连工业大学 轻工与化学工程学院, 辽宁 大连 116034 )
沙蜇蛋白酶解物类蛋白反应修饰及其生物活性
石 晓 梅1,3, 车 丽 辉1,2, 董 秀 芳1,2, 孙 美 玲1,2, 付 颖 寰1,4
( 1.大连工业大学 国家海洋食品工程技术研究中心, 辽宁 大连 116034;2.大连工业大学 食品学院, 辽宁 大连 116034;3.大连工业大学 生物工程学院, 辽宁 大连 116034;4.大连工业大学 轻工与化学工程学院, 辽宁 大连 116034 )
为提高沙蜇肽的降血压和抗氧化活性,通过plastein反应修饰沙蜇蛋白酶解物。根据单因素试验优化得出plastein反应最佳条件:温度20 ℃、底物质量分数35%、加酶量2.5 kU/g。在此条件下反应6 h,游离氨基减少量为83.09 μmol/g,plastein反应产物的体外ACE抑制率为83.15%(产物质量浓度为15 mg/mL),比沙蜇蛋白酶解物的ACE抑制率提高了10.45%;反应4 h,游离氨基减少量为107.52 μmol/g,plastein反应产物的体外DPPH的IC50为24.68 mg/mL,比沙蜇蛋白酶解物的DPPH清除力提高了39.63%。plastein反应可提高沙蜇肽的ACE抑制活性和DPPH清除能力。
沙蜇;类蛋白反应;ACE抑制活性;抗氧化活性
0 引 言
沙蜇(Stomolophusmeleagris)中氨基酸种类和含量丰富[1],脂质胆固醇含量低[2],属于高蛋白低脂肪食物,且资源丰富,在我国大部分沿海地区均有分布[3],具有一定的开发价值。为更好地开发利用沙蜇资源,许多学者对沙蜇多肽的酶解制备条件以及其生物活性进行了研究。李伟伟等[4]对沙蜇的组成成分以及酶解制备沙蜇多肽条件进行了系统的研究,并且对沙蜇多肽的降血压和抗氧化活性进行了研究。
类蛋白(plastein)反应是浓缩的蛋白水解物在适宜的条件下经蛋白酶作用形成类似于蛋白质的混合物[5]。在plastein反应过程中,由于同时存在水解作用、缩合作用、转肽作用和物理聚集[6],因此极有可能生成具有新结构的肽,从而提高其生物学活性。国内外对plastein反应的研究除探究反应机理和适宜的反应条件外[7],大多集中于应用方面[8],高博等[9-10]通过对酪蛋白、大豆蛋白水解物进行类蛋白反应,发现了其ACE抑制活性、抗氧化性等性质得到显著的提高。由于在plastein反应过程中未添加任何有机溶剂或其他的化学试剂,其在生产生活中具有较好的安全性,这方面的研究吸引了越来越多学者的关注。本实验探索通过plastein反应来修饰沙蜇蛋白酶解物,以期达到提高沙蜇肽的降血压和抗氧化活性的目的,为沙蜇蛋白资源的进一步开发利用提供了理论依据。
1 材料与方法
1.1 材 料
盐渍沙蜇皮,购自大连市内长兴市场;色谱甲醇和FAPGG,Sigma-Aldrich公司;其他试剂均为分析纯。
L550离心机,湖南湘仪实验室仪器开发有限公司;A200型电子顺磁共振波谱仪,德国Bruker opertics公司;KQ2200DE型数控超声波清洗器,昆山市超声仪器有限公司;lambda 35 紫外可见光谱仪,Perkin Elmer公司;漩涡振荡器,赛唯斯科技公司;PHS-3C型精密酸度计,上海康仪仪器有限公司。
1.2 盐渍沙蜇皮原料处理
将盐渍沙蜇皮切成1 cm左右的方块,放入去离子水浸泡,隔天换水,共浸泡10 d。沥干后真空冷冻干燥、粉碎,置于-30 ℃冰箱保存备用。
1.3 酶解制备沙蜇生物活性肽
采用碱性蛋白酶酶解沙蜇皮制备沙蜇肽,酶解条件:底物质量分数4%,温度60 ℃,酶加量2.5 kU/g,pH 8。
1.4 plastein反应修饰沙蜇肽
以沙蜇皮蛋白酶解肽冻干粉为原料,利用碱性蛋白酶进行plastein反应。由于该反应发生在肽段之间,类似于重新形成蛋白的反应,因此可以使用体系的游离氨基减少量来表征反应发生的程度。实验中考察了酶加量、底物质量分数、反应温度和反应时间对游离氨基减少量的影响。各因素水平梯度分别为:反应温度10、20、30、40 ℃;底物质量分数30%、35%、40%、45%、50%;酶加量1.5、2.0、2.5、3.0、3.5 kU/g;水解时间1、2、3、4、5、6 h。反应完毕后,在沸水浴中保持10 min灭酶,采用邻苯二甲醛法测定游离氨基含量[11]。
1.5 ACE抑制活性的测定
体外ACE抑制活性参照文献[12]进行测定,将 FAPGG底物溶液与超纯水或ACE抑制肽混合均匀,加入ACE酶液反应30 min后,加入EDTA溶液终止反应,最后加入超纯水稀释,应用紫外分光光度计在340 nm波长下分别测定反应体系0 min和30 min时的吸光度,并计算差值ΔA,ACE抑制率根据下面公式计算[13]:
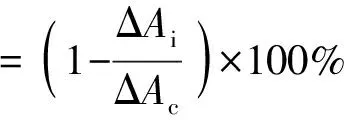
式中:ΔAc为加入超纯水时吸光度在30 min内的变化;ΔAi为加入抑制剂时吸光度在30 min内的变化。
1.6 羟基自由基清除率的测定
在Fenton反应体系中,6 mmol/L的EDTA-2Na 10 μL,6 mmol/L的FeSO410 μL,6% H2O28 μL,1 mol/L DMPO 10 μL,各浓度样品溶液10 μL,用pH 7.4、150 mmol/L磷酸盐缓冲液补充体积至100 μL,混合均匀后,置于40 ℃水浴30 min,放入谐振腔,微波频率9.4 GHz,微波功率74.8 mW,放大倍数1.00×105,调制幅度1.0 G,在中心磁场强度3 369.08 G、调制频率100 kHz、时间常数163.84 ms、转换时间160 ms条件下扫描。空白组中提取液用pH 7.4、150 mmol/L 磷酸盐缓冲液代替,以波谱信号的第2个峰高值表示信号相对强度[14],计算清除率。

1.7 DPPH清除率的测定
DPPH清除能力按照文献方法[15]进行测定,将DPPH、磷酸盐缓冲液(pH=6.0)和抑制剂迅速混合,避光保存30 min后立即吸入毛细管,放入谐振腔,微波功率5.32 mW,微波频率9.44 GHz;在中心磁场强度3 368.6 G、放大倍数1.4×104、调制幅度1.0 G、时间常数81.92 ms调制频率、100 kHz、转换时间40 ms条件下扫描。以波谱信号第3个峰高值表示信号的相对强度,计算清除率。

2 结果与讨论
2.1 酶解制备沙蜇肽及其生物活性
按“1.3”的方法制备沙蜇肽,此条件下水解度为20.69%。经测定,在碱性蛋白酶酶解沙蜇肽质量浓度为15 mg/mL时,ACE抑制率为75.28%;羟基自由基的IC50为16.57 mg/mL;DPPH的IC50为40.88 mg/mL。
2.2 反应温度对plastein反应的影响
由于plastein反应是放热反应[16],本实验考察了10~40 ℃内游离氨基减少量的变化。结果如图1所示,在升温过程中,游离氨基减少量不断下降。但是若反应温度过低,体系内分子运动激烈程度则会大大降低,从而减少了蛋白酶与底物的碰撞概率。因此选择20 ℃为碱性蛋白酶plastein 反应修饰沙蜇酶解肽的最适温度。
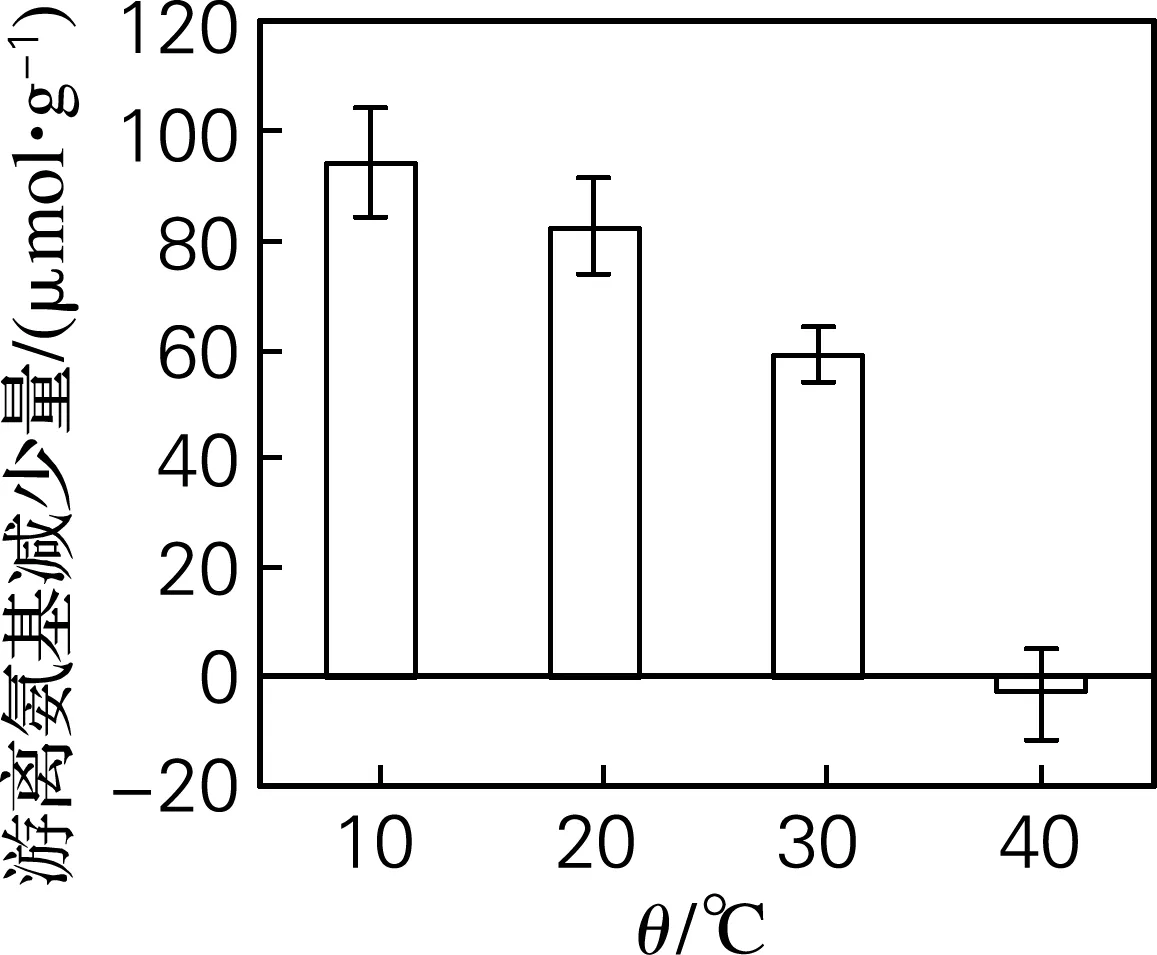
图1 温度对游离氨基减少量的影响
2.3 底物质量分数对plastein反应的影响
类蛋白反应通过浓缩酶解产物发生,因此,底物质量分数是类蛋白反应主要影响因素[7]。由图2可以看出,随着底物质量分数的增加,游离氨基的减少量逐渐增多,当底物质量分数达到35%时,游离氨基的减少量达到峰值,随着底物质量分数继续增加,体系黏度变大,以至于不利于反应的进行,因此游离氨基减少量反而下降。
2.4 酶加量对plastein反应的影响
由图3可知,酶加量在1.5~2.5 kU/g,随着酶加量的增大,游离氨基减少量在逐渐增大;酶加量大于2.5 kU/g时,随着酶加量的增大,游离氨基减少量几乎保持不变,可能是酶量已达到饱和。因此,碱性蛋白酶的最佳添加量为2.5 kU/g。
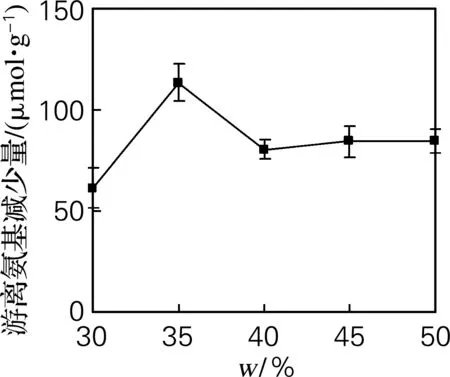
图2 底物质量分数对游离氨基减少量的影响
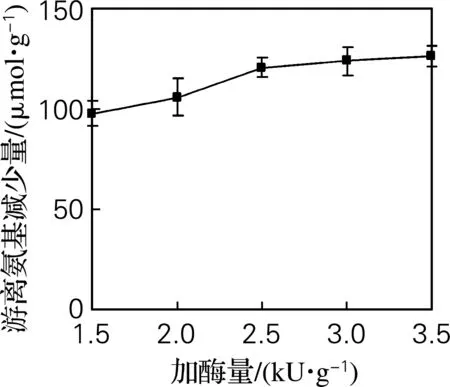
图3 加酶量对游离氨基减少量的影响
2.5 Plastein反应修饰程度与产物生物活性
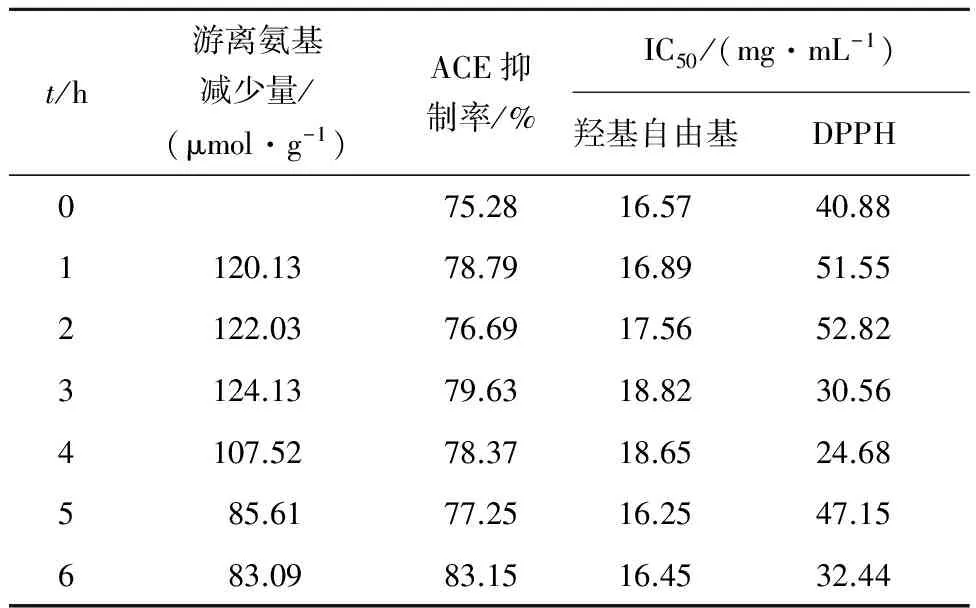
由表1可以看出,随着plastein反应时间的延长,游离氨基的减少量呈现先增加后减少的趋势,说明此时体系中存在着蛋白水解和肽合成两种反应。而酶解物的ACE抑制活性随着plastein 反应修饰时间的延长增幅不大,反应6 h时达到最大值83.15%(沙蜇肽质量浓度为15 mg/mL),表明plastein反应修饰可以提高沙蜇蛋白酶解物ACE抑制活性;沙蜇水解物羟基自由基的IC50随plastein 反应修饰时间的延长几乎保持不变,这表明plastein反应修饰对沙蜇蛋白酶解物的羟基自由基的清除力几乎没有影响;水解物DPPH的IC50随着plastein反应修饰时间的延长呈不规则变化,4 h(24.68 mg/mL)达到最低,虽然活性的

表1 Plastein反应对沙蜇蛋白水解物生物活性的影响
Tab.1 Effects of plastein reaction-based modification on bioactivities of jellyfish protein hydrolysates
t/h游离氨基减少量/(μmol·g-1)ACE抑制率/%IC50/(mg·mL-1)羟基自由基DPPH075.2816.5740.881120.1378.7916.8951.552122.0376.6917.5652.823124.1379.6318.8230.564107.5278.3718.6524.68585.6177.2516.2547.15683.0983.1516.4532.44
提高与修饰程度的相关性不明显,这与plastein反应的随机性有关,但整体的结果仍然表明,沙蜇蛋白水解物的plastein反应修饰是提高DPPH清除能力的有效方法。
3 结 论
本研究确定了碱性蛋白酶plastein反应修饰沙蜇蛋白酶解物的最佳条件:反应温度20 ℃,酶加量2.5 kU/g,底物质量分数35%,此条件下反应6 h,游离氨基减少量为83.09 μmol/g,沙蜇肽体外ACE抑制率为83.15%(沙蜇肽质量浓度为15 mg/mL),比酶解肽ACE抑制率提高了10.45%;此反应条件下反应4 h,游离氨基减少量为107.52 μmol/g,沙蜇肽体外DPPH的IC50为24.68 mg/mL,比酶解肽DPPH清除力提高了39.63%。可见,plastein反应可以改善沙蜇蛋白酶解肽的抗氧化性和ACE抑制活性方面具有一定的潜力,值得进一步研究。
[1] 闫玉霞.沙蜇营养成分分析及肌原纤维自身降解特性研究[D].青岛:中国海洋大学,2011.
[2] HSIEH Y H P, LEONG F, BARNES K W. Inorganic constituents in fresh and processed cannonball jellyfish (Stomolophusmeleagris)[J]. Journal of Agricultural and Food Chemistry, 1996, 44(10): 3117-3119.
[3] 农业部渔业局.2013中国渔业统计年鉴[M].北京:中国农业出版社,2013.
[4] 李伟伟,李八方,胡靖,等.沙海蜇ACE抑制肽制备酶解条件研究[J].农产品加工(学刊),2014(6):4-7.
[5] YAMASHITA M, ARAI S, TSAI S J, et al. Plastein reaction as a method for enhancing the sulfur-containing amino acid level of soybean protein[J]. Journal of Agricultural and Food Chemistry, 1971, 19(6): 1151-1154.
[6] STEVENSON D E, MORGAN K R, FENTON G A, et al. Use of NMR and mass spectrometry to detect and quantify protease-catalyzed peptide bond formation in complex mixtures[J]. Enzyme and Microbial Technology, 1999, 25(3/4/5): 357-363.
[7] SUKAN G, ANDREWS A T. Application of the plastein reaction to caseins and to skim-milk powder: Ⅰ. Chemical and physical properties of the plastein and the mechanism of plastein formation[J]. Journal of Dairy Research, 1982, 49(2): 279-293.
[8] SYNOWIECKI J, JAGIELKA R, SHAHIDI F. Preparation of hydrolysates from bovine red blood cells and their debittering following plastein reaction[J]. Food Chemistry, 1996, 57(3): 435-439.
[9] 高博,赵新淮.耦合Plastein反应的大豆蛋白降压肽酶法制备技术[J].食品科学,2010,31(22):25-30.
[10] ZHAO X H, WU D, LI T J. Preparation and radical scavenging activity of papain-catalyzed casein plasteins[J]. Dairy Science and Technology, 2010, 90(5): 521-535.
[11] 朱晓杰,曾名湧,赵元晖,等.海地瓜蛋白酶解物类蛋白反应修饰及其对ACE活性的影响[J].中国海洋药物,2011,30(6):6-12.
[12] 孙辉.酪蛋白ACE抑制肽的类蛋白反应修饰与溶剂分级研究[D].哈尔滨:东北农业大学,2012.
[13] OTTE J, SHALABY S M A, ZAKORA M, et al. Fractionation and identification of ACE-inhibitory peptides from α-lactalbumin and β-casein produced by thermolysin-catalysed hydrolysis[J]. International Dairy Journal, 2007, 17(12): 1460-1472.
[14] 张友九,宁萍,强亦忠,等.水溶性抗氧化剂清除羟基自由基能力的ESR评价方法[J].苏州医学院学报,2001,21(1):32-34.
[15] 腾杨,王雪,杜波涛,等.金银花的不同浓度醇提取物对DPPH清除作用的ESR研究[J].黑龙江医药科学,2011,34(6):43-44.
[16] 徐微,赵新淮.酪蛋白水解物的Plastein反应修饰及ACE抑制活性变化[J].中国乳品工业,2011(4):8-11.
陈庭家,田景玉,丁月,隋凌云,宋亮.刺参体腔细胞类型及其死亡率与温度的关系[J].大连工业大学学报,2016,35(6):407-410.
Modification of jellyfish protein hydrolysates by plastein reaction and its biological activity
SHI Xiaomei1,3, CHE Lihui1,2, DONG Xiufang1,2, SUN Meiling1,2, FU Yinghuan1,4
( 1.National Marine Food Research Center, Dalian Polytechnic University, Dalian 116034, China; 2.School of Food Science and Technology, Dalian Polytechnic University, Dalian, 116034, China; 3.School of Biological Engineering, Dalian Polytechnic University, Dalian, 116034, China; 4.School of Light Industry and Chemical Engineering, Dalian Polytechnic University, Dalian, 116034, China )
The hydrolysate of jellyfish was modified by plastein reaction to improve its antihypertensive and antioxidant activity. The optimal conditions of plastein reaction were obtained by single factor experiments as follows: reaction temperature of 20 ℃, concentration of jellyfish hydrolysates of 35% and enzyme amount of 2.5 kU/g. Under the conditions, the maximal decrease of free amino groups in reaction mixture of 83.09 μmol/g was obtained. The angiotensin converting enzyme inhibitory activity of the product was 83.15% (the concentration of product was 15 mg/mL) after reaction for 6 h, which increased by 10.45% compared with the unmodified hydrolysate. The maximal decrease of free amino groups in reaction mixture of 107.52 μmol/g was obtained after reaction for 4 h, and the product exhibited IC50of DPPH was 24.68 mg/mL, which increased by 39.63% compared with the unmodified hydrolysate. The plastein reaction could improve ACE inhibitory activity and DPPH radical scavenging activity of hydrolysate obtained from jellyfish.
jellyfish; plastein reaction; ACE inhibitory activity; antioxidant activity
2015-03-20.
国家自然科学基金资助项目(31501431);辽宁省教育厅基本科研业务费项目(2016J014);辽宁省优秀人才支持计划项目(LJQ2013058).
石晓梅(1988-),女,硕士研究生;通信作者:付颖寰(1976- ),女,教授.
TS254;S986.1
A
1674-1404(2016)06-0403-04
SHI Xiaomei, CHE Lihui , DONG Xiufang, SUN Meiling, FU Yinghuan. Modification of jellyfish protein hydrolysates by plastein reaction and its biological activity[J]. Journal of Dalian Polytechnic University, 2016, 35(6): 403-406.
