分光光度法检测酶促反应中底物的量
2016-12-16周彦品,王金辉,李瑞龙,陈瑞华,俞志敏,赵长新
周 彦 品, 王 金 辉, 李 瑞 龙, 陈 瑞 华, 俞 志 敏, 赵 长 新
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
分光光度法检测酶促反应中底物的量
周 彦 品, 王 金 辉, 李 瑞 龙, 陈 瑞 华, 俞 志 敏, 赵 长 新
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
基于酶与底物结合出现游离氨基酸增多的现象建立了检测酶促反应底物存在的新方法。以蔗糖酶与α-淀粉酶为研究对象,采用茚三酮比色法考察了反应温度、pH、酶浓度等因素对因反应造成游离氨基酸量的影响。结果表明,在50 ℃、pH=8、0.1%的蔗糖酶条件下,因反应变化的游离氨基酸的量与蔗糖质量分数在0.02%~0.08%呈线性关系,方法检出限为37.07 μg/mL,相对标准偏差为1.75%~5.11%,方法加标回收率为96.32%~101.31%。α-淀粉酶有相似的结果,方法检出限、相对标准偏差、加标回收率分别为1.317 mg/mL、2.79%~5.88%、92.82%~100.86%。
游离氨基酸;底物检测;蔗糖酶;α-淀粉酶
0 引 言
酶检测法特异性较强,常用于结构分析与化学性质的鉴定,该法无须复杂的预处理,检测速度较快[1]。黄文风等[2]利用农药抑制乙酰胆碱酯酶(AchE)活性影响产物复合物的吸光度原理来测定农药的残留量;夏晓东等[3]利用葡萄糖氧化酶与葡萄糖发生氧化还原反应产生的H2O2量间接检测葡萄糖的存在。以前利用酶检测微量物质的方法,均是通过检测酶促反应产物络合物的量间接检测底物的存在,步骤烦琐,精密度以及准确度难以保证[4]。
酶与底物结合后,反应液出现游离氨基酸增多的现象,且加入底物的量与反应液中游离氨基酸的量成正比,因此通过检测游离氨基酸的量来表征底物的量,此方法专一性强,灵敏度高。蔗糖酶α-淀粉酶、糖化酶、己糖激酶均有此特性。检测产生游离氨基酸的方法较多,其中茚三酮比色法[5]相对于荧光胺法[6]、异硫氰酸苯酯(PTTC)法[7]、异硫氰酸荧光素(FITC)法[8]、邻苯二甲醛法[9]具有快速、灵敏、经济等特点。利用酶与底物结合后的特性,建立一种分光光度法检测底物的新方法,可便捷地检测底物的含量。
1 材料与方法
1.1 主要材料
蔗糖酶、α-淀粉酶、可溶性淀粉、蔗糖、DL-苹果酸、NaH2PO4、NaCl、Na2HPO4。实验用水为双蒸水。
1.2 方 法
1.2.1 溶液的配制
蔗糖酶溶液的配制:取一定的蔗糖酶溶于pH为6.9的0.02 mol/L的PBS缓冲液,分别配成质量分数为0.02%~0.3%的蔗糖酶溶液。
蔗糖溶液的配制:取一定的蔗糖分别溶于不同pH的0.02 mol/L的PBS缓冲液中,分别制成相应pH质量分数为8%的蔗糖溶液以及pH 8.0的0.02%~0.08%的蔗糖溶液。
茚三酮溶液的配制:称取0.5 g茚三酮溶于终体积为100 mL水中得到5 g/L的茚三酮水溶液,保存于棕色瓶中。
1.2.2 酶促反应生成游离氨基酸的测定
比色管中分别加入1 mL蔗糖酶溶液与1.5 mL 蔗糖溶液,反应完全后,加入1 mL 5 g/L的茚三酮溶液,在95 ℃下水浴30 min,避光冷却1 h,在570 nm波长下用分光光度计测定其吸光度。以PBS缓冲液代替蔗糖溶液作空白对照。
1.2.3 温度对游离氨基酸量的影响
将1 mL 0.02%的蔗糖酶溶液与1.5 mL pH为6.9的8%蔗糖溶液分别在40、45、50、55、60、65、70 ℃预热1 min,每组3个平行,反应2 min,测定不同温度对反应液中游离氨基酸的影响。
1.2.4 pH对游离氨基酸量的影响
取pH分别为 5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0的8%蔗糖溶液与0.02%的蔗糖溶液,在50 ℃下反应2 min,在570 nm波长下测定各组反应液吸光度。
1.2.5 蔗糖酶质量分数对游离氨基酸量的影响
将0.04%~0.3%的蔗糖酶溶液分别与1.5 mL pH为8的0.25%蔗糖溶液,在50 ℃下反应2 min,在570 nm波长下测定其吸光度。
1.2.6 底物质量分数对游离氨基酸量的影响
测定质量分数0.02%~0.08%,pH为8的蔗糖溶液,在0.1%蔗糖酶50 ℃下反应3 min,对反应液中游离氨基酸的影响。
2 结果与讨论
2.1 游离氨基酸的测定结果
分别取0.1%的蔗糖酶、0.08%的蔗糖、0.2% 的α-淀粉酶、0.6%的淀粉溶液,按图1中的分组反应,测定游离氨基酸的量。
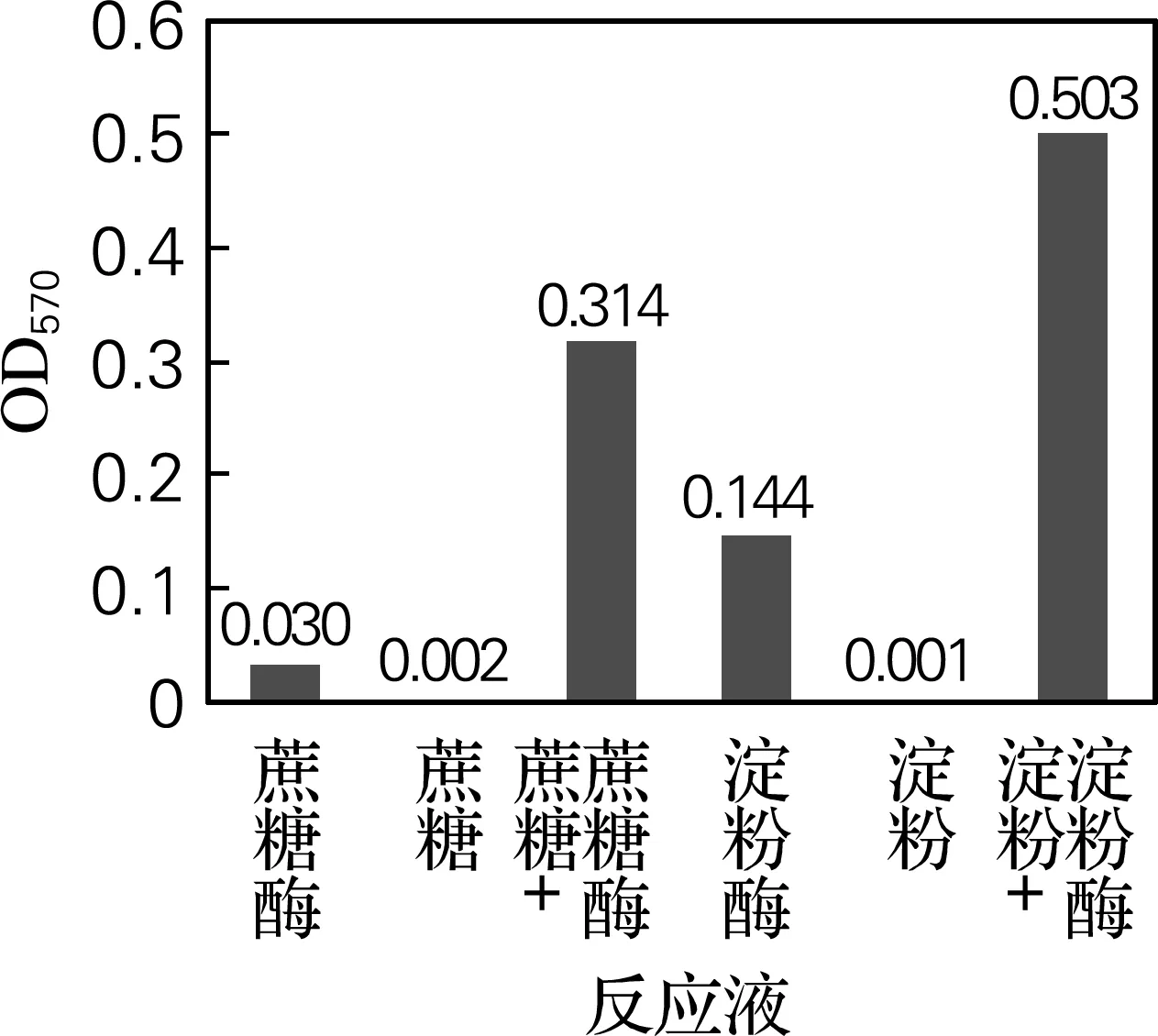
图1 不同酶促反应液中游离氨基酸的量
从图1可以看出,蔗糖酶、蔗糖、α-淀粉酶、淀粉溶液的4种反应液中游离氨基酸的量非常少,而酶与底物反应后反应液中游离氨基酸的量明显增多。出现这一现象可能由于酶分子在酶促反应过程中的构象向有利于酶促反应发生的方向变构,在变构过程中,由于蛋白质的N端和C端具有较大的柔性,使得肽链上的氨基酸在酶分子翻转过程中脱落下来[10-11]。而氨基酸脱落的原因也可能与酶的半衰期有关。酶上氨基酸的脱落有利于调节酶在体内的半衰期,如王镜岩等[12]提到,生物体内半衰期较短的酶都处于重要的代谢控制部位。但对于出现这一现象的原理还有待进一步的探究。
2.2 反应温度
如图2所示,随着温度的升高,蔗糖酶反应液的吸光度随温度的增加先缓慢增加,达到一定值后逐渐降低,因此选择50 ℃为蔗糖酶酶促反应的最佳温度。这种现象的原因可能有两方面:一是温度升高可以加快分子运动速率,提高分子碰撞概率,从而使反应速率加快,同时提高游离氨基酸的增加程度;另一方面,温度升高可以使酶蛋白逐渐变性失活,从而降低酶促反应速率[13]。温度对酶促反应速率的影响是这两方面作用的综合结果。
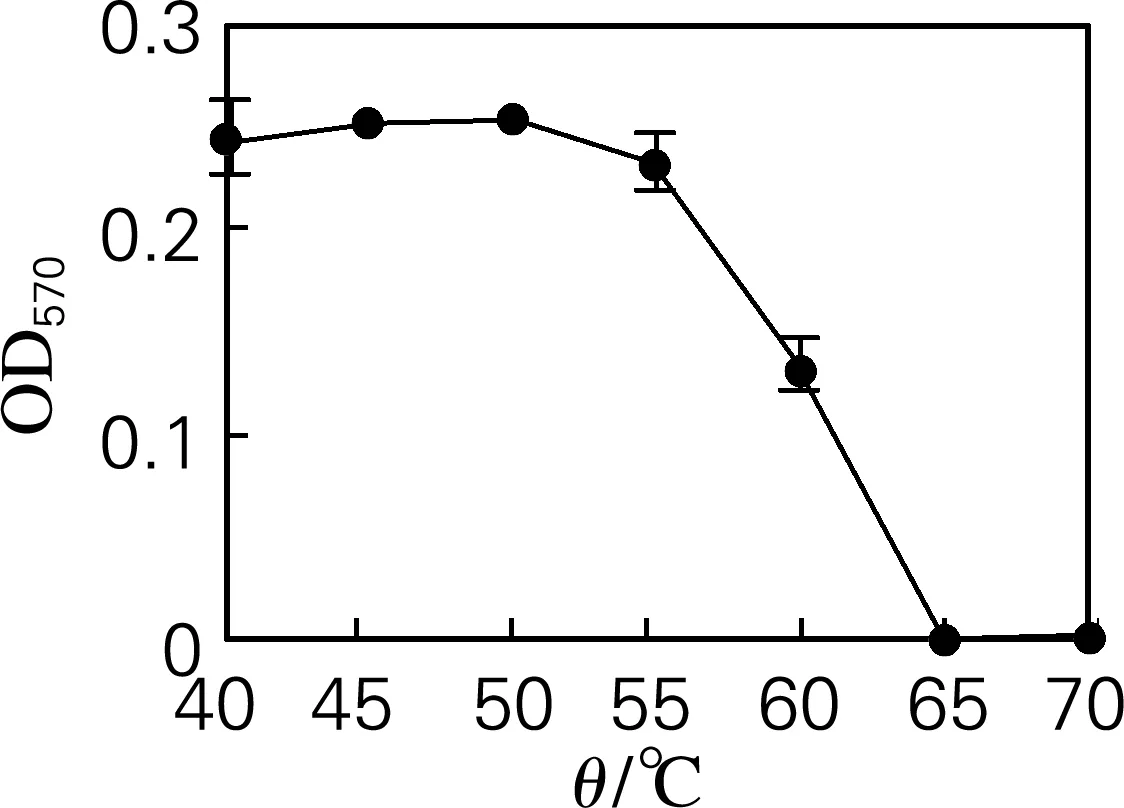
图2 温度对游离氨基酸量的影响
2.3 pH
如图3所示,随着蔗糖溶液pH的增大,反应液的吸光度先逐渐增大后逐渐减小,出现最大值,此吸光度对应最适pH为8。
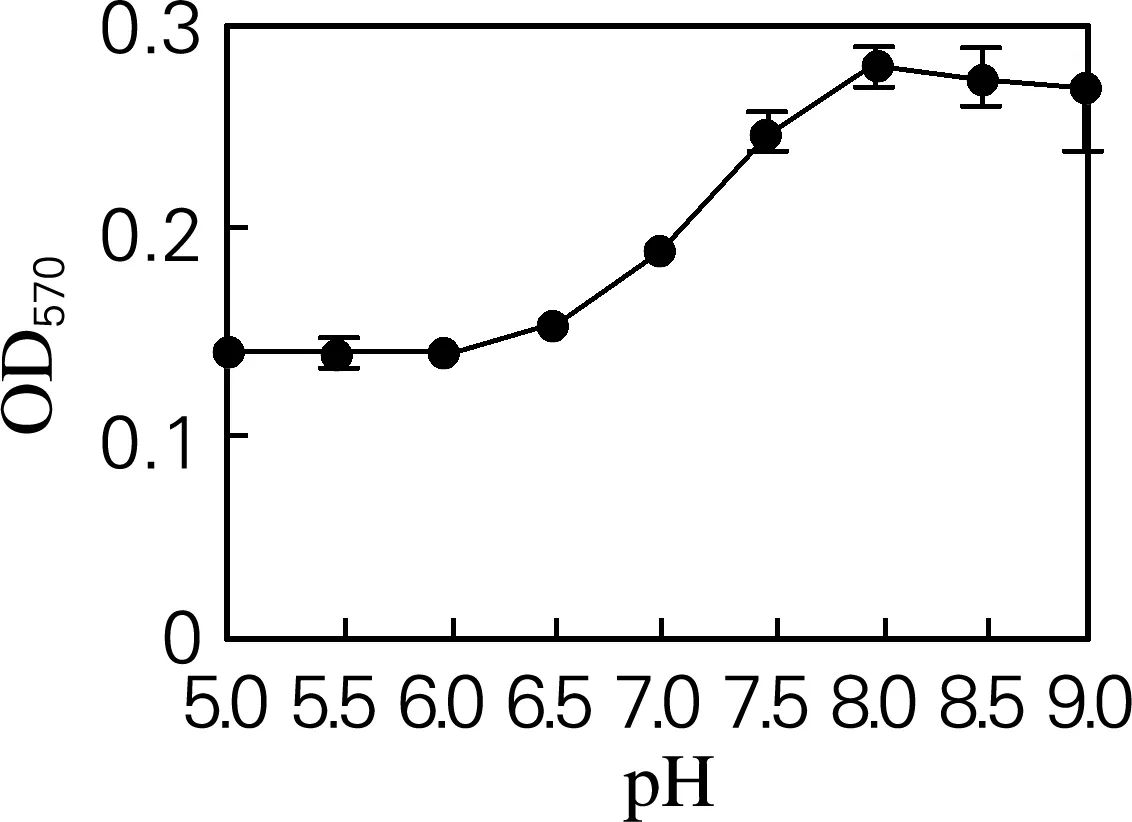
图3 pH对游离氨基酸量的影响
底物pH的选择基于多方面综合考虑:一,pH影响酶促反应。酶促反应速率受环境pH的影响,其会影响底物分子的解离状态,从而影响酶与底物的结合;pH也会影响酶分子的解离状态,特别是酶活性中心有关基团的解离,或者是维持酶的空间结构的有关基团的解离,从而影响酶与底物的结合;pH可能影响中间复合物的解离状态,影响中间复合物分解产生产物;过高或者过低的pH条件甚至会导致酶蛋白变性而失活[14-15]。二,pH影响茚三酮显色反应。茚三酮显色反应也受环境pH的影响,当pH在4以下时不显色,而pH在6~10时,颜色变化明显[16]。三,pH对游离氨基酸量的影响。游离氨基酸的来源可能是由于酶分子电荷失衡导致氨基酸脱落,体系的pH对酶分子电荷有影响。
2.4 蔗糖酶质量分数
不同蔗糖酶质量分数下茚三酮反应液的吸光值变化如图4所示。从图4可以看出,随着蔗糖酶质量分数的增大,反应液的吸光度也逐渐增加,但增长率逐渐降低,考虑到蔗糖酶成本、分光光度计的检测范围以及吸光度增长率等因素,可选择酶质量分数0.08%~0.20%,本实验中选择0.1% 为酶促反应条件。
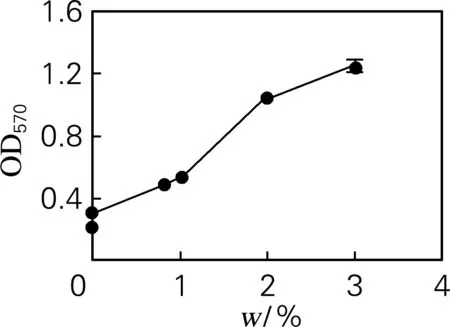
图4 蔗糖酶溶液质量分数对游离氨基酸量的影响
Fig.4 The effects of sucrose enzyme concentrations on the amounts of free amino acids
当酶促反应体系的温度、pH不变、底物过量时,酶量与酶促反应的速度成正比关系,在底物过量的情况下,酶量越大,则生成的中间产物越多,反应速度也就越快。如果反应体系中底物不足,酶过量也不会加大酶促反应的速度[17]。在2min内0.02%的蔗糖酶对0.25%的蔗糖是过量的,因此在此基础上,随着酶浓度的增加,酶促反应的速率也不会增加,因此随着酶量的增加反应液的吸光度增长率也不会增加。
2.5 标准曲线的制作
0.1%的蔗糖酶分别与pH为8不同浓度梯度的蔗糖溶液,在50 ℃温度下反应3min,测定不同浓度蔗糖溶液对应茚三酮反应液吸光度变化。结果表明,蔗糖溶液质量分数在0.02%~0.08% 与其吸光度呈线性关系,线性回归方程为y=351.67x+0.021 7(R2=0.999 7)。
2.6 方法检出限的测定
以蔗糖酶为例,用相应缓冲液代替底物标准液,以酶、茚三酮与缓冲液混合溶液作参比测定吸光度,平行测定11次,计算空白液的标准偏差Sb=0.004 346,根据工作曲线斜率,计算出检出限C=37.07μg/mL。经计算,检测淀粉的方法检出限为1 317μg/mL。
2.7 精密度试验
以蔗糖酶为例,吸取3组不同浓度的蔗糖标准液测定吸光度。平行测定5次,得出S在0.094 5%~0.003 5%,RSD在1.75%~5.11%,而α-淀粉酶RSD在2.79%~5.88%,说明精密度良好。
2.8 干扰因素的测定
将蔗糖酶与除蔗糖以外的其他溶液,如DL-苹果酸溶液、淀粉溶液混合,在相同条件下进行测定,未出现吸光度的变化,表明由于酶的专一性,除底物之外的物质对测定并不产生干扰。
2.9 实际样品分析
称取质量分数为0.06%、0.07%、0.08%的蔗糖溶液,在已确定的最佳反应条件下进行酶促反应,测定反应液中的氨基酸质量分数,对应所述标准曲线,得出底物质量分数,并作样品加标回收率测定,结果见表1。如表1所示,加标回收率在96.32%~101.31%,而α-淀粉酶加标回收率在95.95%~100.40%。说明此方法的系统误差小,重现性好。

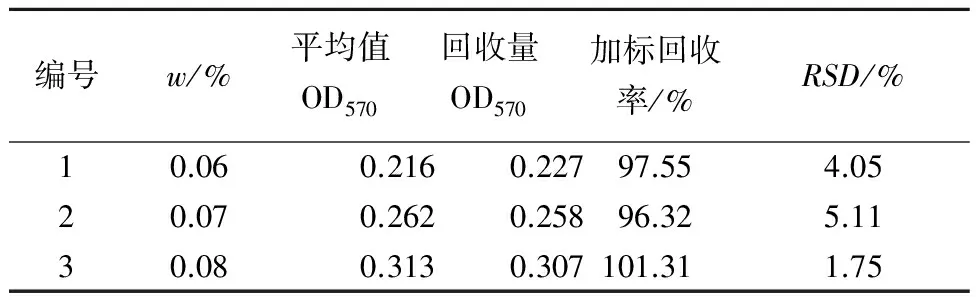
表1 蔗糖酶的验证性实验(n=5)
3 结 论
用分光光度法建立酶促反应检测底物含量的方法。以蔗糖酶为例,该方法的线性回归方程为y=351.67x+0.021 7(R2=0.999 7),方法检出限为37.07 μg/mL,相对标准偏差为2%~6%,加标回收率为96.32%~101.31%。淀粉酶同样有此现象,方法检出限、相对标准偏差、加标回收率分别为1 317 μg/mL、2.79%~5.88%、95.95%~100.40%。说明此方法系统误差小,测定数据准确,操作简便。
蔗糖酶、α-淀粉酶、糖化酶与己糖激酶均出现酶遇底物游离氨基酸增加的现象,由此推测此方法可能适用于大部分专一性的酶,根据此原理建立了一种利用酶促反应检测底物的新方法。
[1] 罗贵民.酶工程[M].北京:化学工业出版社,2008.
[2] 黄文风,蔡琪,林而立,等.酶催化动力学光度法快速测定蔬菜中的农药残留毒性[J].现代科学仪器,2002(2):29-30.
[3] 夏晓东,易平贵.基于蛋壳膜固定酶和纳米银膜光度法对葡萄糖的检测[J].分析测试学报,2009,28(12):1424-1427.
[4] 袁勤生.现代酶学[M].广州:华南理工大学出版社,2007.
[5] 周游,谭亚林,王晓玲,等.氨基酸分析方法[J].安徽农业科学,2012,40(24):11939-11941.
[6] LATERBACH J H. LC-UV-MS analysis of amino acids and amino sugars in flue-cured tobacco[C]. Lexington: Tobacco Chemists Research Conference, 1988.
[7] YANG S S, SMETENA I. Determination of free amino acids in tobacco by HPLC with fluorescence detection and precolumn derivatization[J]. Chromatographia, 1993, 37(11): 593-598.
[8] HEINRISON R L, MEREDITH S C. Amino acid analysis by reverse-phase high-performance liquid chromatography: precolumn derivatization with phenylisothiocyanate[J]. Analytical Biochemistry, 1984, 136(1): 65-74.
[9] 柴家荣,尚志强,字萍,等.白肋烟草间品种间游离氨基酸含量变化规律初探[J].氨基酸和生物资源,2002,24(1):54-56.
[10] YUEN C M, LIU D R. Dissecting protein structure and function using directed evolution[J]. Nature Methods, 2007, 4(12): 995-998.
[11] 谢渊.脂肪酶活性中心区域进化提高酶动力学稳定性和催化活性[D].长春:吉林大学,2014.
[12] 王镜岩,朱圣庚,徐长法.生物化学[M].3版.北京:高等教育出版社,2002.
[13] 陈守文.酶学[M].北京:科学出版社,2008.
[14] 侯倩倩.几类重要的酶催化反应的机理研究[D].济南:山东大学,2013.
[15] 陈宁.酶工程[M].北京:中国轻工业出版社,2011.
[16] 王昂,王丽丽,仪宏,等.茚三酮比色法测定谷氨酸含量的研究[J].中国调味品,2005,8(8):50-51.
[17] 郭勇.酶工程[M].北京:科学出版社,2009.
田维珍,周景辉.4种乙醇木素的抗氧化活性[J].大连工业大学学报,2016,35(6):437-440.
Spectrophotometry method to detect the substrate of enzymatic reaction
ZHOU Yanpin, WANG Jinhui, LI Ruilong, CHEN Ruihua, YU Zhimin, ZHAO Changxin
( School of Biological Engineering, Dalian Polytechnic University, Dalian 116034, China )
A new method for determination of enzymatic reaction substrates based on the phenomenon that free amino acids increased in the process of enzyme and substrate mixture was proposed. The effects of reaction temperature, pH, enzyme concentration on the free amino acids were investigated using invertase and α-amylase as the research object by ninhydrin colorimetry. Results showed that a good linearity between the amount of free amino acids and sucrose concentration was observed within the range of the sucrose mass fraction of 0.02%-0.08% with the linear equation in the optimum conditions of 50 ℃, pH=8 and 0.1% invertase. The detection limit was 37.07 μg/mL and the relative standard deviation was 1.75%-5.11%, while the method of standard addition recoveries were 96.32%-101.31%. The result of α-amylase was similar with invertase, of which the method detection limit, relative standard deviation and standard addition recovery rate were 1.317 mg/mL, 2.79%-5.88% and 92.82%-100.86%, respectively.
free amino acids; detection of substrate; invertase; α-amylase
2015-03-31.
国家自然科学基金资助项目(31401681).
周彦品(1990-),女,硕士研究生;通信作者:赵长新(1955-),男,教授.
Q55
A
1674-1404(2016)06-0433-04
ZHOU Yanpin, WANG Jinhui, LI Ruilong, CHEN Ruihua, YU Zhimin, ZHAO Changxin. Spectrophotometry method to detect the substrate of enzymatic reaction[J]. Journal of Dalian Polytechnic University, 2016, 35(6): 433-436.
