当归总酚酸的纯化工艺研究
2016-12-14邵建兵夏国华
邵建兵,刘 尖,汪 燕,夏国华,解 冰
·药学研究·
当归总酚酸的纯化工艺研究
邵建兵1,刘 尖2,汪 燕1,夏国华2,解 冰3*
目的 研究大孔树脂纯化当归总酚酸的工艺。方法 以阿魏酸和总酚酸含量为指标,比较不同树脂对阿魏酸和当归总酚酸的比吸附量和比洗脱量,筛选出最佳纯化树脂,并考察其纯化当归酚酸的最佳工艺条件及参数。结果 将多糖纯化中醇沉的上清液回收乙醇浓缩至1.2 g/mL,盐酸调pH至2,上HPD600大孔吸附树脂,上柱后水洗8 BV,70%乙醇洗脱8 BV。收集乙醇洗脱液,回收乙醇,浓缩,干燥得当归总酚酸组分,总酚酸纯度为58.27%,纯化转移率为87.02%。结论 HPD600大孔吸附树脂可以较好地纯化富集当归总酚酸。
当归;总酚酸;阿魏酸;大孔吸附树脂
0 引言
当归为伞形科植物当归Angelicasinensis(Dliv.)Diels的干燥根,为临床常用药,俗有“十方九归”之称,具有补血活血、调经止痛、润肠通便等功效。酚酸类物质为当归的主要有效部位[1-3],具有显著的抗氧化、清除自由基以及细胞保护作用,其中阿魏酸具有抗血小板凝集和血栓[4],抗氧化、清除自由基以及细胞保护作用,抗肿瘤,抗突变[5-6]等作用。但以阿魏酸为代表的该类成分在提取物中的纯度较低[7],因此,通过提取纯化技术改变当归制剂粗大黑外观和服用剂量过大的问题,是当归制剂现代研究的热点。
本实验以阿魏酸和当归总酚酸的含量为指标,以阿魏酸和当归总酚酸的比吸附量和比洗脱量为指标筛选出最佳纯化树脂,并考察其纯化当归酚酸母液的工艺条件及参数,为当归总酚酸的工业化生产提供理论依据。
1 仪器与材料
Agilent 1100高效液相色谱仪(美国安捷伦公司);十万分之一电子天平(德国METTLER TOLEOR公司);UV-2802型紫外可见分光光度计(上海尤尼克仪器有限公司);DZF-6051真空干燥箱(上海精宏实验设备有限公司)。
树脂购自上海摩速科学器材有限公司;延胡索乙素对照品(批号:0726-200208,供含量测定用),由中国药品生物制品检定所提供;醋延胡索(批号:080201),南京药业股份有限公司中药饮片厂;甲醇为色谱纯(美国OMNI公司),水为实验室自制超纯水,其余试剂均为国药(上海)试剂有限公司分析纯。
2 方法与结果
2.1 样品制备 取2 000 g当归超临界提取挥发油后,药渣加10倍水提取,每次2 h,合并滤液,浓缩至相对密度1.4,冷却至40 ℃用95%乙醇醇沉至醇浓度为70%,静置过夜,抽滤,合并滤液减压浓缩至1.6 g/mL,备用,测得阿魏酸含量为0.336 mg/g,总酚酸含量为12.655 mg/g。
2.2 阿魏酸含量测定
2.2.1 色谱条件 Agilent HC-C18(150 mm×4.6 mm,5 μm),流动相:MeOH-0.05%HAC(35∶65),流速1.0 mL/min,检测波长:320 nm,色谱图见图1。
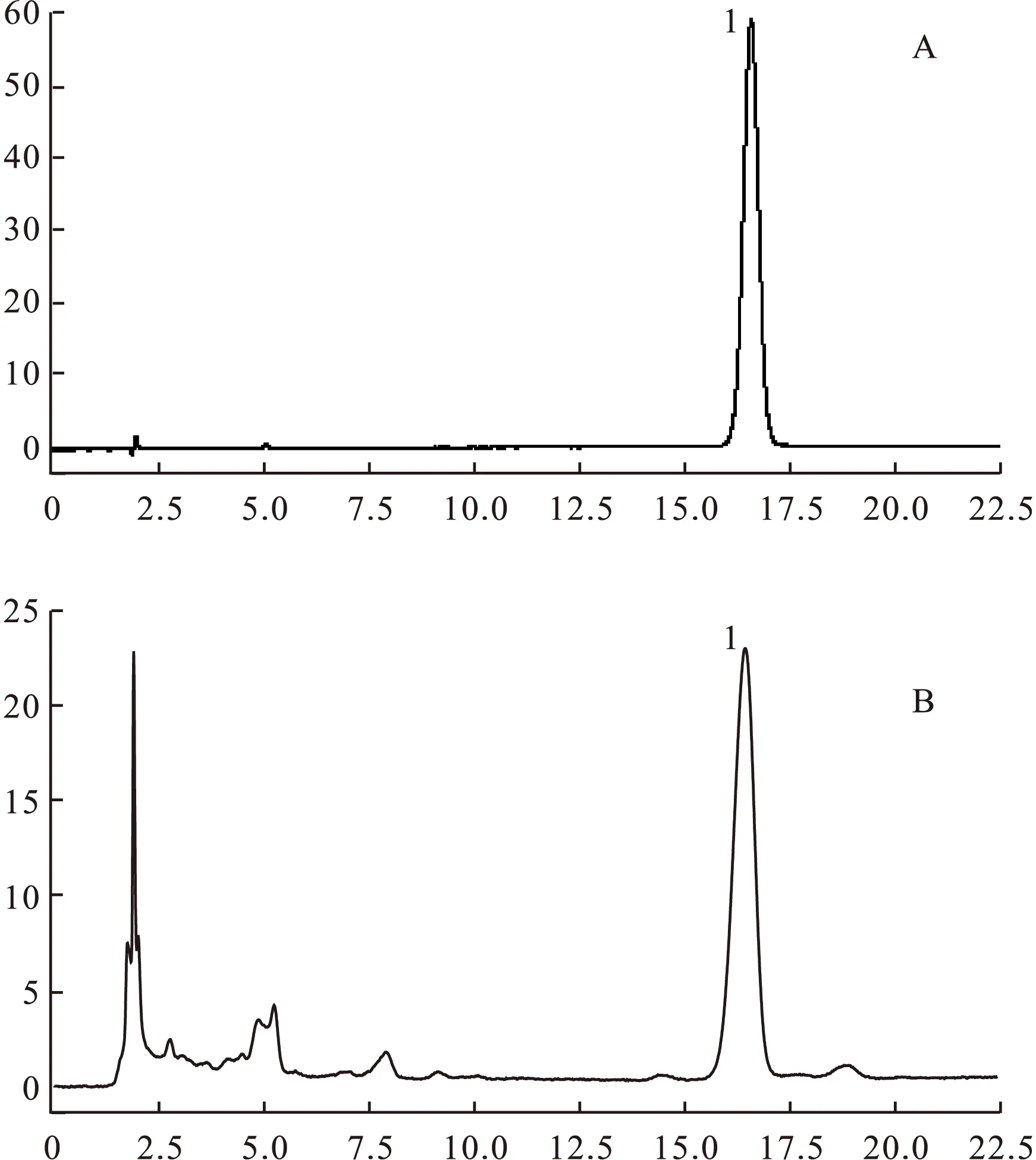
图1 HPLC色谱图
2.2.2 标准曲线 精密称取阿魏酸对照品4.785 mg至10 mL量瓶,用流动相定容,再精密吸取1.0 mL于25 mL容量瓶,用流动相定容得对照品溶液。分别吸取对照品溶液3、5、10、15、20、25、30、35 μL按上述色谱条件分别进样。以对照品进样量为横坐标(X),峰面积积分值为纵坐标(Y),绘制标准曲线,得回归方程,Y=49.577 X-15.147,r=0.999 9,表明阿魏酸在57.42~669.9 ng范围内线性良好。
2.2.3 样品的含量测定 取适量树脂洗脱液挥干,置10 mL量瓶用流动相定容,过0.45 μm的微孔滤膜后,精密吸取10 μL进样,计算阿魏酸含量。
2.3 当归总酚酸含量测定[8]
2.3.1 标准曲线的绘制 精密吸取阿魏酸对照品溶液0.6、0.8、1.0、1.2、1.4、1.6、1.8 mL置10 mL具塞试管,加甲醇至2 mL,加0.3%十二烷基硫酸钠0.8 mL,0.6%三氯化铁-0.9%铁氰化钾(1∶0.9)混合液0.4 mL,混匀,暗处放置5 min,加0.1 mol/L盐酸溶液至刻度,摇匀,暗处放置20 min,以显色剂为空白,720 nm波长下测定吸光度。以阿魏酸的浓度(X,μg/mL)为横坐标,吸光度(Y)为纵坐标,绘制阿魏酸对照品的标准曲线,得回归方程Y=0.017 34 X-0.071 3,R2=0.994 0,表明阿魏酸浓度在12.53~47.13 μg/mL范围内线性良好。
2.3.2 样品的含量测定 取适量树脂洗脱液挥干,甲醇定容至10 mL,参照标曲方法测定吸光度,计算其含量。
2.4 树脂预处理 各树脂用2 mol/L NaOH浸泡5 h,蒸馏水洗至中性后,用3 mol/L盐酸浸泡8 h,蒸馏水洗至中性,再用乙醇浸泡24 h充分溶胀,至醇洗液加5倍水无白色浑浊,最后用蒸馏水洗至无醇味,蒸馏水浸泡待用。所用树脂的物理参数见表1。

表1 所用树脂的物理结构参数
2.5 树脂的筛选 采用动态吸附法,称取处理过的上述湿树脂各5.0 g,湿法装柱,均上样20.00 mL(生药量:1.6 g/mL),流速0.5 mL/min,过柱流出液重吸附2次,静置2 h,用蒸馏水洗至流出液无色,以50%乙醇洗脱10 BV后,收集各洗脱液,测定阿魏酸和总酚酸的含量,按下式计算比吸附量和比洗脱量。结果见表2和表3。比吸附量=(上样量-水洗成分量)/干树脂重,比洗脱量=醇洗成分质量/干树脂重。
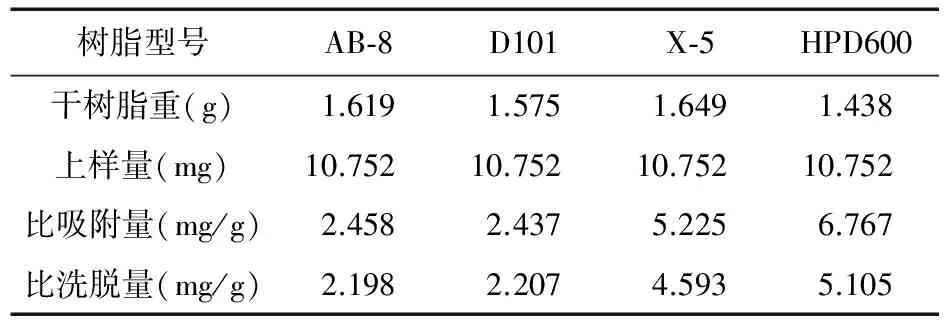
表2 4种型号大孔吸附树脂对阿魏酸的动态吸附性能比较(n=3)
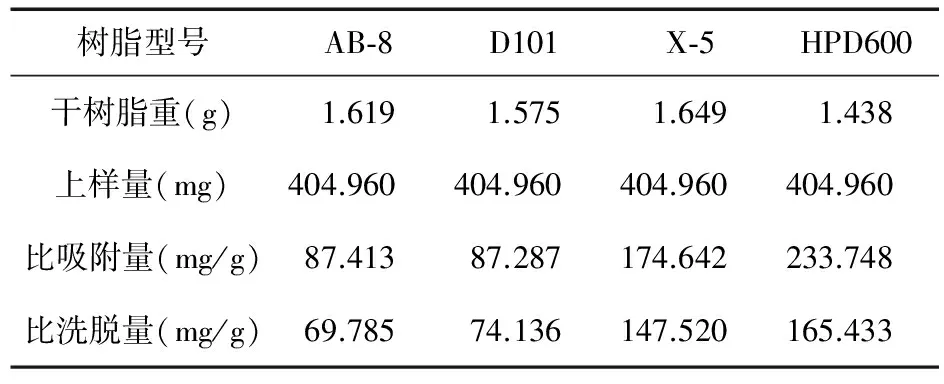
表3 4种型号大孔吸附树脂对总酚酸的动态吸附性能比较(n=3)
由表2、表3可以看出,不同类型的大孔吸附树脂对阿魏酸和总酚酸的动态吸附效果有较大的差异,其中HPD600各指标均优于其他3种。
2.6 上样浓度的考察 取3份样品液(生药量:1.6 g/mL)各20.00 mL,加水配制成浓度为0.8、1.2和1.6 g/mL的溶液,分别上湿重5.0 g HPD600大孔吸附树脂(干重1.438 g)柱,流速0.5 mL/min,过柱流出液重吸附2次,静置2 h,用蒸馏水洗至流出液无色,以50%乙醇洗脱10 BV后,收集各洗脱液,以总酚酸和阿魏酸的比吸附量(mg/g)和比洗脱量(mg/g)为指标,考察上样浓度。结果见表4。
由表4可以看出,上样液浓度为1.2 g/mL时,HPD600大孔吸附树脂对总酚酸和阿魏酸比吸附量和比洗脱量最佳。

表4 上样浓度考察
2.7 上样液pH值考察 取当归样品液(生药量:1.2 g/mL)30.0 mL,测得pH值为4.2,用盐酸和氢氧化钠调pH值分别为2、4、6、8、10[9],分别上湿重5.0 g HPD600大孔吸附树脂(干重1.438 g)柱,流速0.5 mL/min,过柱流出液重吸附2次,静置2 h,用蒸馏水洗至流出液无色,以50%乙醇洗脱10 BV后,收集各洗脱液。以总酚酸和阿魏酸的比吸附量(mg/g)及比洗脱量(mg/g)为指标,考察上样pH值。结果见表5。
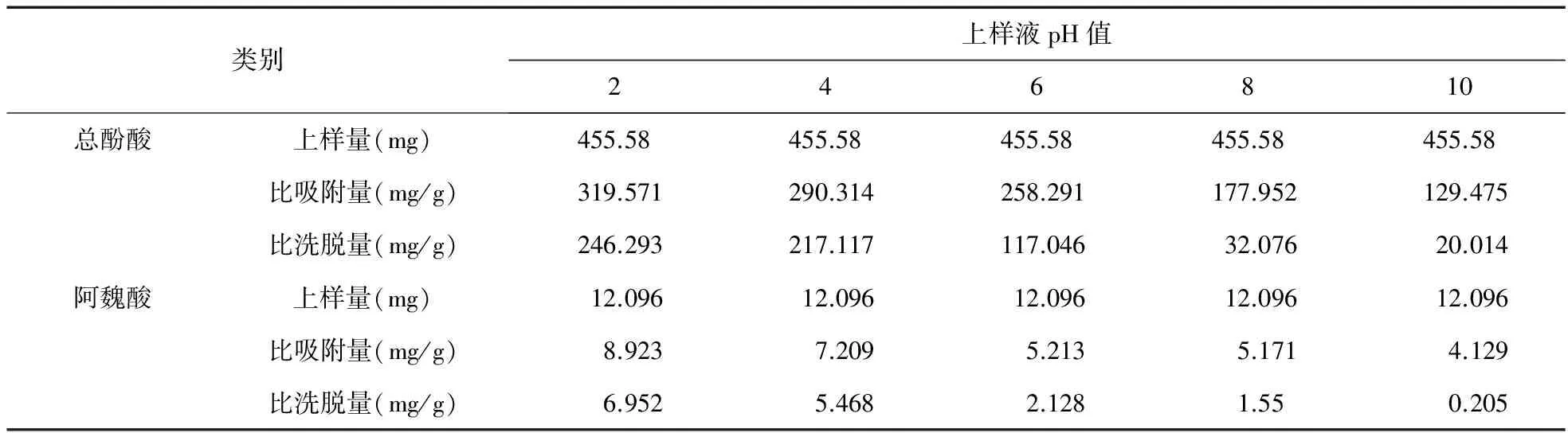
表5 上样液pH考察
从表5可以看出,上样液pH值为2时,HPD600大孔吸附树脂对总酚酸和阿魏酸比吸附量和比洗脱量最佳。
在上样液浓度为1.2 g/mL,pH值为2,以阿魏酸为指标时,每克干HPD600大孔吸附树脂吸附26.557 g生药,以当归总酚酸为指标时,每克干HPD600大孔吸附树脂吸附25.252 g生药,为尽量保留有效组分,选择以当归总酚酸为指标下的饱和吸附量作为生药的最佳吸附量,即25.252 g/g。
2.8 水洗体积考察 按当归总酚酸的饱和吸附量上样,精密吸取样品液(1.2 g/mL)30.26 mL,用盐酸调pH值为2,加至湿的5.0 g HPD600大孔吸附树脂(折合干树脂1.438 g)柱,以0.5 mL/min的流速进行动态吸附,过柱流出液重吸附2次,静置2 h。以蒸馏水冲洗,按1 BV收集,检测Molish反应,结果见表6。

表6 水洗液Molish反应结果
注:++表示强阳性,+表示阳性,—表示阴性
由表6可知,水洗至8 BV时,大部分杂质已经洗脱,确定上柱后最佳水洗体积为8 BV。
2.9 洗脱剂浓度的考察 精密吸取当归样品液(1.2 g/mL)30.26 mL,用盐酸调pH值为2,加至湿的5.0 g HPD600大孔吸附树脂(折合干树脂1.438 g)柱,以0.5 mL/min的流速进行动态吸附,过柱流出液重吸附2次,静置2 h,先用蒸馏水洗脱8 BV后,依次用20%乙醇、30%乙醇、50%乙醇、70%乙醇、95%乙醇各6 BV洗脱,洗脱液流速为1.0 mL/min,测定洗脱液中总酚酸和阿魏酸的含量,计算洗脱率。结果见表7。
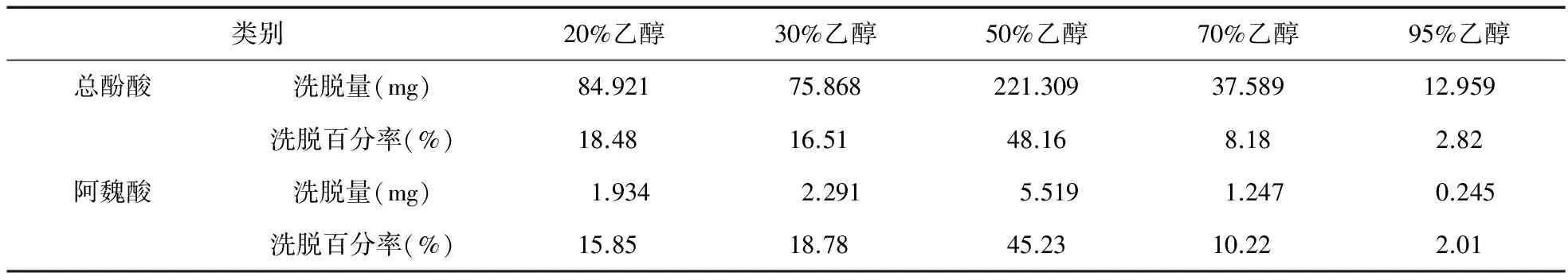
表7 洗脱溶剂浓度考察
由表7可以看出,总酚酸主要集中在50%乙醇部分,总洗脱百分率达到79.87%,70%还可洗下8.18%;阿魏酸主要集中在50%乙醇部分,总洗脱百分率达到83.15%,70%还可洗下10.22%。综合考虑溶剂用量和洗脱百分率,选择70%乙醇作为洗脱溶剂。
洗脱曲线的绘制:精密吸取样品液(1.2 g/mL)30.26 mL,用盐酸调pH值为2,加至湿的5 g HPD600大孔吸附树脂(折合干树脂1.438 g)柱,以0.5 mL/min的流速进行动态吸附,过柱流出液重吸附2次,静置2 h。先用蒸馏水洗脱8 BV,用70%乙醇洗脱,按1、2、3、4、5、6、7、8、9、10、11、12 BV进行收集。分别测定总酚酸和阿魏酸的含量,并分别以总酚酸和阿魏酸的比洗脱量为纵坐标(mg/g),洗脱柱体积(BV)为横坐标绘制总酚酸和阿魏酸的洗脱曲线,见图2。
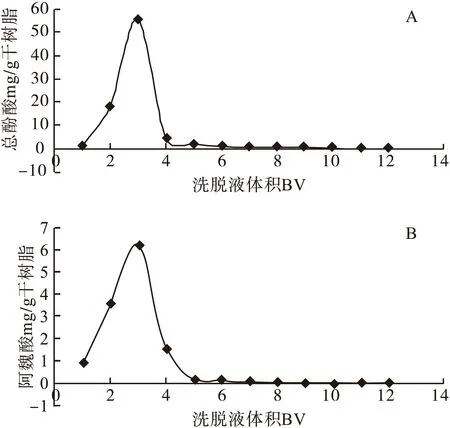
图2 70%乙醇洗脱曲线
由图2可以看出,用70%乙醇洗脱8 BV时,总酚酸洗脱百分率达到95.86%,阿魏酸的洗脱百分率达到96.72%,已基本洗脱完全。
验证试验:吸取样品液1.2 g/mL,盐酸调pH值为2,体积为302.60 mL,加至已处理好的装有50 g湿HPD600大孔吸附树脂柱,调节流速为0.5 mL/min,过柱流出液重吸附2次,静置2 h,用蒸馏水洗脱8 BV,用70%乙醇洗脱8 BV,收集乙醇洗脱液,回收乙醇,60 ℃真空干燥。测定阿魏酸和总酚酸含量及各自占干膏的比例。结果见表8。
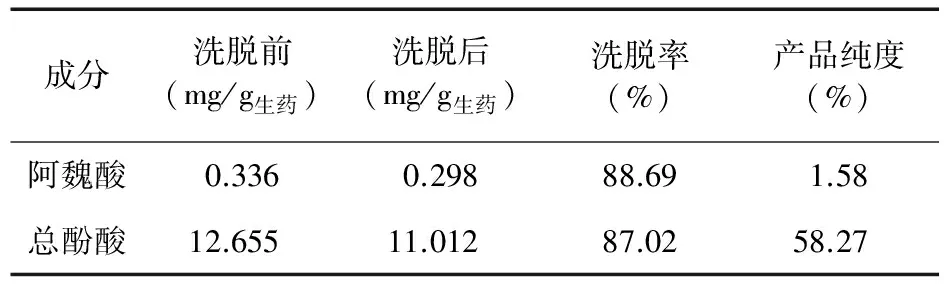
表8 验证试验结果
3 结论与讨论
3.1 HPD600树脂纯化当归提取挥发油后水提液的醇沉上清液中总酚酸的最佳工艺条件:每克干树脂吸附25.252 g生药,上样药液最佳浓度为1.2 g/mL,最佳pH值为2,上柱后水洗8 BV,70%乙醇洗脱8 BV。该工艺经验证,终产品总酚酸纯度为58.27%,纯化转移率为87.02%,该工艺稳定可靠,可较好地提取纯化当归中总酚酸。
3.2 先前研究中[7,10]采用乙醇直接提取后直接纯化得到当归总酚酸,而当归中挥发油、总多糖、总酚酸都具有显著的药理活性[11-13],本研究充分考虑生药资源的综合利用,分步提取挥发油、总多糖和总酚酸,而且乙醇直接提取得到的浸膏黏稠度太高,不利于纯化。
3.3 在设计当归各组分提取分离纯化路线的过程中,有两种不同的方法,一种是将当归粉末提取挥发油后的药渣水提液浓缩、醇沉后取沉淀作为粗多糖,将上清液醇沉上清液回收乙醇作为酚酸母液;一种是将当归粉末提取挥发油后的药渣水提液浓缩直接作为酚酸母液,将酚酸母液上树脂纯化后的水洗液作为多糖母液,浓缩醇沉取沉淀作为粗多糖。本研究在对两种方法进行比较,后一种方法的缺点是:当归提取挥发油后的药渣水提液浓缩至0.5 g/mL时已经非常黏稠,容易堵塞树脂柱,不利于有效组分的吸附。本研究经过实验比较后,对当归酚酸和总多糖的提取纯化路线采用前一种方法,减少了浓缩、回收乙醇的次数,并且当归酚酸母液在醇沉前后含量测定比较损失很小,醇沉前为0.340 mg/g,醇沉后为0.336 mg/g。
3.4 总酚酸含量测定过程中,按照标曲显色方法处理后,UV-2802型紫外可见分光光度计进行全波长扫描,在720 nm处有最大吸收峰,故选择检测波长为720 nm。
[1]杜俊蓉,白波,余彦,等.当归挥发油研究新进展[J].中国中药杂志,2005,30(18):1400-1405.
[2]扬帆,肖远胜,章飞芳,等.当归化学成分的HPLC-MS/MS分析[J].药学学报,2006,41(11):1078-1083.
[3]Lu XH,Zhang JJ,Liang H,et al.Chemical constituents of angelica sinensis[J].J Chin Pharmaceut Sci,2004,13(1):1-3.
[4]黄丰阳,徐秋萍.中药有效成分的抗血小板作用研究进展[J].北京中医药大学学报,1999,22(2):28.
[5]Kawabata K,Yamamoto T,Ham A,et al.Modifying effects of ferulic acid on azoxymethane-induced colon carcinogenesis in F344 rats [J].Cancer Lett,2000,157(1):15-21.
[6]Ogiwara T,Satoh K,Kadoma Y,et al.Radical scavenging activity and cytotoxicity of ferulic acid [J].Anticancer Res,2002,22(5):2711-2717.
[7]吴军,陈晨,武洁,等.大孔吸附树脂纯化当归酚酸类成分的工艺研究[J].中国中医药科技,2014,21(2):164-166.
[8]王进,崔宇姣,王艳玲.HPLC法测定当归龙荟片中阿魏酸的含量[J].实用药物与临床,2009,12(1):30-31.
[9]孙锦秀.大孔吸附树脂纯化桑黄总黄酮工艺[J].实用药物与临床,2012,15(11):744-746.
[10]杨银花,赵博琛,兰颐,等.当归酚酸类成分提取、富集工艺研究[J].北京中医药大学学报,2013,3(9):627-632.
[11]扬帆,肖远胜,章飞芳,等.当归化学成分的HPLC-MS/MS分析[J].药学学报,2006,41(11):1078-1083.
[12]杨铁虹,贾敏,梅其炳.当归多糖组分AP-3诱导小鼠脾细胞IL-2和IFN-γ的作用[J].药学学报,2006,41(1):54-57.
[13]齐群霞,张文霞.养血当归胶囊治疗功能性痛经的临床疗效及安全性研究[J].实用药物与临床,2013,16(12):1222-1224.
Purification technology of total phenolic acid from angelica
SHAO Jian-bing1,LIU Jian2,WANG Yan1,XIA Guo-hua2,XIE Bing3*
(1.Department of Pharmacy,Rugao People′s Hospital,Rugao 226500,China;2.School of Pharmacy,Jiangsu University,Zhenjiang 212013,China;3.Department of Laboratory,Zhenjiang Dantu Hospital of Traditional Chinese Medicine,Zhenjiang 212028,China)
Objective To study the purification technology of total phenolic acid from angelica by macroporous resin.Methods The contents of phenolic acid and ferulic acid were chosen as the reference,and the optimum macroporous resin was selected by comparing adsorptive capabilities and desorption ratio in 4 kinds.The purification technology was optimized.Results The ethanol from supernatant of polysaccharides alcohol purification was condensed to 1.2 g/mL,the pH value of hydrochloric acid was adjusted to 2,and then it was purified by macroporous adsorptive resins HPD600 and washed by water for 8 BV and 70% ethanol for 8 BV.The 70% ethanol eluant was collected,and the angelica total phenolic acid was obtained after recovering,condensing and drying ethanol,and the purity was 58.27%,and purification of transfer was 87.02%.Conclusion HPD600 resin can be used to enrich and purify total phenolic acid from angelica.
Angelica;Total phenolic acid;Ferulic acid;Macroporous resin
2016-04-05
1.如皋市人民医院药剂科,江苏 如皋 226500;2.江苏大学药学院,江苏 镇江 212013;3.镇江市丹徒区中医院检验科,江苏 镇江 212028
镇江市重点研发计划(HS2015075);江苏大学大学生科研立项项目
10.14053/j.cnki.ppcr.201611021
*通信作者
