右美托咪定不同处理方式对大鼠局灶性脑缺血再灌注损伤的干预研究
2016-12-14唐春永夏乐强
唐春永,王 瑛,夏乐强
右美托咪定不同处理方式对大鼠局灶性脑缺血再灌注损伤的干预研究
唐春永,王 瑛,夏乐强
目的 通过大鼠右侧大脑中动脉阻闭再灌注模型,探讨右美托咪定(Dex) 3种不同干预方式对大鼠局灶性脑缺血再灌注脑损伤的影响、机制及差异性。方法 将100只健康雄性SD大鼠随机分为5组:假手术组(Sham组)、缺血再灌注组(I/R组)、Dex预处理组(Dex1组)、Dex后处理组(Dex2组)和Dex预处理联合后处理组(Dex3组),每组20只。应用Dex对动物模型做预处理、后处理、预处理联合后处理3种方式的干预,并检测各组大鼠脑组织超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量以及血清神经元特异性烯醇化酶(NSE)含量。结果 ①与Sham组比较,其他4组大鼠脑组织SOD活性降低,MDA含量升高,血清NSE含量升高(P<0.05)。②与I/R组比较,3个Dex组脑组织SOD活性均显著升高,MDA含量降低,血清NSE含量降低(P<0.05)。③Dex1组、Dex3组脑组织MDA含量和血清NSE含量低于Dex2组(P<0.05);Dex3组脑组织MDA和血清NSE含量低于Dex1组(P<0.05);Dex3组脑组织SOD活性高于Dex2组(P<0.05)。结论 三种不同干预方式的Dex处理均能减轻局灶性脑缺血再灌注损伤。Dex预处理联合后处理能够产生效果更佳的脑缺血再灌注损伤保护作用。Dex抑制过度氧化应激反应,减少过量氧自由基生成,可能是其脑缺血再灌注损伤的保护作用机制之一。
右美托咪定;脑缺血再灌注损伤;预处理;后处理
0 引言
大脑是对缺氧最敏感的人体器官,而脑缺血后再灌注是一把双刃剑,一方面可以恢复血供,使缺血区的机能得到一定程度的恢复;另一方面,是由再灌注引发的氧自由基蓄积、兴奋性氨基酸的神经毒性、钙超载等引发并加重了缺血脑细胞的进一步损伤[1-2]。右美托咪定(Dexmedetomidine,Dex)作为一种新型的α2肾上腺素能受体(α2-AR)激动剂,激动α2-AR具有高效和高选择性。Dex对脑缺血再灌注损伤(CIRI)有一定保护作用,可能的机制包括:降低儿茶酚胺水平,减少兴奋性神经递质的释放以及调节细胞凋亡途径等[3-7],但其确切的保护作用机制仍未完全阐明,而且临床用药最佳剂量、时间和方式也不明确,仍有待进一步的研究。
本实验通过改良线栓法制作大鼠右侧大脑中动脉阻闭(Middle cerebral artery occlusion,MCAO)再灌注模型,模拟人体急性脑缺血再灌注损伤病理生理过程,同时应用Dex预处理、后处理、预处理联合后处理3种方式作为干预措施,从相关分子水平探讨Dex 3种不同干预方式处理对大鼠局灶性CIRI的影响、机制及其差异性,推测其可能具有的保护作用机制,为Dex能够更安全可靠地应用于临床脑血管疾病患者和围术期脑缺血高危患者提供一种明确有效的治疗方法及安全用药参考依据。
1 资料与方法
1.1 一般资料 选择100只日龄为49~63 d、体重为250~300 g的健康雄性SD大鼠。所有大鼠于动物手术室内适应性喂养7 d,均给予自由饮水和标准动物饲料喂养。将手术室空调温度设置维持在23 ℃左右。术前12 h禁食,不禁水。试剂:右美托咪定注射液(2 mL,200 μg,批号:2014030732,配制Dex浓度为10 μg/mL),ELISA试剂盒等。
1.2 方法 所有大鼠称重、编号后,查取随机数表,分为5组,每组20只。参照改良 Zea Longa[8]方法,采用线栓技术进行大鼠MCAO模型制作。模型制作成功后,按实验方案继续进行。若有大鼠出现死亡,或者栓线插入深度过短(<16 mm),并且无明显神经功能缺损表现、手术时出血过多、症状较重等情况,均予以剔除,并以同批次预留SD大鼠随机补充制作模型。
①假手术组(Sham组):假手术操作前30 min腹腔注射0.9% NS 5 mL/kg,分离出血管后经右侧颈内动脉置入线栓9 mm,不进入大脑中动脉。假手术操作完成后8 h,腹腔注射0.9% NS 5 mL/kg,再观察19 h。②缺血再灌注组(I/R组):于MCAO模型制作前30 min腹腔注射0.9% NS 5 mL/kg,然后制备MCAO模型,完成右侧大脑中动脉阻闭缺血3 h,于恢复再灌注后5 h给予腹腔注射0.9% NS 5 mL/kg,再灌注共24 h。③Dex预处理组(Dex1组):于MCAO模型制作前30 min腹腔注射Dex 50 μg/kg,然后制备MCAO模型,完成右侧大脑中动脉阻闭缺血3 h,于恢复再灌注后5 h给予腹腔注射0.9%NS 5 mL/kg,再灌注共24 h。④Dex后处理组(Dex2组):于MCAO模型制作前30 min腹腔注射0.9% NS 5 mL/kg,然后制备MCAO模型,完成右侧大脑中动脉阻闭缺血3 h,于恢复再灌注后5 h给予腹腔注射Dex 50 μg/kg,再灌注共24 h。⑤Dex预处理联合后处理组(Dex3组):于MCAO模型制作前30 min腹腔注射Dex 50 μg/kg,然后制备MCAO模型,完成右侧大脑中动脉阻闭缺血3 h,于恢复再灌注后5 h给予腹腔注射Dex 50 μg/kg,再灌注共24 h。
1.3 观察指标 采用ELISA法测定各组大鼠脑组织超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量以及血清神经元特异性烯醇化酶(NSE)含量。
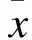
2 结果
2.1 五组大鼠一般情况比较 各组大鼠的体重、日龄比较差异均无统计学意义(P>0.05),见表1。
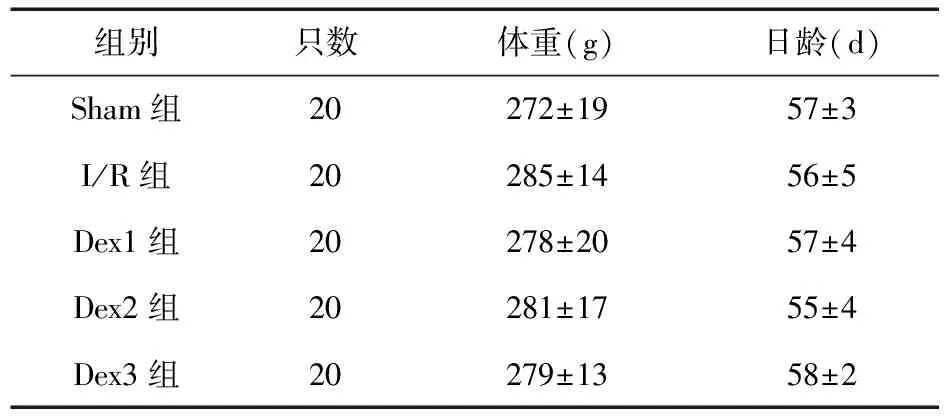
表1 5组大鼠体重和日龄情况
2.2 动物模型存活情况及剔除结果 Zea等[8]于1989年对大鼠MCAO的模型制作进行了改进,以制作更简便、创伤更小、不开颅、易掌控、重复性好、模拟度高以及脑损伤稳定等优势,成为目前最主要的动物CIRI模型制作方法。本研究中,I/R组1例死亡,Dex3组1例栓线插入深度过短,予以剔除并做补充。
2.3 各组实验大鼠术后NSE、SOD和MDA情况 与Sham组比较,I/R组、Dex1组、Dex2组和Dex3组脑组织SOD活性降低,MDA含量升高,血清NSE含量升高,差异均有统计学意义(P<0.05)。与I/R组比较,Dex 3种不同干预方式处理组的脑组织SOD活性显著升高,MDA含量降低,血清NSE含量降低,差异均有统计学意义(P<0.05)。Dex1组和Dex3组脑组织MDA含量和血清NSE含量低于Dex2组(P<0.05);Dex3组脑组织MDA和血清NSE含量低于Dex1组(P<0.05),脑组织SOD活性高于Dex2组(P<0.05);但Dex2组、Dex3组的脑组织SOD活性与Dex1组比较差异无统计学意义(P>0.05)。见表2。

表2 五组大鼠NSE含量、SOD活性和MDA含量比较
注:*与Sham组比较,P<0.05;#与I/R组比较,P<0.05;△与Dex2组比较,P<0.05;▲与Dex1组比较,P<0.05
3 讨论
人体大脑作为一个高灌注、高氧耗、高代谢和能量低储备的重要生命器官,对缺血缺氧的耐受能力十分有限[9]。因此,寻找一种能够更安全可靠地应用于临床脑血管疾病患者和围术期脑缺血高危患者的治疗方法,对有效防治CIRI、降低患者伤残率及死亡率具有重要意义。
CIR时,正常体内的自由基产生和清除平衡被打破,体内自由基清除系统功能障碍,导致氧自由基大量产生并蓄积,而且病理性连锁式地引发脂质过氧化,产生大量有毒性的脂质过氧化产物,是导致IRI的主要机制之一[10],其中以产生的MDA毒性最大。SOD作为人体内最主要的自由基清除剂和抗氧化酶,能够确保机体及时有效地清除过量的氧自由基,保护器官组织[11]。因此,SOD活力可间接反映机体清除氧自由基的能力[12-13],而MDA含量可间接反映机体组织细胞受到自由基攻击损伤的程度、脂质过氧化以及氧自由基水平[14]。本研究中,除Sham组之外,I/R组、Dex1组、Dex2组和Dex3组脑组织SOD活性降低,MDA含量升高,推测为MACO模型在CIR后,大量氧自由基产生并蓄积,同时SOD也反应性地产生增加,而后不断受到消耗、抑制以及代谢合成功能障碍,导致SOD的质和量降低。
NSE特异性定位于神经元内,神经元损伤、坏死主要引起初期NSE血清水平的急性增高,NSE持续增高可能与继发性的脑损伤有关,其释放水平的值与神经元损伤数量和程度相关[15]。本研究中,3个Dex组大鼠的血清NSE水平高于Sham组,但均较I/R组降低,并以Dex3组降低最为明显,证实Dex具有神经保护作用。Dex组的脑组织SOD活性高于I/R组,MDA含量低于I/R组,并以Dex3组最为明显,表明Dex神经保护作用机制之一可能是通过抑制过量氧自由基生成、减少氧自由基蓄积、减轻脂质过氧化反应等实现的。预处理组和预处理联合后处理组的NSE低于后处理组,其原因可能在于:后处理虽然能够通过模拟缺血后处理(IPostC)效应,激发机体产生内源性保护机制,可以使脑组织产生缺血缺氧耐受,减轻CIRI,但本实验给予Dex后处理时,CIRI已经历8 h,已经造成了一定的脑损伤,而预处理是在CIRI之前给予Dex,提前通过模拟缺血预处理(IPC)效应激发机体产生内源性保护机制,使脑组织产生缺血缺氧耐受,从而更有利于减轻CIRI。预处理联合后处理则可能是在二者CIRI保护作用的协同或者叠加之下共同发挥保护作用。
本研究中大鼠MCAO模型的阻闭时间为3 h。有研究表明,对于大鼠脑缺血再灌注模型,若MCAO模型的阻闭缺血时间较短(<1 h),恢复再灌注后,大鼠脑梗死面积存在较大的个体差异;如果给予MCAO模型的阻闭缺血时间较长(>3 h),恢复血液灌注后,在神经缺损症状和脑梗死面积方面与无血液再灌注的大鼠相比无明显差异[16-17]。研究证实,脑梗死体积与缺血时间存在显著的相关性。通常认为,脑梗死出现的时间点为缺血后1 h,随着血液再灌注的恢复以及再灌注损伤的发生和发展,脑损伤达峰时间点约为72 h[18]。此外,研究发现,大鼠CIRI所致的神经细胞凋亡高峰时间为24~48 h[19],故本实验选择MCAO模型阻闭再灌注24 h后进行血清NSE含量、脑组织SOD活性和MDA含量的测定。有研究发现,在动物脑缺血模型中,Dex的神经保护作用具有一定剂量依赖性,产生神经保护效应的有效剂量范围为1~100 μg/kg[20-22],故本实验选取的应用剂量为50 μg/kg。Dex的神经保护作用在研究机械性脑创伤的动物模型中同样得到证实,研究表明,Dex可能通过激活细胞外调节蛋白激酶(ERK)产生神经保护性作用,而加入ERK的抑制剂后该作用则被拮抗[23]。Degos等[24]研究证实,Dex可以通过作用于星型胶质细胞上的α2受体,促进星型胶质细胞对谷氨酸的摄取及降解。侯冠峰等[25]同样在大鼠CIRI模型实验中发现,预先给予小剂量Dex可使CIRI减轻,而大剂量Dex则不具备此作用。在星形细胞培养模型研究中,Dex可通过激动α2A-AR刺激GDNF的释放,从而产生神经保护作用[26]。在临床上,柏晓漫等[27]将Dex应用于颈内动脉瘤夹闭手术患者,发现Dex可提供稳定的血液动力学,提高脑氧摄取率并改善脑氧合功能。Dong等[28]发现,应用Dex可以减轻止血带所引起的IRI,认为Dex具有抑制脂质过氧化作用,同时提高内源性抗氧化酶水平。
4 展望
CIRI是多种损伤因子、多个病理性损伤连锁反应以及多条信号级联通路彼此关联、共同作用的综合结果,参与损伤的途径和相关因子众多,过程复杂,而本研究只对个别因子进行不完全定量检测,因此,要阐明Dex对CIRI确切完整的保护作用机制,使Dex更安全可靠地应用于临床脑血管疾病患者和围术期脑缺血高危患者,仍有待进一步研究。
[1]Yalcin S,Aydogan H,Kucuk A.Supplemental oxygen in elective cesarean section under spinal anesthesia:handle the sword with care[J].Braz J Anesthesiol,2013,63(5):393-397.
[2]Zhou HY,Zhang LN,Zheng MZ,et al.Improved myocardial function with supplement of levosimendan to Celsior solution[J].J Cardiovasc Pharmacol,2014,64(3):256-265.
[3]Hoffman W,Kochs E,Werner C,et al.Dexmedetomidine improves neurologic outcome from incomplete ischemia in the rat:reversal by the a2-adrenergic antagonist atipamezole[J].Anesthesiology,1991,75:328-332.
[4]Eser O,Fidan H,Sahin O,et al.The influence of dexmedeto- midine on ischemic rat hippocampus[J].Brain Res,2008,1218:250-256.
[5]Cosar M,Eser O,Fidan H,et al.The neuroprotective effect of dexmedetomidine in the hippocampus of rabbits after subarachnoid hemorrhage[J].Surg Neurol,2009,71:54-59.
[6]Sanders R,Xu J,Shu Y,et al.Dexmedetomidine attenuates isoflurane-induced neurocognitive impairment in neonatal rats[J].Anesthesiol,2009,110(5):1077-1085.
[7]Nakano T,Okamoto H.Dexmedetomidine-induced cerebral hypoperfusion exacerbates ischemic brain injury in rats[J].J Anesth,2009,23:378-384.
[8]Zea LE,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[9]Fan Y,Yang GY.Therapeutic angiogenesis for brain ischemia:A brief review[J].J Neuroimm Pharmacol,2007,2:284-289.
[10]Konishi T.Brain oxidative stress as basic target of antioxidant traditional oriental medicines[J].Neurochem Res,2009,34(4):711-715.
[11]Zheng W,Huang LZ,Zhao L,et al.Superoxide dismutase activity and malondialdehyde level in plasma and morphological evaluation of acute severe hemorrhagic shock in rats[J].Am J Emerg Med,2008,26(1):54-59.
[12]Liu PH,Yang LH,Wang TY,et al.Proximity of lesioning determines response of facial motoneurons to peripheral axotomy[J].J Neurotrauma,2006,23(12):1857-1873.
[13]Nishi T,Maier CM,Hayashi T,et al.Superoxide dismutase 1 overexpression reduces MCP-1 and MIP-1 alpha expression after transient focal cerebral ischemia[J].J Cereb Blood Flow Metab,2005,25(10):1312-1324.
[14]KimuraKS,Kanaya N,Kamada N,et al.Cardioprotective effect and mechanism of action of landiolol on the ischemic reperfused heart[J].Anesth,2007,21:480-489.
[15]Anand N,Stead LG.Neuron-specific enolase as marker for acute ischemic stroke:a systematic review[J].Cerebrovasc Dis,2005,20:213-219.
[16]Kawamura S,Li Y,Shirasawa M,et al.Reversible middle cerebral artery occlusion in rats using an intraluminal thread technique[J].Surg Neurol,1994,41(5):368-373.
[17]Memezawa H,Minamisawa H,Sinith ML,et al.Ischemic penumbra in a model of reversible middle cerebral artery occlusion in the rat[J].Exp Brain Res,1992,89(1):67-78.
[18]Van Lookeren CM,Thomas GR,Thibodeaux H,et al.Secondary reduction in the apparent diffusion coefficient of water,increase in cerebral blood volume,and delayed neuronal death after middle cerebral artery occlusion and early reperfusion in the rat[J].J Cereb Blood Flow Metab,1999,19(2):1354-1364.
[19]王越晖,孟召祥,汪林,等.大鼠脑缺血再灌注损伤后 NF-KB 蛋白、Caspase-3mRNA表达及细胞凋亡的研究[J].中风与神经疾病杂志,2004,21(3):208-210.
[20]Sanders RD,Maze M.Alpha2-adrenoceptor agonists.Curr Opin Investig Drugs,2007,8(1):25-33.
[21]Jolkkonen J,Puurunen K,Koistinaho J,et al.Neuroprotection by the alpha2-adrenoceptor agonist,dexmedetomidine,in rat focal cerebral ischemia[J].Eur J Pharmacol,1999,372(1):31-36.
[22]Kuhmonen J,Pokory J,Miettinen R,et al.Neuroprotective effects of dexmedetomidine in the gerbil hippocampus after transient global ischemia[J].Anesthesiology,1997,87(2):371-377.
[23]Schoeler M,Loetscher PD,Rossaint R,et al.Dexmedetomidine is neuroprotective in an in vitro model for traumatic brain injury[J].BMC Neurol,2012,12:20-27.
[24]Degos V,Charpentier TL,Chhor V,et al.Neuroprotective effects of dexmedetomidine against glutamate agonist-induced neuronal cell death are related to increased astrocyte brain-derived neurotrophic factor expression[J].Anesthesiology,2013,118(5):1123-1132.
[25]侯冠峰,陈晓蓉,承韶辉.右美托咪定对大鼠脑缺血再灌注损伤的影响[J].江苏医药,2013,39(13):1508-1560.
[26]Yan M,Dai H,Ding T,et al.Effects of dexmedetomidine on the release of glial cell line-derived neurotrophic factor from rat astrocyte cells[J].Neurochem Int,2011,58(5):549-557.
[27]柏晓漫,梁枫,李龙云.盐酸右美托咪定对颈内动脉瘤夹闭术患者血流动力学及脑氧代谢的影响[J].中国诊断医学,2013,17(7):1200-1202.
[28]Dong X,Xing Q,Li Y,et al.Dexmedetomidine protects against ischemia-reperfusion injury in rat skeletal muscle[J].J Surg Res,2014,186(1):240-245.
Effect of different treatments with dexmedetomidine on focal cerebral ischemia reperfusion injury in rats
TANG Chun-yong,WANG Ying,XIA Le-qiang
(Department of Anesthesiology,Deyang People′s Hospital,Deyang 618000,China)
Objective To discuss the effects of different treatments with dexmedetomidine (Dex) on focal cerebral ischemia reperfusion injury in rats through the right middle cerebral artery occlusion-reperfusion model.Methods Totally 100 healthy male SD rats were randomly divided into 5 groups:sham operation group (sham group),cerebral ischemic-reperfusion group (I/R group),dexmedetomidine preconditioning group (Dex1 group),dexmedetomidine post-conditioning group (Dex2 group) and dexmedetomidine preconditioning combined with post-conditioning group (Dex3 group),20 rats in each group.All the rats were treated by different ways of dexmedetomidine.The superoxide dismutase (SOD) activity and malonaldehyde (MDA) content in brain tissue and the neuron specific enolase (NSE) content in serum were measured by ELISA method.Results Compared with sham group,the SOD activity in I/R group,Dex1 group,Dex2 group and Dex3 group decreased significantly,the MDA content increased,and the content of serum NSE increased (P<0.05).Compared with I/R group,the SOD activity in the three Dex groups significantly increased,and the content of MDA and serum NSE decreased significantly (P<0.05).The contents of MDA in brain tissue and serum NSE in Dex1 group and Dex3 group were lower than those of Dex2 group (P<0.05),and the contents in Dex3 group were lower than those of Dex1 group (P<0.05).The activity of SOD in brain tissue of Dex3 group was higher than that of Dex2 group (P<0.05).Conclusion All the three different interventions with dexmedetomidine can relieve the focal cerebral ischemia reperfusion injury in rats.Dexmedetomidine preconditioning combined with post-conditioning has better protective effects on cerebral ischemia reperfusion injury.Dex can inhibit the excessive oxidative stress response and reduce the excessive oxygen free radicals,which may be one of the protection mechanisms of Dex for cerebral ischemia reperfusion injury.
Dexmedetomidine;Cerebral ischemia reperfusion injury;Preconditioning;Post-conditioning
2016-04-04
德阳市人民医院麻醉科,四川 德阳 618000
10.14053/j.cnki.ppcr.201611006
