H2O2/[CnMIm]HCO3对CEES的消毒动力学及机理
2016-12-14王志成习海玲孔令策赵三平左言军
王志成,习海玲,2,孔令策,赵三平,左言军
(1.防化研究院,2.国民核生化灾害防护国家重点实验室,北京102205)
H2O2/[CnMIm]HCO3对CEES的消毒动力学及机理
王志成1,习海玲1,2,孔令策1,赵三平1,左言军1
(1.防化研究院,2.国民核生化灾害防护国家重点实验室,北京102205)
合成了4种不同烷基链长的1⁃烷基⁃3⁃甲基咪唑碳酸氢盐([CnMIm]HCO3,n=2,4,6,8)离子液体(ILs),并以H2O2水溶液(质量分数30%)为氧化剂,研究了H2O2在[CnMIm]HCO3离子液体、H2O和C2H5OH中对芥子气模拟剂2⁃氯乙基乙基硫醚(CEES)的消毒能力,考察了离子液体烷基链长、H2O2/CEES摩尔比和反应温度对消毒率的影响,并对反应活化能和产物进行了分析.结果表明,H2O2在不同溶剂中对CEES的消毒能力依次为[BMIm]HCO3>[EMIm]HCO3>[HMIm]HCO3>[OMIm]HCO3>C2H5OH>H2O.对于CEES在[BMIm]HCO3中形成的20 mg/mL的毒剂溶液,当n(H2O2)∶n(CEES)=10时,H2O2可在30 min内消毒99.58%的CEES,且该体系具有一定的低温(243 K)消毒能力.该反应为一级反应,活化能为15.59 kJ/mol,低于单一过碳酸钠与CEES的反应活化能.化学发光测试结果表明,在碳酸氢根活化过氧化氢(BAP)体系中,咪唑基离子液体可抑制亚砜被超氧阴离子(·O-2)过度氧化为砜.
离子液体;洗消;2⁃氯乙基乙基硫醚;碳酸氢根活化过氧化氢
2,2′⁃二氯二乙基硫醚(HD),又称“毒剂之王”,是一种危害巨大的糜烂性毒剂,易使皮肤和组织起泡、糜烂并坏死.对HD的消毒试剂一般包括氯基氧化剂、碱性溶液和氧基氧化剂等,氯基氧化剂和碱性溶液具有较强的腐蚀性及易污染环境的缺点,绿色消毒剂H2O2以其环境友好、适用性广和成本低廉等特点,正逐步代替传统的氯基氧化剂并成为洗消领域的研究热点.随着研究的深入,H2O2消毒体系也暴露出一些问题:(1)水基消毒剂对HD溶解性差的特点限制了其消毒率,虽然在实际应用中可通过加大H2O2用量来提高消毒率,但这通常伴随着对染毒表面腐蚀的风险[1];(2)通过添加助溶剂如正丁醇、异丙醇或表面活性剂等可提高H2O2水溶液对HD的溶解度,但其对HD的消毒速率并没有明显提高[2],且大量挥发性有机溶剂(VOC)的使用往往会造成环境污染.因此,提高H2O2体系对HD的消毒能力并减少环境污染有待深入研究.
向H2O2溶液中添加活化剂可显著提高H2O2的消毒能力,常见的活化剂包括碳酸氢盐[3]、过硼酸盐[4]、过钼酸盐[5]、有机碱[6]和氨气[7]等.采用碳酸氢根活化过氧化氢(BAP)体系氧化硫醚时,其二级反应速率常数约为单纯使用H2O2的300倍以上[8],而且具有使用方便及价格低廉等特点,广泛应用于氧化脱硫[9]、有机废水处理[10]、有机污染物降解[11]和烯烃氧化[12]等领域.
离子液体(ILs)是指仅由阴、阳离子构成,熔点低于373 K的离子化合物,具有宽广的液态温度范围、良好的溶解性、非挥发性及可设计性等特点,也被称为“绿色溶剂”[13,14].近年来,ILs也开始作为溶剂应用于洗消领域并有少量报道.Wilkes等[15]研究发现,在1,2⁃二甲基⁃3⁃丙基咪唑双三氟甲基磺酰亚胺盐([DMPIm]NTf2)离子液体中,H2O2在双三氟甲基磺酰亚胺铜[Cu(NTf2)2]的催化作用下可在24 h内实现对HD模拟剂2⁃氯乙基苯基硫醚(CEPS)的完全消毒,从而证实可在ILs中对毒剂进行氧化消毒.Voss等[16]将室温离子液体1⁃己基⁃3⁃甲基咪唑双三氟甲基磺酰亚胺盐([HMIm]NTf2)、有机凝胶(LMOG)和三乙烯四胺(TETA)熔合成室温下可稳定贮存6个月以上的消毒涂层,涂覆于染毒试样24 h,可消毒沾染的70%~95%HD模拟剂2⁃氯乙基乙基硫醚(CEES),拓展了ILs在洗消领域中的可能应用方式.ILs具有的可设计性的特点决定了以其作为溶剂时,消毒能力还有很大的提升空间[17].
本文将具有活化H2O2能力的碳酸氢盐类ILs引入洗消领域,设计合成了不同烷基链长的1⁃烷基⁃3⁃甲基咪唑碳酸氢盐([CnMIm]HCO3,n=2,4,6,8)离子液体.通过高效液相色谱(HPLC)研究了[CnMIm]HCO3对CEES的溶解度,并以H2O2(质量分数30%)为氧化剂,研究了溶剂种类、氧化剂与CEES比例及反应温度对消毒能力的影响.通过计算不同温度下的反应速率常数测得反应活化能;采用气相色谱⁃质谱联用技术分析了消毒产物;并利用傅里叶变换红外光谱和化学发光技术检测了反应体系的活性氧物种,推测了消毒机制.为H2O2/[BMIm]HCO3对CEES的消毒技术研究提供了基础数据.
1 实验部分
1.1 试剂与仪器
2⁃氯乙基乙基硫醚(CEES),纯度98%,美国Aldrich公司;CnH2n+1Br(n=2,4,6,8),化学纯,上海麦克林生化科技有限公司;甲醇、乙腈(ACN)、N⁃甲基咪唑、二氯甲烷和乙酸乙酯均为化学纯,美国Sigma⁃Aldrich公司;五水合硫代硫酸钠、碳酸氢钠和H2O2(质量分数30%)均为化学纯,北京试剂厂;光泽精,化学纯,上海阿拉丁生化科技股份有限公司;1⁃丁基⁃3⁃甲基咪唑双氰胺盐([BMIm]DCA)和1⁃丁基⁃3⁃甲基咪唑双三氟甲基磺酰亚胺盐([BMIm]NTf2)均为化学纯,中国科学院兰州化学物理研究所.
Breeze高效液相色谱(HPLC),美国Waters公司;600 MHz核磁共振波谱(NMR)仪,美国Varian公司;DSQⅡ型气相色谱⁃质谱(GC⁃MS)联用仪,美国Thermo Scientific公司;Agilent 7890A气相色谱(GC),美国Agilent公司;Nicolet 6700傅里叶变换红外光谱仪(FTIR),美国Thermo Scientific公司;Evolution 260紫外⁃可见分光光度计(UV⁃Vis),美国Thermo Scientific公司;EYELA型旋转蒸发仪,上海爱朗仪器有限公司;DK⁃S26型恒温水浴锅,上海精密实验设备有限公司;EW0440型高低温湿热试验箱,广东爱斯佩克环境仪器公司;家用微波炉,美的公司;EFFM⁃E流动注射化学发光分析仪(CL),西安瑞迈分析仪器有限公司.
1.2 [CnMIm]HCO3(n=2,4,6,8)的合成
采用微波反应法合成1⁃烷基⁃3⁃甲基咪唑溴盐([CnMIm]Br,n=2,4,6,8),合成路线如Scheme 1所示.将N⁃甲基咪唑和CnH2n+1Br(n=2,4,6,8)以摩尔比1∶1.1加入锥形瓶中,磁力搅拌10 s后置于微波炉中,在200 W功率下反应1 min,取出搅拌10 s,重复操作3次,得到黄色黏稠液体;用乙酸乙酯洗涤3次,减压蒸馏除去溶剂,并于353 K真空干燥20 h,得到淡黄色黏稠状液体[CnMIm]Br(n=2,4,6,8).向[CnMIm]Br中加入等摩尔NaHCO3,以甲醇为溶剂,于313 K搅拌24 h,经真空抽滤、减压蒸馏及真空干燥等步骤,可分别得到4种浅黄色的离子液体[CnMIm]HCO3:1⁃乙基⁃3⁃甲基咪唑碳酸氢([EMIm]HCO3,n=2),1⁃丁基⁃3⁃甲基咪唑碳酸氢([BMIm]HCO3,n=4),1⁃己基⁃3⁃甲基咪唑碳酸氢([HMIm]HCO3,n=6),1⁃辛基⁃3⁃甲基咪唑碳酸氢([OMIm]HCO3,n=8)离子液体.

Scheme 1 Synthetic routes of[CnMIm]HCO3(n=2,4,6,8)
1.3 CEES在[CnMIm]HCO3中的溶解度
参照文献[18]方法,采用HPLC法测定了CEES在[CnMIm]HCO3中的溶解度.测试条件为V(甲醇)∶V(水)=7∶3;流速1 mL/min;紫外⁃可见吸收检测波长224 nm,检测时间10 min.
1.4 H2O2/[CnMIm]HCO3对CEES的消毒能力
用移液枪移取一定量的溶剂至10 mL具塞试管中,加入定量H2O2,将其置于高低温试验箱内于一定温度下恒温60 min,随后移取9.4 μL CEES(10 mg)至试管内,振荡10 s后于相应温度下静置反应,30 min后加入过量五水合硫代硫酸钠终止反应,随后加入1.5 mL ACN稀释并振荡,反应液经0.22 μm膜过滤后进行HPLC分析.空白样为CEES(10 mg/mL)的ACN溶液,HPLC条件同上.
1.5 反应产物分析
由于[BMIm]HCO3与CH2Cl2互溶,因此对反应产物进行稀释后直接分析.GC⁃MS条件:DB⁃5MS色谱柱(30 m×0.25 mm×0.25 μm);载气:氦气,恒流方式,1 mL/min;进样口温度523 K;色谱升温程序:初始温度323 K,保持1 min,以10 K/min速率升温至523 K,保持5 min;质谱离化方式:EI和CI;离化电压70 eV;扫描范围33~600 amu(EI),80~500 amu(CI);扫描速率150 amu/s.采用GC对不同反应时间各物质含量进行分析.GC条件:硫磷检测器;色谱柱:DB⁃1701(30 m×250 μm×0.25 μm);色谱升温程序:初始温度313 K,保持1 min,以15 K/min速率升温至493 K,保持2 min,再以40 K/min速率升温至523 K,保持2 min.
1.6 H2O2/[BMIm]HCO3体系活性氧检测
采用流动注射化学发光分析仪研究体系的活性氧物种.以光泽精(1 mmol/L,pH=9.0)为超氧阴离子的光敏化剂,对体系活性氧物种进行监测.仪器参数如下:高压400 V,采样速度20次/s,运行时间550 s.采用原位FTIR对体系中的变化进行监测:将[BMIm]HCO3与H2O2按实际反应比例加入红外吸收池,测定的吸光度值随时间的变化情况.
2 结果与讨论
2.1 [CnMIm]HCO3的结构表征
在4种ILs的红外光谱中,3420 cm-1处为缔合—OH伸缩振动峰,3200~2700 cm-1为C—H伸缩振动峰,1633 cm-1处为伸缩振动峰,1572 cm-1处为咪唑环骨架振动峰,1430和1232 cm-1处为和—OH的振动偶合峰,1168 cm-1处为咪唑环上C—H弯曲振动峰,765 cm-1处为咪唑环上的C—H面外摇摆弯曲振动峰,表明合成的[CnMIm]HCO3(n=2,4,6,8)具有咪唑和碳酸的结构特征[19].
4种ILs的核磁共振表征结果如表1所示.对合成产物用水稀释,加入适量HCl溶液(质量分数10%),产生CO2气泡,进一步证实了的存在[20].

Table 11H NMR and13C NMR data of compounds[CnMIm]HCO3(n=2,4,6,8)
2.2 CEES在[CnMIm]HCO3中的溶解度
迄今未见关于ILs作为溶剂时消毒率的测试报道,因此需要建立准确且重复性好的消毒率测试方法.基于ILs不易挥发且易污染GC的特点,本文采用HPLC对[CnMIm]HCO3中CEES含量及检测线性范围进行标定.配制浓度分别为0,0.5,1.5,2,5和10 mg/mL的CEES的ACN溶液,对其响应面积与浓度进行拟合,得到线性回归方程A=887970c+206537(式中,A为响应面积,c为CEES浓度,R2=0.9973,线性范围为0~10 mg/mL).进一步通过CEES响应面积计算CEES在[CnMIm]HCO3中的溶解度.室温下,[CnMIm]HCO3对CEES的溶解度分别为5.2,20.5,29.2,53.0 g/(100 g),即ILs咪唑环上烷基链越长,其溶解CEES的能力越强.
2.3 H2O2在不同溶剂中对CEES消毒能力
图1给出以H2O2为氧化剂,H2O2分别在ILs,C2H5OH和H2O中对CEES的消毒能力.由图1可知,H2O2在不同溶剂中对CEES的消毒能力依次为[BMIm]HCO3>[EMIm]HCO3>[HMIm]HCO3>[OMIm]HCO3>[BMIm]DCA>C2H5OH>[BMIm]· NTf2>H2O.与其它碱性相近的疏水型咪唑基离子液体和常规溶剂相比,H2O2/[BMIm]HCO3表现出最佳的消毒效率.
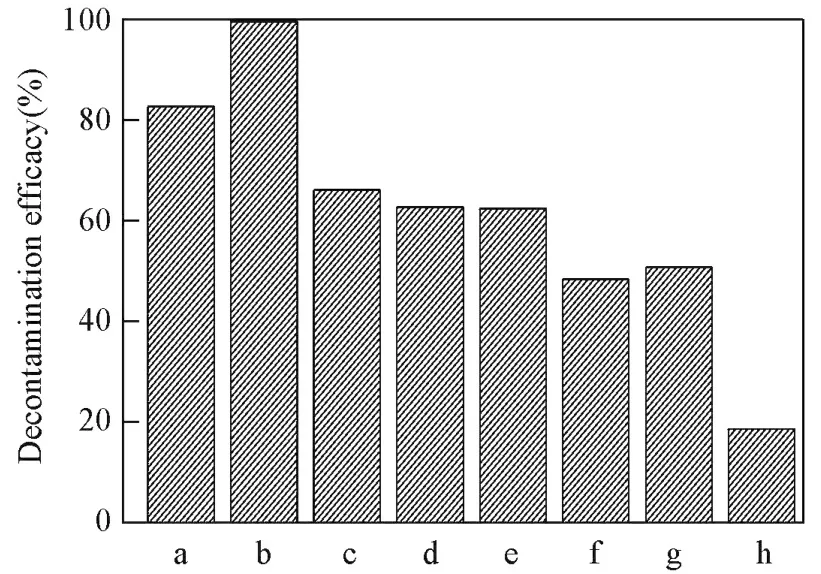
Fig.1 Decontamination efficacy of CEES by H2O2in different solventsa.[EMIm]HCO3;b.[BMIm]HCO3;c.[HMIm]HCO3;d.[OMIm]HCO3;e.[BMIm]DCA;f.[BMIm]NTf2;g.C2H5OH;h.H2O.Experimental conditions:m(CEES)=10 mg,solvents 420 μL,30%H2O2aqueous solution 80 μL,n(oxidant)∶n(CEES)=10,30 min.
对于CEES(20 mg/mL)的[BMIm]HCO3溶液,H2O2过量10倍时,可在30 min内消毒99.58%的CEES.减小或增加阳离子烷基链长,H2O2/[CnMIm]HCO3消毒率降低.这主要是因于,H2O2/[CnMIm]HCO3对CEES的消毒率取决于[CnMIm]HCO3对CEES及H2O2的溶解能力,[CnMIm]HCO3阳离子咪唑环上烷基链越长或阳离子相同时阴离子亲油性越强,其溶解CEES能力越佳{[BMIm]DCA和[BMIm]NTf2对CEES的溶解度分别为134.68和66.59 g/(100 g)};阳离子烷基链越短,其溶解H2O2能力越佳[21,22];而[BMIm]·HCO3对二者都具有良好的溶剂能力,故其消毒效果最佳.由此可知,H2O2/[CnMIm]HCO3对CEES的消毒率主要取决于[CnMIm]HCO3对氧化剂与毒剂的溶解能力.
2.4 [BMIm]HCO3中H2O2用量对CEES消毒能力的影响
以[BMIm]HCO3作为消毒溶剂,研究了不同H2O2用量对消毒效率的影响.当n(H2O2)∶n(CEES)=2.5∶1时,反应30 min,H2O2/[BMIm]HCO3可以消毒95.11%的CEES;当H2O2过量10倍时,消毒率可达99.5%以上;进一步提高H2O2用量,消毒率基本不再发生变化.相比于传统溶剂,[BMIm]HCO3可显著提高H2O2的消毒性能[23],并在低H2O2用量时仍表现出良好的消毒效果,对敏感设备的消毒具有极大的应用前景.
2.5 动力学方程的建立及活化能的计算
CEES易发生C—Cl键的亲核取代反应及S原子的氧化反应,当体系中氧化剂过量时,速率方程一般为r=kcx(式中,r为反应速率;k为反应速率常数;c为CEES浓度).图2给出了243,253,273,298和313 K下反应不同时间CEES的浓度变化.
由图2可见,在30 min内,随着反应时间的延长,H2O2/[BMIm]HCO3体系对CEES的消毒率逐渐提高;随着反应温度的升高,体系对CEES的消毒能力逐渐增强.由于[BMIm]HCO3在低温时仍具有较好的流动性,因此,H2O2/[BMIm]HCO3体系在243 K仍具有一定的消毒效果(54.28%).通过对不同温度下反应2~30 min的lnc~t拟合发现,在该时间段内反应符合一级动力学方程[24],由此可求出其表观速率常数.
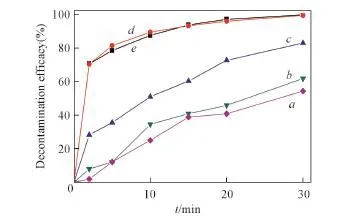
Fig.2 Decontamination efficacy of CEES using H2O2/[BMIm]HCO3at different temperaturesExperimental conditions:c(CEES)=20 mg/mL,n(oxidant)∶n(CEES)=10,30 min.Temperature/K:a.243;b.253;c.273;d.298;e.313.
根据Arrhenius公式的不定积分式lnk=-Ea/RT+lnA(式中:A为指前因子,与碰撞频率有关;R为气体常数;T为温度;Ea为表观活化能;k为速率常数)对不同温度下的lnk值与1/T进行拟合,计算得到H2O2/[BMIm]HCO3与CEES反应的表观活化能,结果示于图3.

Fig.3 Apparent activation energy of oxidation of CEES
由图3可知,该反应的表现活化能为15.59 kJ/mol,低于单一过碳酸钠体系(Ea=44.73 kJ/ mol)[25],这可能归因于该体系中的浓度远高于饱和NaHCO3溶液中的浓度,且离子液体对氧化剂和毒剂有较好的溶解能力,加速了H2O2对CEES的氧化进程.
2.6 H2O2/[BMIm]HCO3体系对CEES消毒的主要产物
利用GC⁃MS分析了CEES在H2O2/[BMIm]HCO3体系中反应30 min的消毒产物.由图4可见,CEES主要发生氧化与消去反应,产物中糜烂性的砜含量低于10%,低于BAP水溶液中硫醚氧化产物砜的含量(40%)[3].同时,产物中出现离子液体的氧化产物2⁃咪唑酮.图5示出了通过气相色谱测定的几种物质浓度随时间的变化情况,由图5可知,产物中亚砜的含量先增加后减少,砜与2⁃咪唑酮的含量缓慢增加,表明CEES首先被氧化为相应的亚砜,随着反应时间延长,亚砜被过度氧化为相应的砜.由于离子液体阳离子易被氧化为2⁃咪唑酮[26],因此,咪唑基离子液体作为溶剂时可抑制CEES被过度氧化.
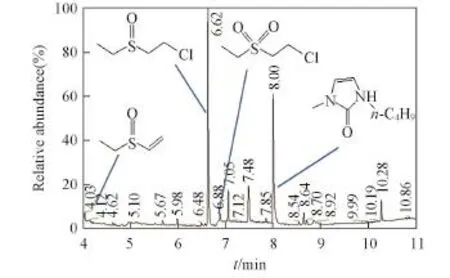
Fig.4 GC⁃MS spectrum of CEES oxidation products in H2O2/[BMIm]HCO3
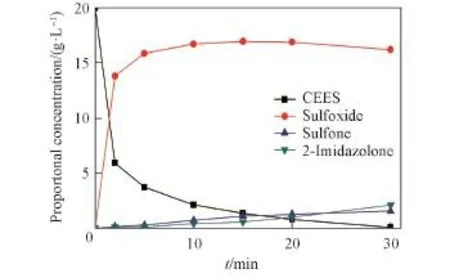
Fig.5 Oxidation products of CEES in H2O2/[BMIm]HCO3
2.7 H2O2/[BMIm]HCO3体系中活性氧物种的测定
采用化学发光技术对体系中的活性氧物种进行了研究.取pH值为9.0的光泽精溶液2 mL,加入50 μL[BMIm]HCO3并振荡,注射加入100 μL H2O2,其化学发光谱图如图6所示.由于光泽精可选择性地与产生化学发光[27],并且可稳定存在于咪唑基ILs中[28].当将H2O2(质量分数30%)注入含[BMIm]HCO3的光泽精溶液中,会在瞬间产生一个强烈且持久的的发光峰.而将[BMIm]HCO3换为其它碱性离子液体如[BMIm]DCA和[BMIm]NTf2,其发光峰明显偏低,表明H2O2/[BMIm]HCO3体系会产生与其它BAP体系结论一致[29].
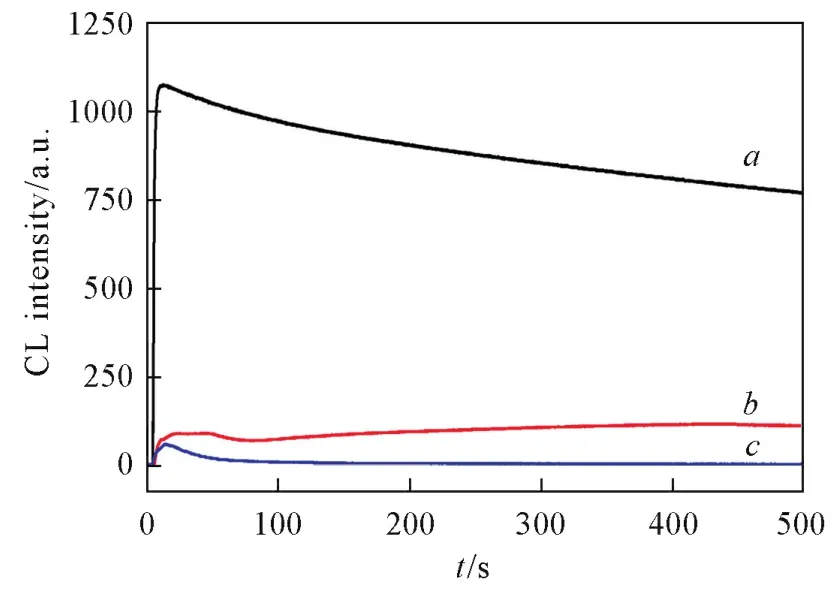
Fig.6 CL kinetics of H2O2in lucigenin solution which containing basic ILsa.[BMIm]HCO3;b.[BMIm]DCA;c.[BMIm]NTf2. Experimental conditions:2 mL lucigenin,100 μL H2O2,50 μL ILs.
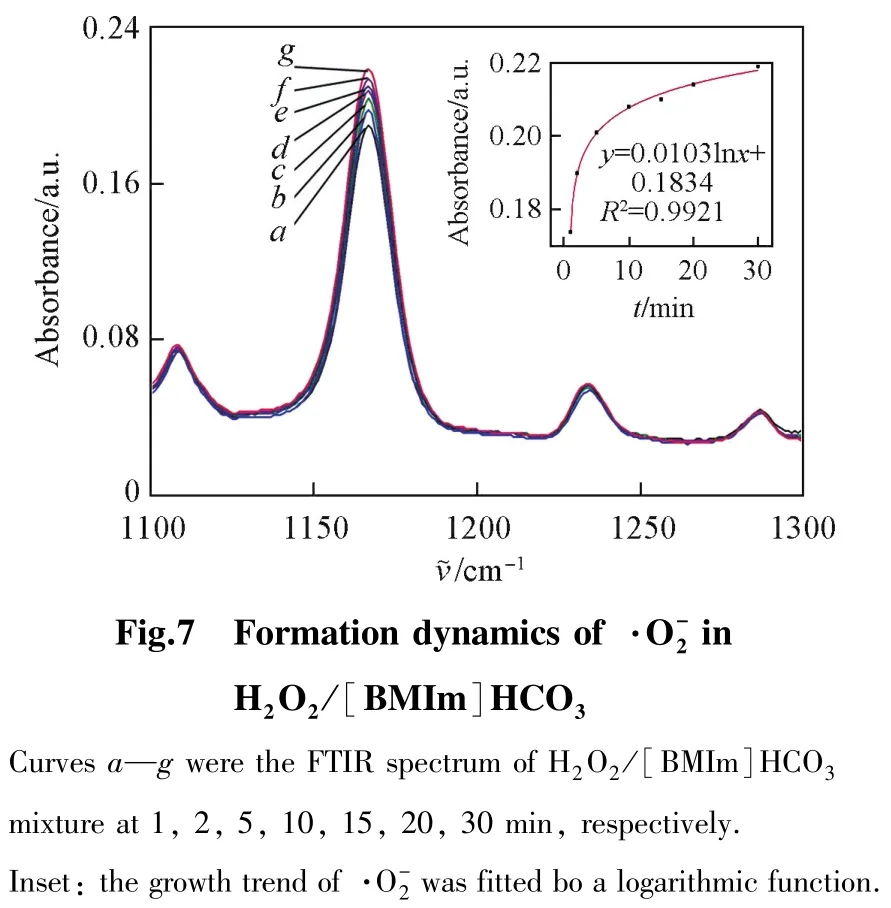
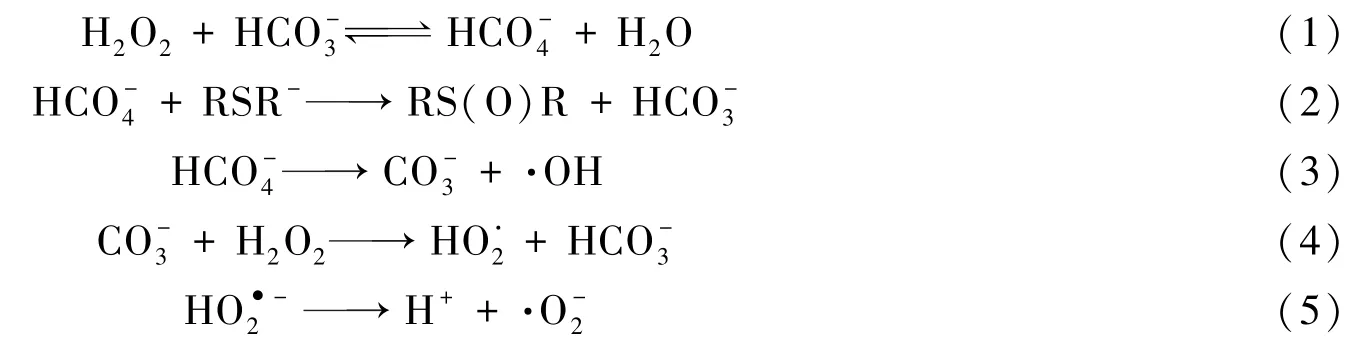
综合考虑体系活性氧物种及反应产物,推测CEES在H2O2/[BMIm]HCO3体系中的反应机制如Scheme 2所示.在弱碱性条件下,H2O2和可通过溶剂分子辅助的氧转移机制完成对CEES的初级氧化,其中对硫醚的初级氧化速率比H2O2高2个数量级.分解产生的是硫醚过度氧化的主要活性氧[32],但由于离子液体阳离子易被氧化为2⁃咪唑酮,因此[BMIm]HCO3离子液体作为溶剂时可抑制砜的生成.
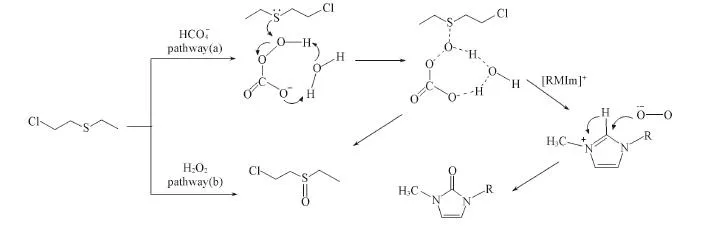
Scheme 2 Possible reaction mechanism between CEES with H2O2/[BMIm]HCO3
3 结 论
研究了不同烷基链长的1⁃烷基⁃3⁃甲基咪唑碳酸氢盐离子液体对芥子气模拟剂CEES的溶解能力及加入H2O2后的消毒能力,并对不同H2O2用量、反应活化能、产物、活性氧物种和反应机制进行了探讨.结果表明,H2O2/[CnMIm]HCO3对CEES的消毒率取决于[CnMIm]HCO3对氧化剂、毒剂的溶解能力及对氧化剂的活化能力.对于CEES在[BMIm]HCO3中形成的20 mg/mL的毒剂溶液,n(H2O2)∶n(CEES)=10时,H2O2在30 min可消毒99.58%的CEES,且具有一定的低温(243 K)消毒能力.该反应为一级反应,活化能为15.59 kJ/mol,低于单一过碳酸钠对CEES的反应活化能(44.73 kJ/mol).在该BAP体系中,反应产物主要为相应的亚砜,[BMIm]HCO3中咪唑的存在能抑制亚砜被超氧阴离子过度氧化为砜.
[1] Talmage S.S.,Watson A.P.,Hauschild V.,Munro N.B.,King J.,Curr.Org.Chem.,2007,79(23),285—298
[2] Wagner G.W.,Yang Y.,Ind.Eng.Chem.Res.,2002,41(8),1925—1928
[3] Fakhraian H.,Valizadeh F.,J.Mol.Catal.A:Chem.,2010,333,69—72
[4] Karunakaran C.,Kamalam R.,J.Chem.Soc.,2002,2,2011—2018
[5] Wagner G.W.,Procell L.R.,Yang Y.,Bunton C.A.,Langmuir,2001,17(16),4809—4811
[6] Yan S.,Zhang S.J.,Zhao Y.X.,Li X.M.,Zhang Y.M.,Zhang H.,Wang J.,Fu J.Q.,Chem.J.Chinese Universities,2016,37(5),946—955(严山,张胜建,赵迎宪,李显明,张永明,张洪,王健,符建琼.高等学校化学学报,2016,37(5),946—955)
[7] Wagner G.W.,Sorrick D.C.,Procell L.R.,Brickhouse M.D.,Mcvey I.F.,Schwartz L.I.,Langmuir,2007,23(3),1178—1186
[8] Richardson D.E.,Yao H.,Frank K.M.,Bennett D.A.,J.Am.Chem.Soc.,2000,122(8),1729—1739
[9] Bokare A.D.,Choi W.,J.Hazard.Mater.,2016,304,313—319
[10] Jawad A.,Chen Z.,Yin G.,Chinese J.Catal.,2016,37(6),810—825
[11] Peng J.,Shi H.,Li J.,Wang L.,Wang Z.,Gao S.,Chem.Eng.J.,2016,306,484—491
[12] Maurya M.R.,Kumar N.,J.Mol.Catal.A:Chem.,2015,406,204—212
[13] Zhang L.N.,Cai K.,Zhang F.,Yue Q.F.,Chem.Res.Chinese Universities,2015,31(1),130—137
[14] Zhao Y.M.,Cui H.M.,Zheng C.Z.,Chen X.G.,Li C.Y.,Chem.Res.Chinese Universities,2016,32(1),112—117
[15] Wilkes J.S.,Castle P.J.,Levisky J.A.,Hermosillo A.,Cote P.J.,Corley C.A.,Montgomery E.A.,Bird D.M.,Hutchinson R.R.,Ditson M.F.,Ind.Eng.Chem.Res.,2009,48(13),6203—6211
[16] Voss B.A.,Noble R.D.,Gin D.L.,Chem.Mater.,2012,24(6),1174—1180
[17] Gao D.L.,Yu X.P.,Guo Y.F.,Wang S.Q.,Liu M.M.,Deng T.L.,Chen Y.W.,Belzile N.,Chem.Res.Chinese Universities,2015,31(4),621—626
[18] Li L.J.,Li X.W.,Ding J.,Liu Y.,Wu Q.,Wang X.Z.,Li M.,Jin Y.R.,Chem.J.Chinese Universities,2016,37(3),454—459(李兰杰,李绪文,丁健,刘迎,吴谦,王晓中,李敏,金永日.高等学校化学学报,2016,37(3),454—459)
[19] Ma Y.Q.,Wang R.,Chem.J.Chinese Universities,2014,35(7),1515—1522(马云倩,王睿.高等学校化学学报,2014,35(7),1515—1522)
[20] Wang X.D.,Wu W.Y.,Tu G.F.,Jiang K.X.,Chinese Science Bulletin,2009,54(1),21—26(王晓丹,吴文远,涂赣峰,蒋开喜.科学通报,2009,54(1),21—26)
[21] Zhou T.,Chen L.,Ye Y.,Chen L.,Qi Z.,Freund H.,Sundmacher K.,Ind.Eng.Chem.Res.,2012,51(17),6256—6264
[22] Freire M.G.,Neves C.M.S.S.,Shimizu K.,Bernardes C.E.S.,Marrucho I.M.,Coutinho J.A.P.,Lopes J.N.C.,Rebelo L.P.N.,J.Phys.Chem.B,2010,114(48),15925—15934
[23] Fallis I.A.,Griffiths P.C.,Cosgrove T.,Dreiss C.A.,Govan N.,Heenan R.K.,Holden I.,Jenkins R.L.,Mitchell S.J.,Notman S.,Platts J.A.,Riches J.,Tatchell T.,J.Am.Chem.Soc.,2009,131(28),9746—9755
[24] Liu Q.Z.,Xue F.,Lei Z.K.,Liu C.J.,Chem.J.Chinese Universities,2016,37(5),886—891(刘庆治,薛飞,雷振凯,刘晨江.高等学校化学学报,2016,37(5),886—891)
[25] Zhang L.,Xi H.L.,Environmental Chimistry,2011,30(10),1695—1699(张磊,习海玲.环境化学.2011,30(10),1695—1699)
[26] AlNashef I.M.,Hashim M.A.,Mjalli F.S.,Ali M.Q.A.,Hayyan M.,Tetrahedron Letters,2010,51(15),1976—1978
[27] Khajvand T.,Alijanpour O.,Chaichi M.J.,Hashemi M.V.,Anal.Bioanal.Chem.,2015,407,6127—6136
[28] Islam M.M.,Imase T.,Okajima T.,Takahashi M.,Niikura Y.,Kawashima N.,Nakamura Y.,Ohsaka T.,J.Phys.Chem.A,2009,113(5),912—916
[29] Xu A.,Li X.,Xiong H.,Yin G.,Chemosphere,2011,82(8),1190—1195
[30] Hayyan M.,Hashim M.A.,AlNashef I.M.,Ionics,2015,21,719—728
[31] Yao H.,Richardson D.E.,J.Am.Chem.Soc.,2003,125(20),6211—6221
[32] Zhao S.P.,Study on the Reactive Oxygen Species in the Activated H2O2Solution and Their Decontamination Mechanisms on Chemical Warfare Agents(CWAs),Research Institute of Chemical Defence,Beijing,2015(赵三平.典型活化H2O2消毒体系的活性氧及其对化学毒剂的消毒机制研究,北京:防化研究院,2015)
(Ed.:P,H,W,K)
†Supported by the State Key Laboratory Project of Civil Nuclear,Biological,and Chemical Defence Project,China(No.SKLNBC2012⁃09).
Kinetics and Mechanism of Decontamination Reaction of CEES in H2O2/[CnMIm]HCO3†
WANG Zhicheng1,XI Hailing1,2∗,KONG Lingce1,ZHAO Sanping2,ZUO Yanjun1
(1.Research Institute of Chemical Defence,2.State Key Laboratory of Civil Nuclear,Biological,and Chemical Defence,Beijing 102205,China)
A series of environmentally benign 1⁃n⁃alkyl⁃3⁃methylimidazolium bicarbonate ionic liquids(ILs)([CnMIm]HCO3,n=2,4,6,8)was synthesized and hydrogen peroxide was employed in decontamination against 2⁃chloroethyl ethyl sulfide(CEES,a mustard agent simulant)in these ILs.The influencing factors such as ILs alkyl chain length,oxidant/CEES molar ratio and temperature were tested and the activation energy,reaction product in H2O2/[BMIm]HCO3was analyzed.The results indicated that the solvents species can affect decontamination efficacy against CEES and they were in the following sequences:[BMIm]HCO3>[EMIm]HCO3>[HMIm]HCO3>[OMIm]HCO3>C2H5OH>H2O.In H2O2/[BMIm]HCO3system,99.58% of the CEES was oxidized mainly to corresponding sulfoxide after 30 min at the concentration of 20 mg/mL and O/S molar ratio of 10.The apparent activation energy of CEES oxidized by H2O2/[BMIm]HCO3was 15.59 kJ/mol.Moreover,the superoxide radical anioncould be produced and oxidized ILs to 2⁃imidazolone, which inhibited the formation of corrosive sulfone.The result indicated that H2O2/[BMIm]HCO3system may be a new option for decontamination against CEES.
Ionic liquid;Decontamination;2⁃Chloroethyl ethyl sulfide;Bicarbonate activation of H2O2
O643.11
A
10.7503/cjcu20160487
2016⁃07⁃08.网络出版日期:2016⁃11⁃18.
国民核化生灾害防护国家重点实验室项目(批准号:SKLNBC2012⁃09)资助.
联系人简介:习海玲,女,研究员,博士生导师,主要从事军事化学方面的研究.E⁃mail:fhxihl@163.com
