安徽省汉族人氨基糖苷类抗生素致耳聋患者基因突变的研究
2016-12-14余元勋王迎新李建平
徐 彬,余元勋,王迎新,李建平,刘 萍,张 立
安徽省汉族人氨基糖苷类抗生素致耳聋患者基因突变的研究
徐 彬,余元勋,王迎新,李建平,刘 萍,张 立
目的 研究安徽省汉族人氨基糖苷类抗生素致耳聋(AAID)患者基因突变与其非综合征性耳聋(NSHL)的关系,建立口腔黏膜细胞基因组DNA新一代基因测序法(NGS)。方法 由122例NSHL患儿及120 例健康儿童,取得口腔黏膜基因组DNA,应用NGS对GJB2、12S rRNA 基因测序。结果 口腔黏膜细胞的基因组DNA质量较好,能满足NGS 研究需要;在122例NSHL患者中,28例GJB2 基因突变,占耳聋患者的22.95%;10例12S rRNA基因突变,占耳聋患者的8.20%。120例健康儿童中,未发现基因突变(P<0.01)。结论 口腔黏膜细胞基因组DNA 的NGS检测法能用于检出安徽省汉族人AAID基因突变;在安徽NSHL患者中GJB2、12S rRNA基因突变有其一定的特点,能对安徽省汉族人AAID基因突变研究提供帮助。
口腔黏膜细胞;耳聋;突变;GJB2;12S rRNA
我国每年约有3万例先天性耳聋发病患者[1]。50%耳聋与遗传因素相关,为遗传性耳聋,由遗传因素、环境因素的共同作用而引发,包括非综合征型耳聋[(non-syndromic hearing loss,NSHL),约占70%]、综合征型耳聋[(syndromic hearing loss,SHL),约占30%];已发现与NSHL相关的致病基因及其突变有一定异质性,与人群的种族、地区不同相关[2]。氨基糖苷类抗生素(aminoglycosides antibiotic,AmAn)使用中出现的听觉和前庭的损害常是不可逆的,可诱发氨基糖苷类抗生素致聋(aminoglycosides antibiotic induced deafness,AAID)[3-4],与AAID相关的12S rRNA 基因突变,以C1494T、
spectral imaging of the brain:initial results of selecting optimal monochromatic image for beam-hardening artifacts and image noise reduction[J]. J Comput Assist Tomogr, 2011,35(2):294-7.
[5] 莫泳康,黄锦粧,马树华,等. 肝脏动脉期CT能谱成像的影像优选[J]. 国际放射医学杂志,2014,37(1):1-5.
[6] 王贵生,高建华,赵 帅,等.肝脏增强扫描门静脉期能谱CT与传统多层螺旋CT辐射剂量和图像质量的比较[J].中华放射学杂志, 2013,47(4):340-3.
A1555G、nt961insC、nt961delT、Tnt1095C等突变较常见[5];研究[6]表明,GJB2基因上至少有110余种突变,可能与NSHL相关,GJB2基因突变的携带率为3%。目前遗传性耳聋较常用的基因诊断方法包括基因芯片法、NGS法。该研究主要应用口腔黏膜细胞的DNA,经NGS法检测耳聋致病基因突变, 以便为进一步开展AAID相关研究提供技术支持,为临床合理治疗提供指导。
1 材料与方法
1.1 研究对象
1.1.1 对象 安徽残联康复研究中心、安徽省优生优育遗传医学中心门诊NSHL患者共122例,其中男童75例,女童47例;120例健康儿童作为对照,其中男童71例,女童49例。
1.1.2 病史采集 采用问卷调查的方式, 由患者家属等填写。
1.1.3 纯音听阈测定 应用的全部仪器按国家标准校准。① 耳科检查:应用耳镜检查外耳道、鼓膜;② 纯音听阈测定:按照常规于静室内,采用丹麦Madsen502便携式听力计,根据WHO预防聋和听力损失项目方法(1997年), 应用上升法进行气导听阈测定,计算0.5、1、2、4kHz4个频率听阈平均值为纯音听阈;听力障碍者听力损失的具体分级如下:轻度听力损失:26~40dBHL;中度听力损失:41~60dBHL;重度听力损失:61~80dBHL;极重度听力损失:>81dBHL。
1.1.4 调查结果 122例患者均无亲缘关系,经体检排除遗传性SHL,否认有中耳炎、接触强噪音、外伤的病史, 耳科检查鼓膜正常, 无穿孔、充血、内陷;NSHL患者中,9例在3岁内用过庆大霉素(7例)、链霉素(2例),29例孕期或生后用药情况不详,84例无耳毒性药物用药史;77例为先天性聋(生后3个月内确诊),41 例为生后6个月内确诊, 4例为1岁以后听力下降;耳聋程度分布情况见表1。

表1 不同发病时期耳聋程度分布情况(n)
1.2 基因组DNA抽提
1.2.1 口腔黏膜细胞 取122例遗传性NSHL耳聋患者和120例健康人口腔黏膜细胞,制备细胞悬液,4 ℃保存;DNA抽提方法,按照本研究组已发表的文献[7]制备基因组DNA溶液。
1.2.2 PCR引物设计 设计时参考人类GenBank数据库(http://www.ncbi.nlm.nih.gov/genbank) 遗传性耳聋的序列, 并利用Premier 5.0软件设计,由上海生工公司合成,引物信息见表2。

表2 引物序列
1.3 PCR反应体系和条件 反应体系:Total 10 μl:polymerase 1 U;Primer forward (2 μmol/L)1 μl;Primer reverse (2 μmol/L)1 μl;DNA溶液1 μl; 10×buffer 1 μl;MgCl2(50 mmol/L)0.3 μl;dNTPs(10 mmol/L)0.2 μl;水补齐至10 μl。反应条件:Preheat,95 ℃ 5 min;PCR 40 cycles(95 ℃ 15 s;60 ℃ 20 s;72 ℃ 30 s);72 ℃ 15 min,4 ℃ 保存。
1.4 PCR产物测序 测序 PCR的反应产物由华大生物科技公司检验中心进行荧光全自动基因DNA正/反向测序,分析相关基因DNA突变。
1.5 统计学处理 采用SPSS 19.0软件进行统计学分析,耳聋组与健康对照组的基因DNA突变结果采用t检验进行分析,P<0.05为差异有统计学意义。两种DNA标本来源的 DNA 基因检测结果一致性分析用Kappa检验,Kappa>0.75则两者一致性较好。
1.6 突变分析 122例耳聋患者和120例健康人基因DNA的测序结果,与由GenBank中获得的正常人相关基因DNA相应序列进行比对,分析突变情况。
2 结果
2.1 一般资料 NSHL患者122例,其中男童75例(61.48%),女童47例(38.52%);男女之比为1.596 ∶1;均自愿参加,签署知情通知书。患者就诊年龄在出生后2~8(3.21±4.22)岁,男童平均年龄(4.26±5.12)岁,女童平均年龄为(3.61±3.96)岁;不同发病年龄耳聋程度分布不同。见表1。120例健康儿童作为对照,其中男童71例,女童49例;年龄在出生后2~8(3.39±4.37)岁,男童平均年龄(4.38±5.05)岁,女童平均年龄为(3.23±3.57) 岁。
2.2 提取DNA 取口腔颊黏膜细胞,制备基因组DNA溶液,凝胶电泳均为一条带,达到检验DNA溶液的纯度;基因组DNA溶液,经紫外分光光度计检测,OD260/OD280均为1.8,纯度合格;基因组DNA溶液浓度为1 μg/μl。
2.3 新一代基因测序分析结果 122例遗传性耳聋患者及120 例健康对照人群口腔黏膜细胞的DNA的PCR扩增、新一代基因测序分析后结果如下:在122例NSHL患者中,GJB2基因发现14例nt 235 del C杂合或纯合突变,2例nt 235 del C+nt 299~300 del AT复合突变,1例nt 235 del C+nt 176 del 16复合突变,4例nt 299~300 del AT移码突变,3例nt 176 del 16杂合突变, 2例nt 538 C→T纯合突变, 2例nt 547 G→A纯合突变,28例GJB2 基因突变患者占耳聋组的22.95%。
在122例NSHL患者中,线粒体12S rRNA基因发现3例nt 961 insC(如第12例)、3例nt 961 del T(如第23例)、1例nt 961 del T+T nt1095 C(如第28例)、2例A nt1555 G(如第63例)、1例C nt1494 T(如第86例),10例线粒体12S rRNA基因突变患者占耳聋组的8.20%,结果显示5种基因突变的相应测序部分截图见图1~5。120 例健康对照者未发现基因突变, 与耳聋组基因突变率差异有统计学意义(t=3.719,P<0.01)。
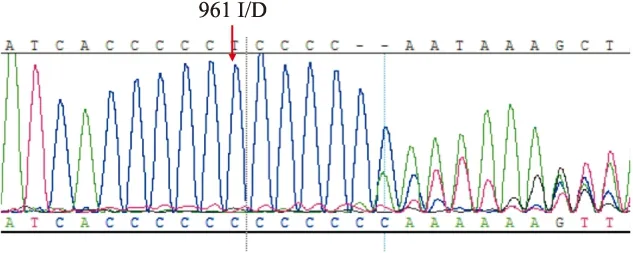
图1 患者第12例基因突变测序部分截图
男,4岁半,听力阈值90 dB,12S rRNA基因的961位点出现nt 961 insC的缺失,箭头指示突变位置
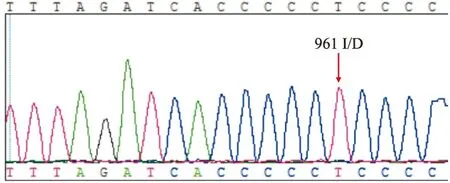
图2 患者第23例基因突变测序部分截图
男,3岁10个月,听力阈值95 dB, 12S rRNA基因的961位点出现nt 961 delTC的插入,箭头指示突变位置

图3 患者第28例基因突变测序部分截图
男,5岁,左耳听力阈值90 dB,右耳听力阈值95 dB, 12S rRNA基因的961位点出现nt 961 delT+T nt1095 C的复合突变,箭头指示突变位置
3 讨论
我国7岁以下的耳聋儿童约有80万例,常在应用氨基糖苷类抗生素后出现听力损失,大部分为重度耳聋,少部分为轻中度耳聋,造成了严重的社会问题;利用准确、低成本、高效率的耳聋基因诊断方法,早期发现、诊断耳聋发生的原因, 根据不同病因采取不同的干预措施,对耳聋儿童的生存质量意义重大。

图4 患者第63例基因突变测序部分截图
女,4岁,听力阈值90 dB, 12S rRNA基因1555位点的A突变为G,箭头指示突变位置

图5 患者第86例基因突变测序部分截图
女,6岁,听力阈值95 dB,12S rRNA基因1494位点的C突变为T,箭头指示突变位置
研究[8]显示,由口腔黏膜细胞提取基因组DNA,可应用于基因诊断。本研究结果表明,收集口腔黏膜细胞,抽取基因组DNA,可用于耳聋基因诊断,方法简易、方便。
GJB2基因常是非综合征型耳聋的致病基因, 其中约50%为常染色体隐性遗传性(DFNB),约20%为常染色体显性遗传性(DFNA);该基因位于DFNA3A基因座, 编码缝隙连接蛋白Cx26,表达于内耳上皮毛细胞等。GJB2基因突变后,突变Cx26可引发内淋巴液钾离子循环紊乱,能导致感音神经性耳聋,常表现为先天性、双侧对称的、非进行性重度耳聋;一般可见于新生儿听力筛查未通过的患儿,可被新生儿听力检查 + 基因诊断联合筛查发现。对中国2 063例耳聋患者进行研究[9]表明GJB2基因突变在NSHL患者的阳性率为14.9%,本研究结果阳性率为22.95%,包括nt 235del C、235 del C+nt 299~300 del AT 、nt 235 del C+nt 176 del 16、nt 299~300 delAT、nt 176 del 16、nt 538 C→T、nt 547 G→A, 分别占122例患者的11.48%、1.64%、0.82%、3.28%、2.46%、1.64%、1.64%; 其阳性率、分型情况与国内报道一致;nt 235del C、nt 299~300 delAT、nt 176 del 16 可能是安徽省NSHL患者中的GJB2 基因突变热点。
线粒体mtDNA 12S rRNA基因突变有母系遗传的特点,与耳毒性药物相关。研究[10]显示mtDNA 无组蛋白而裸露,在12S rRNA发生Ant1555G、Cnt1494T突变后,能使12S rRNA 在空间结构上与细菌16S rRNA 相似,易结合AmAn,能引发氧化磷酸化紊乱,减少产生 ATP,可毒性损伤内耳毛细胞,导致 AAID;后者对 AmAn 敏感,有时可一针致聋。研究[11]证实mtDNA Ant1555G 点突变是 AAID 遗传易感性的分子基础,其在中国汉族人NSHL患者中的携带率存在地域、种族的差异, 其在南京、福州、武汉[12-14]的NSHL患者的检出率分别为1.50%、0.67%、2.27%。本研究的检出率为1.64%,其差异可能与各地区使用AmAn的频率、基因突变检测方法等相关。研究[12]提示mtDNA Cnt1494T点突变的致病机制与Ant1555G 类似。本研究对安徽省122例耳聋患者筛查,检出1例Cnt1494T突变,检出率为0.82%。
线粒体nt 961 del T/insC是12S rRNA的nt 961位T的缺失和(或)C插入;可能是AmAn致聋的又一重要原因[3];该突变位于12S rRNA 基因的第21、22 环之间,可改变12S rRNA空间结构,易与AmAn结合而引发中毒性耳聋。本研究在安徽省的122 例耳聋患者中检出3例nt 961 insC、3例nt 961 del T、1 例复合突变nt 961 del T+Tnt 1095 C,总检出率为5.74%,3种突变分别占122例耳聋患者的2.46%、2.46%、0.82%。T nt1095 C位于12S rRNA的第25螺旋,能导致线粒体mtDNA 空间结构改变,促进与AmAn的结合,引发氧化磷酸化紊乱,减少产生ATP,可毒性损伤内耳毛细胞,导致产生 AAID[15]。本研究显示1例复合突变nt 961 del T+Tnt1095C,可能与耳聋发病相关;复合突变导致的耳聋症状可能较重,但需进一步研究。本研究122例耳聋患者中,12S rRNA 基因的 Ant3243G、Ant7445G、Ant827G、Gnt7444A 等突变未检出。
本研究提示AmAn诱发的药物性耳聋在各年龄段均可出现,不能忽视线粒体基因突变的检测,特别是有AmAn用药史、母系家族遗传史的患者;12S rRNA基因突变携带者发现后,要再检查未耳聋的母系成员,可早期发现相同突变携带者,能对其进行用药指导,避免药物性耳聋的发生。本研究建立的常见聋病基因分型快速检测方法,能了解GJB2、12S rRNA等基因突变的情况,能提高基因突变检出率, 可为本地区耳聋遗传咨询和聋病基因筛查提供依据。
[1] Xin F,Yuan Y,Deng X.Genetic mutations in nonsyndromic deafness patients of Chinese minority and han ethnicities in Yunnan, China[J].J Transl Med,2013,11:312-21.
[2] 朱一鸣,郭玉芬,刘晓雯,等.陕西省部分聋哑学生聋病易感基因分子流行病学研究[J].听力学及言语疾病杂志,2010,18(3):225-8.
[3] 管敏鑫, 赵立东.与氨基糖苷类抗生素耳毒性相关的线粒体12S rRNA突变的流行病学特征[J].中华耳科学杂志,2006,4(2):98 -105.
[4] 曹 云,冯大飞,张 磊. 线粒体MT-RNR1基因突变与药物性聋[J].听力学及言语疾病杂志,2013,21(4):428-30.
[5] Mahmoud R F,Lubna M D,Samir A,et al.Screening for the mitochondrialA1555G mutation among Egyptian patients with non-syndromic, sensorineural hearing loss[J]. Int J Mol Epidemiol Genet,2014,5(4):200-4.
[6] Wei Q,Liu Y,Wang S,et al.A novel compound heterozygous mutation in the GJB2 gene causing non-syndromic hearing loss in a family[J].Int J Mol Med,2014,33(2):310-6.
[7] 徐 彬,余元勋,鲍远程,等.肝豆状核变性中ATP7B基因复合突变的研究[J].第二军医大学学报,2014,35(11):1209-14.
[8] 程家蓉,关赛芳,王学励,等.从人口腔细胞获取基因组DNA作基因多态性分析的可行性[J]. 癌症,2005,24(7):893-7.
[9] Dai P, Yu F, Han B, et al. GJB2 mutation spectrum in 2,063 Chinese patients with nonsyndromic hearing impairment[J].J Transl Med,2009,7:26.
[10]Guan M X. Prevalence of mitochondrial 12S rRNA mutations associated with aminoglycoside ototoxicity[J]. Mitochondrion, 2011,11(2):237-45.
[11]赵 芳,张芩娜.一母系遗传氨基糖苷类抗生素致聋家系线粒体DNA A1555G 突变检测[J].中华耳科学杂志,2010,8(1):40-5.
[12]戴大春,鲁雅洁,陈智斌,等.非综合征耳聋患者线粒体DNA12S rRNA及tRNAser(UCN) 基因序列分析[J].南京医科大学学报,2012,32(1):67-71.
[13]邓 蔚,于 飞,戴 朴,等. 福州市特教学校非综合征性聋分子病因学分析-GJB2 235delC突变和线粒体DNA 12S rRNA A1555G突变筛查报告[J].中华耳科学杂志, 2006,4(1):12-4.
[14]何 勇, 孙 勍, 戴 朴,等. 武汉地区非综合征性聋分子病因学分析-GJB2 235delC突变和线粒体DNA 12S rRNA A1555G突变筛查报告[J].中华耳科学杂志, 2006,4(1):24-6.
[15]Zhao L,Young W Y, Li R, et al.Clinical evaluation and sequence analysisof the complete mitochondrial genome of three Chinese patients with hearing impairment associated with the 12S rRNA 1095 T>C mutation[J].Biochem Biophys Res Commun,2004,325(4):1503-8.
AbstractObjectiveTostudytherelationshipofthegenemutationsofAnhuiHanpeopleaminoglycosidesantibioticsinduceddeafness(AAID)patientsandnon-syndromichearingloss(NSHL),andsetupnext-generationsequencing(NGS)oforalmucosalcellsgenomaDNA.MethodsFrom122casesofNSHLpatientsand120casesofhealthychildren,wegottheoralmucosalcellsgenomaDNAsandusingNGSsequencedGJB2,12SrRNAgenes.ResultsThegenomaDNAsoforalmucosalcellsweregoodqualityforNGSstudy.In122casesofNSHLpatients,wefoundGJB2genemutationsof28casea(22.95%),andfound12SrRNAgenemutationsof10casea(8.20%).In120casesofhealthychildren,wedidnotfindanymutation(P<0.01).ConclusionNGSsequencingmethodoforalmucosalcellsgenomaDNAcanbeusedfordetectingthemutationsofAnhuiHanpeopleAAID.ThemutationsofGJB2,12SrRNAgenesinAnhuiNSHLpatientshavesomedifferentcharictersandcanhelptostudythegenemutationsofAnhuiHanpeopleAAID.
Keywordsoralmucosalcell;deafness;mutation;GJB2;12SrRNA
Comparative study of abdominal imaging quality between mixed energy mode and mono-energy mode reconstruction on dual-energy spectral CT
Wei Wei, Deng Kexue, Zhao Yingming, et al
(DeptofRadiology,AffiliatedProvincialHospitalofAnhuiMedicalUniversity,Hefei230001)
ObjectiveToevaluatethedifferenceofmixedenergymodeandmono-energymodereconstructionimagesonabdomenspectralCTimaging.MethodsAbdomenpre-contrastandcontrastenhancedCTscanswereappliedwithspectralCTonsixtypatients.Imageswerereconstructedbytwo-modes:QCmodeandMonomode.Thefollowingvariableswerecompared:signal-to-noise(SNR)ofliver,spleenandpancreas,contrast-to-noise(CNR)ofliver,spleenandpancreas.Twoexperiencedradiologistsevaluatedtheartifactlevelofimagesofthetworeconstructionmodes.ResultsComparedwithmixed-energymodeimages,70keVmono-energyimagesyieldedsignificantlygreaterSNRandCNR(P<0.05).Subjectivescoreof70keVmono-energyimageswashigherthanthatofmixed-energyimage(P<0.001).ConclusionInabdominalspectralCTimaging,mono-energyreconstructioncanprovidehigherqualityofimagesthanmixed-energyreconstructionandcanreplacemixed-energyimagesinclinicaldiagnosis.
abdomen;computedtomography;X-raycomputed;spectralCT;reconstructionmode
Research of genetic mutation in Anhui Han people AAID patients
Xu Bin,Yu Yuanxun,Wang Yingxin,et al
(AnhuiMedicalGeneticsCenterinAnhuiMedicalCollege,Hefei230061)
安徽高校省级自然科学研究项目(编号:KJ2014A128)
安徽医学高等专科学校省遗传医学中心,合肥 230061
徐 彬,男,副研究员,责任作者,E-mail:xb.1030@163.com
时间:2016-10-12 13:23:00
http://www.cnki.net/kcms/detail/34.1065.R.20161012.1323.022.html
R 969.3
A
1000-1492(2016)11-1653-05
10.19405/j.cnki.issn1000-1492.2016.11.023
2016-06-22接收
