RACK1突变体在哺乳动物细胞中的表达及定位研究
2016-12-14朱亮亮王蓓华耿慧武潘林鑫刘晓颖范礼斌
朱亮亮,韩 卢,王蓓华,耿慧武,潘林鑫,刘晓颖,范礼斌
RACK1突变体在哺乳动物细胞中的表达及定位研究
朱亮亮,韩 卢,王蓓华,耿慧武,潘林鑫,刘晓颖,范礼斌1
目的 根据活化蛋白激酶C受体1(RACK1)的蛋白结构,构建其缺失突变体的真核表达质粒,研究RACK1缺失突变体在真核细胞内的表达及定位改变。方法 根据RACK1蛋白的结构域特点,以pcDNA3.1-RACK1-FLAG为模板,构建真核表达质粒pcDNA3.1-RACK1(51-317)-FLAG、pcDNA3.1-RACK1(93-317)-FLAG、pcDNA3.1-RACK1(135-317)-FLAG、pcDNA3.1-RACK1(180-317)-FLAG、pcDNA3.1-RACK1(219-317)-FLAG;Western blot检测上述重组质粒在HEK 293T细胞中的表达;免疫荧光技术检测RACK1的各缺失突变体在COS7细胞中的定位情况。结果 成功构建了RACK1各缺失突变体的真核表达质粒;Western blot结果表明,除pcDNA3.1-RACK1(219-317)-FLAG外,其余缺失突变体在HEK 293T细胞中均有效表达;免疫荧光实验表明RACK1缺失突变体在COS7细胞中主要定位在胞质,细胞核中也有少量分布。结论 成功构建了RACK1缺失突变体真核表达质粒,并在HEK 293T和COS7细胞中成功表达;在COS7细胞中不同缺失突变体的表达定位均有差异,与野生型的RACK1相比也有所不同,表明缺失不同的结构域后其在细胞中的定位表达也发生了改变。这为研究RACK1各结构域的功能提供了重要依据。
突变体;质粒构建;免疫荧光;Western blot;结构域
活化蛋白激酶C受体1(the receptor for activated C kinase 1,RACK1)是由7个WD40(Trp-Asp)重复结构域组成的36 ku的细胞内支架蛋白,首先是作为锚定蛋白并激活胞内受体蛋白激酶C(PKC)被报道[1],且能与PKCβ Ⅱ相互作用[2]。RACK1也命名为鸟嘌呤核苷酸结合蛋白β亚基类似物1(GNB2L1),确定为WD40结构域蛋白家族成员,在大分子复合物中广泛存在[3]。RACK1可以与不同的信号分子如PER1、PKCe、Src相互作用,并作为多种蛋白质与蛋白质相互作用的平台[4-7]。对于许多激酶和受体来说RACK1作为一种支架蛋白,在许多生物反应中起着至关重要的作用,包括免疫应答、细胞生长、黏附、迁移和分化等[8-10]。该研究根据RACK1的7个WD40重复结构域,对其进行逐个缺失,并构建重组质粒。了解各缺失突变体的表达及定位情况,比较各缺失突变体与野生型的差异,进一步探索各结构域的不同功能。
1 材料与方法
1.1 材料
1.1.1 细胞系、菌株等 HEK 293T、COS7、感受态E.coliTG1细胞、真核表达载体pcDNA3.1(+)、pcDNA3.1-RACK1-FLAG均为安徽医科大学生物教研室保存。
1.1.2 主要试剂与仪器 Prime Star酶购自日本TaKaRa公司;限制性内切酶Hind Ⅲ、EcoR Ⅴ、T4 DNA连接酶及Lambda DNA EcoR Ⅰ+Hind Ⅲ Marker购自加拿大Fermentas公司;AxyPrep DNA Gel Extraction Kit购自美国Axygen公司;Plasmid Mini Kit 购自美国Omega Bio-TEK公司;DMEM高糖培养基购自北京赛默飞世尔科技有限公司;胎牛血清购自美国Hyclone公司;LipofectamineTM2000、Opti-MEM购自美国Invitrogen公司;FLAG M2单抗购自美国Sigma公司;TRITC/FITC标记山羊抗小鼠IgG购自北京中杉金桥生物技术有限公司;荧光封片胶购自丹麦DAKO公司;PVDF膜购自加拿大BioBasi公司;ECL显色试剂盒购自美国Pierce公司;荧光显微镜(Leica DMI 6000型)购自德国Leica公司。
1.2 方法
1.2.1 运用NCBI数据库分析 RACK1序列,划分RACK1的7个WD40区域。RACK1是G蛋白β亚基的高度同源物,根据G蛋白β亚基的晶体结构使用PyMOL软件绘制RACK1的三维结构彩图。
1.2.2 缺失突变体的构建 根据目的基因序列和引物设计原则设计特异性引物,引物由通用生物系统(安徽)有限公司合成,具体引物设计见表1。以pcDNA3.1-RACK1-FLAG为模板,使用厂商推荐的PCR反应程序用Prime Star酶扩增目的序列,产物由琼脂糖凝胶电泳分离,并用凝胶回收试剂盒回收纯化。扩增产物以及真核表达载体pcDNA3.1(+)用限制性内切酶Hind Ⅲ、EcoR Ⅴ进行酶切。酶切产物经T4 DNA连接酶16 ℃连接过夜;连接产物转化到感受态细胞TG1,均匀涂布于含氨苄抗性的LB培养皿上,37 ℃倒置培养8~12 h;挑取单克隆于含有氨苄抗性的LB培养基中37 ℃震荡过夜;SDS碱裂解法抽提质粒并酶切鉴定,选择1管鉴定正确的质粒送通用生物系统(安徽)有限公司测序。
1.2.3 细胞培养 COS7细胞和HEK 293T细胞均在含5%胎牛血清的高糖DMEM培养基中培养,培养过程中加入双抗(青霉素、链霉素)并置于37 ℃、5%CO2的培养箱中。
1.2.4 瞬时转染 蛋白表达实验中,待转染前1 d接种的HEK 293T细胞长至80%~90%的汇合度时,按照脂质体LipofectamineTM2000的说明书将重组质粒瞬时转染于细胞中,培养48 h。在荧光定位实验中,转染前1 d在35 mm的培养皿中置盖玻片接种的细胞长至40%~50%的汇合度时,将重组质粒瞬时转染于细胞中,培养24 h。
1.2.5 Western blot检测蛋白表达 转染48 h后收集细胞,将细胞悬浮于细胞裂解液中4 ℃混旋裂解0.5~1 h,4 ℃、14 000 r/min离心20 min,分别收集上清液和沉淀;取50 μl上清液与等量2×SDS上样缓冲液混合,沉淀中直接加入适量2×SDS,沸水浴煮5 min,12 000 r/min离心5 min后进行SDS-PAGE电泳;电泳结束后100 V恒压电转1 h;室温下用含5%脱脂奶粉的TBST溶液封闭PVDF膜2 h,FLAG 一抗(1 ∶500)4 ℃孵育过夜,TBST漂洗3次(每次10 min);二抗(1 ∶5 000)室温孵育1.5 h,TBST漂洗3次(每次15 min);于暗室中ECL显色试剂盒显影。
1.2.6 免疫荧光 COS7细胞转染24 h后取出盖玻片,用预冷的PBS洗去残留的培养基后,分别用甲醇和70%的乙醇溶液固定细胞;1%脱脂奶粉溶液封闭30 min;FLAG一抗(1 ∶200,用封闭液稀释)室温孵育2 h;TRITC标记的山羊抗小鼠IgG 二抗(1 ∶200,用TBST稀释)室温孵育1 h;0.15 g/L DAPI溶液染核;荧光封片胶Dako将盖玻片封于载玻片上。4 ℃储存过夜,用共聚焦荧光显微镜观察其定位。
2 结果
2.1 RACK1三维结构图像和结构域分区 RACK1是G蛋白β亚基的同源物,根据其晶体结构用PyMOL软件绘制RACK1的三维结构图。见图1A,RACK1的结构是一个显著不对称的七叶片螺旋桨结构,并插入两个显著的回环,一个在叶片Ⅲ和Ⅳ之间另一个在叶片Ⅵ和Ⅶ之间,从晶体结构上看RACK1的N末端和C末端之间有部分交叉。依据NCBI数据库分析RACK1的序列,将RACK1的317个氨基酸分成了不等的7个WD40结构域,并按照逐个缺失的方式构建了5个缺失突变体,见图1B。

表1 引物序列
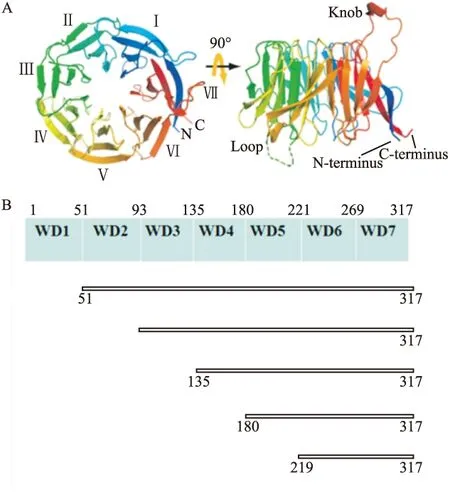
图1 RACK1晶体结构和结构域图
A:RACK1晶体结构(左边是俯视图,Ⅰ到Ⅶ每个叶片都贴上标签并使用CHAINBOWs设计着色;右边是侧视图);B:RACK1结构域 野生型RACK1被分成7个不等的结构域,并以此设计5个突变体
2.2 RACK1缺失突变体PCR扩增产物及重组质粒的鉴定 对提取的重组质粒pcDNA3.1-RACK1(51-317)-FLAG、pcDNA3.1-RACK1(93-317)-FLAG、pcDNA3.1-RACK1(135-317)-FLAG、pcDNA3.1-RACK1(180-317)-FLAG、pcDNA3.1-RACK1(219-317)-FLAG;进行HindⅢ、EcoR Ⅴ酶切鉴定,经与Marker的比对表明连接成功,见图2。测序结果进一步证实目的片段正确插入到pcDNA3.1(+)载体中。
2.3 RACK1突变体在哺乳动物细胞中的表达 对转染了pcDNA3.1-RACK1(51-317)-FLAG、pcDNA3.1-RACK1(93-317)-FLAG、pcDNA3.1-RACK1(135-317)-FLAG、pcDNA3.1-RACK1(180-317)-FLAG、pcDNA3.1-RACK1(219-317)-FLAG的HEK293T细胞,48 h后收集细胞并进行Western blot检测。如图3A所示,除pcDNA3.1-RACK1(219-317)-FLAG外,其它突变体裂解液均检测到相应的目的条带。而在沉淀中所有的突变体均有表达,如图3B所示。与蛋白Marker比较,条带与预期的一致,即分别为30、25、20、15和10 ku。表明RACK1的5个缺失突变体均能在HEK 293T细胞中表达。
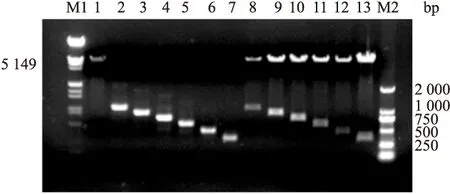
图2 重组质粒酶切鉴定图
M1:Lambda DNA/EcoR Ⅰ+Hind Ⅲ Marker;M2:TaKaRa DL2000 Marker;1:pcDNA3.1(+)载体酶切鉴定结果;2、8:pcDNA3.1-RACK1-FLAG的PCR产物和酶切鉴定结果;3、9:pcDNA3.1-RACK1(51-317)-FLAG的PCR产物和酶切鉴定结果;4、10:pcDNA3.1-RACK1(93-317)-FLAG的PCR产物和酶切鉴定结果;5、11:pcDNA3.1-RACK1(135-317)-FLAG的PCR产物和酶切鉴定结果;6、12:pcDNA3.1-RACK1(180-317)-FLAG的PCR产物和酶切鉴定结果;7、13:pcDNA3.1-RACK1(219-317)-FLAG的PCR产物和酶切鉴定结果
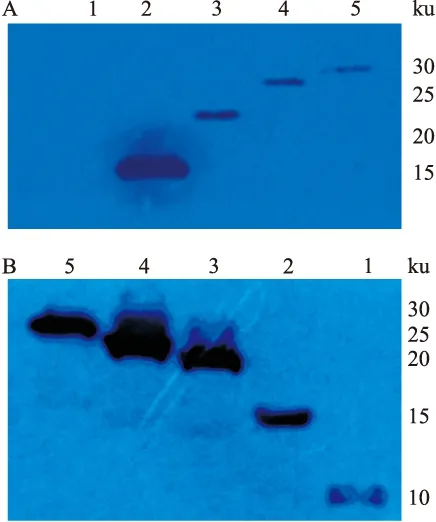
图3 Western blot检测RACK1突变体在哺乳动物细胞中的表达
A:转染了相应缺失突变体的HEK 293T细胞裂解液;B:转染了相应缺失突变体的HEK 293T细胞沉淀;1:pcDNA3.1-RACK1(219-317)-FLAG;2:pcDNA3.1-RACK1(180-317)-FLAG;3:pcDNA3.1-RACK1(135-317)-FLAG;4:pcDNA3.1-RACK1(93-317)-FLAG;5:pcDNA3.1-RACK1 (51-317)-FLAG
2.4 RACK1突变体在COS7细胞中的定位 转染了RACK1突变体质粒的COS7细胞,24 h后取出进行免疫荧光制片并在荧光显微镜下观察其定位。
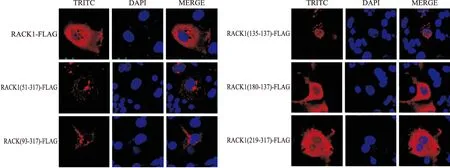
图4 RACK1突变体在COS7细胞中的定位 ×600
红色:带FLAG标签的RACK1突变体蛋白;蓝色:DAPI染色的细胞核;TRITC:FLAG荧光二抗;DAPI:细胞核染料;MERGE:组合图
如图4所示,pcDNA3.1-RACK1(51-317)-FLAG主要定位在细胞质并成点状分布,细胞核中有极少表达;pcDNA3.1-RACK1(93-317)-FLAG与pcDNA3.1-RACK1(51-317)-FLAG在COS7细胞中的定位相同;pcDNA3.1-RACK1(135-317)-FLAG主要定位在细胞核中,但细胞质中也有部分点状分布;pcDNA3.1-RACK1(180-317)-FLAG与pcDNA3.1-RACK1(219-317)-FLAG主要定位在细胞质中且成弥散式的分布,与其他突变体一样在细胞核中也有部分表达,但相对量较多;在定位发生变化的同时,各突变体的表达量也发生了变化。随着WD40区域的减少,RACK1突变体在COS7中的定位发生了一定的变化,可能是由于在减少WD40结构域的同时其酸碱性氨基酸发生了变化,导致其在细胞中的定位发生了变化。
3 讨论
本研究设计并构建了5个带FLAG标签的RACK1缺失突变体,并分别将其转染至HEK 293T和COS7细胞中,结果显示,所有缺失突变体均能在HEK 293T细胞中表达,但pcDNA3.1-RACK1(219-317)-FLAG在上清液中不表达而在沉淀中表达,这可能是pcDNA3.1-RACK1(219-317)-FLAG在HEK 293T细胞中的细胞膜上表达,不能被溶解到裂解液中而留在沉淀中。在COS7细胞中,缺失突变体pcDNA3.1-RACK1(51-317)-FLAG和pcDNA3.1-RACK1(93-317)-FLAG主要成点状分布在细胞质中,这可能是因为WD2和WD3区域含较多的酸性氨基酸,缺失突变体pcDNA3.1-RACK1(135-317)-FLAG主要分布在细胞核中,但细胞质中也有少量点状分布,这可能是因为WD4区域含较多的双碱性氨基酸,这些缺失突变体与野生型RACK1的细胞定位相比有明显的变化[11-12];缺失突变体pcDNA3.1-RACK1(180-317)-FLAG、pcDNA3.1-RACK1(219-317)-FLAG主要在胞质与核膜处成弥散型分布,细胞核中有少量分布,与野生型RACK1的细胞定位未发生明显变化。随着WD40结构域的缺失其细胞定位随之也发生了变化,表明不同的WD40结构域对细胞定位可能有不同的影响。在定位发生变化的同时,各突变体的表达量也发生了变化,可能存在的原因有待进一步研究。
WD40蛋白广泛存在于真核细胞中[11],特别是在人源基因中[12],其特征在于由40到60个不等的重复氨基酸组成,其内部含有两个保守的肽序列,甘氨酸-组氨酸(GH)和色氨酸-天冬氨酸(WD)[13-14]。含WD40的蛋白会参与诸如信号转导,染色质修饰和转录调控的基本机制。RACK1含有7个重复的WD40区域,可能具备所有WD40蛋白家族的特征。与其相互作用的蛋白都特异性结合在特定的WD区域,如Src、PDE4D5、PKCβ、干扰素受体等的结合区域都在WD5-7范围[15]。RACK1的WD6与WD7结构域能够与pkd2L1的Ala19-Pro45片段相互作用。表明RACK1的不同WD40区域可能具备不同的功能。研究显示野生型RACK1可与CLIC1蛋白相互作用,本研究表明在缺失不同的WD40区域后其仍可在哺乳动物细胞中表达,故可进一步研究RACK1的不同缺失突变体是否与CLIC1蛋白存在相互作用,以及相互作用的具体区域。
[1] Ron D, Mochly-Rosen D. Agonists and antagonists of protein kinase C function, derived from its binding proteins[J]. J Biol Chem,1994,269(34):21395-8.
[2] Ron D,Chen C H,Caldwell J,et al.Cloning of an intracellular receptor forprotein kinase C:a homolog of the beta subunit of G proteins[J].Proc Natl Acad Sci USA,1994,91(3):839-43.
[3] Adams D R,Ron D,Kiely P A.RACK1, A multifaceted scaffolding protein:structure and function[J].Cell Commun Signal,2011,9:22.
[4] Hu L,Lu F, Wang Y, et al.RACK1,a novel hPER1-interacting protein[J].J Mol Neurosci,2006,29(1):55-63.
[5] Besson A,Wilson T L,Yong V W. The anchoring protein RACK1 links protein kinase C epsilon to integrin beta chains.Requirements for adhesion and motility[J].J Biol Chem,2002,277(24):22073-84.
[6] Chang B Y,Chiang M,Cartwright C A.The interaction of Src and RACK1 is enhanced by activation of protein kinase C and tyrosine phosphorylation of RACK1[J]. J Biol Chem,2001,276(23):20346-56.
[7] Sklan E H, Podoly E, Soreq H. RACK1 has the nerve to act: structure meets function in the nervous system[J]. Prog Neurobiol,2006,78(2):117-34.
[8] McCahill A,Warwicker J,Bolger G B,et al.The RACK1 scaffold protein: a dynamic cog in cell response mechanisms[J].Mol Pharmacol,2002,62(6):1261-73.
[9] Mamidipudi V, Dhillon N K, Parman T, et al. RACK1 inhibits colonic cell growth by regulating Src activity at cell cycle checkpoints[J].Oncogene,2007,26(20):2914-24.
[10]Berns H, Humar R, Hengerer B, et al. RACK1 is up-regulated in angiogenesis andhuman carcinomas[J]. FASEB J,2000,14:2549-58.
[11]Janda L,Tichy P, Spízek J, et al. A deduced Thermomonospora curvata protein containing serine/threonine protein kinase and WD-repeat domains[J]. J Bacteriol,1996,178(15):1487-9.
[12]Letunic I,Doerks T,Bork P. SMART:recent updates, new developments and status in 2015[J]. Nucleic Acids Res,2014, 43:257-60.
[13]Yu L,Gaitatzes C,Neer E,et al.Thirty-plus functional families from a single motif[J].Protein Sci,2000,9(12):2470-6.
[14]Van Nocker S, Ludwig P. The WD-repeat protein super family in Arabidopsis: conservation and divergence in structure and function[J].BMC Genomices,2003,4(1):50.
[15]McCahill A,Warwicker J,Bolger G B, et al.The RACK1 scaffold protein:a dynamic cog in cell response mechanisms[J]. Mol Pharmacol, 2002, 62(6):1261-73.
Expression and localization of RACK1 mutants in mammalian cell
Zhu Liangliang, Han Lu, Wang Beihua,et al
(DeptofBiology,AnhuiMedicalUniversity,Hefei230032)
ObjectiveTo construct the eukaryotic expression plasmids of the receptor for activated C kinase 1 (RACK1) deletion mutants according to the protein structure of RACK1 and observe the expression and cellular localization of RACK1 mutants in the eukaryotic cells.MethodsAccording to the characteristics of RACK1 domains, the eukaryotic expression plasmids pcDNA3.1-RACK1 (51-317)-FLAG, pcDNA3.1-RACK1 (93-317)-FLAG, pcDNA3.1-RACK1 (135-317)-FLAG, pcDNA3.1-RACK1 (180-317)-FLAG, and pcDNA3.1-RACK1 (219-317)-FLAG were constructed. The expressions of RACK1 mutants plasmids in HEK 293T cells were detected by Western blot and the localizations in COS7 cells were detected by immunofluorescence technique.ResultsAll the plasmids of RACK1 mutants were successfully constructed. Western blot results indicated that all the mutants in HEK 293T cells expressed effectively except pcDNA3.1-RACK1(219-317)-FLAG. Immunofluorescence experiments indicated that RACK1 mutants localized both in cytoplasm and nucleus, mainly in cytoplasm.ConclusionRecombinant plasmids of RACK1 mutants are constructed successfully and express effectively in HEK 293T cells and COS7 cells. However there are differences in the expression and localization of the different mutants in COS7 cells, and to contrast with the wild-type RACK1 are also similar. This situation indicates that the expression and cellular localization have some changes happened when there are some domains deficient in the RACK1 protein. The study is very important for exploring the function of the different domains of RACK1.
mutant;recombinant plasmids;fluorescence;Western blot;domain
国家自然科学基金青年基金(编号:81201368)
安徽医科大学生命科学学院生物学系,合肥 230032
朱亮亮,男,硕士研究生; 刘晓颖,女,副教授,责任作者,E-mail:liuxiaoying@ahmu.edu.cn; 范礼斌,男,教授,硕士生导师,责任作者,E-mail:lfan@ahmu.edu.cn
时间:2016-10-12 13:23:00
http://www.cnki.net/kcms/detail/34.1065.R.20161012.1323.009.html
Q 28;R 392.7
A
1000-1492(2016)11-1595-05
10.19405/j.cnki.issn1000-1492.2016.11.009
2016-07-07接收
