霍山石斛多糖对肥胖小鼠氧化应激的影响
2016-12-14谷仿丽陈乃富余茂耘徐海军
谷仿丽,陈乃富,余茂耘,徐海军
(1.皖西学院 生物与制药工程学院,安徽 六安 237012;2.安徽省石斛产业化开发协同创新中心,安徽 六安 237012)
霍山石斛多糖对肥胖小鼠氧化应激的影响
谷仿丽1,2,陈乃富1,2,余茂耘1,徐海军1,2
(1.皖西学院 生物与制药工程学院,安徽 六安 237012;2.安徽省石斛产业化开发协同创新中心,安徽 六安 237012)
为了探讨霍山石斛多糖对肥胖小鼠氧化应激的影响,给予高脂饮食8周复制肥胖小鼠模型,给予霍山石斛多糖7周,检测小鼠体重、Lee’s、体脂比、血清游离脂肪酸(FFA)、血清胰岛素(INS)、空腹血糖(FBG)、肝谷胱甘肽过氧化物酶GSH-Px)、肝过氧化物歧化酶(SOD)、肝总抗氧化能力(T-AOC)和丙二醛(MDA)。结果显示:霍山石斛高剂量组显著降低模型小鼠体重、Lee’s、体脂比、FFA、INS、和MDA,显著提高GSH-Px、SOD、T-AOC水平 (P<0.05v模型组),FBG有降低趋势,但不显著。因此,霍山石斛多糖具有降低肥胖小鼠氧化应激的作用。
霍山石斛;多糖;小鼠;氧化应激
石斛为兰科石斛属的常用名贵中药材,具有滋阴清热、益胃生津、润肺止咳的功效;霍山石斛为石斛属一种,主要分布于安徽霍山县及邻近地区[1],以其味甘、粘质厚成为石斛中的极品,备受历代医家推崇[2]。由于人们掠夺性的采挖野生霍山石斛,致使资源已近枯竭,市场供不应求;为此,本课题组进行霍山石斛组织快繁研究及原产地大规模种植研究,成功解决了资源紧缺的问题,为探讨霍山石斛为石斛中“极品”的现代药理学研究提供了物质基础。
随着我国经济的发展和人们生活水平的不断提高,城乡居民的膳食结构发生了巨大的变化,表现为膳食结构趋向高能量密集、脂肪和糖类摄入过多,体内能量代谢旺盛,自由基增加从而诱发氧化应激。研究证明氧化应激是许多疾病发生发展过程的共同作用机制,这些疾病包括心血管疾病、胰岛素抵抗性糖尿病、非酒精性脂肪肝、炎性肠病等[3-5]。目前,已有研究报道,应用抗氧化剂可清除自由基,从而防止或改善机体的氧化应激状态[6]。
据报道[7-8],霍山石斛多糖具有较好的抗氧化作用。因此,本课题组拟通过测定霍山石斛多糖对高脂膳食诱导的肥胖小鼠体重、Lee’s、体脂比、血清游离脂肪酸(Free fatty acids,FFA)、血清胰岛素(Insulin,INS)、空腹血糖(Fasting blood glucose,FBG)、肝谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)、肝过氧化物歧化酶(Superoxide dismutase,SOD)、肝总抗氧化能力(Total antioxidant capacity,T-AOC)和丙二醛(Malona-ldehyde,MDA)的影响相关数据,探讨霍山石斛多糖对高脂膳食诱导的肥胖小鼠氧化应激的影响,为霍山石斛的进一步开发应用打下基础。
1 材料
1.1 实验动物
健康清洁级C57BL/6J小鼠,雄性,体重18~22 g,购自南京医科大学动物实验中心,许可证号:SCXK(苏) 2002—0031。
1.2 药品及试剂
霍山石斛多糖:霍山石斛,安徽省石斛产业化开发协同创新中心提供;普罗布考:由颈复康药业有限公司生产,批号:H10960161;GSH-Px、SOD、T-AOC、MDA检测试剂盒,购自南京建成生物工程研究所;熊去氧胆酸片:上海中西三维药业有限公司生产,批号:H31021950;丙基硫氧嘧啶:上海朝晖药业有限公司,批号:H31021082;猪油等。
1.3 仪器
TU-1901紫外可见分光光度计,北京普析通用仪器有限责任公司;RE-52A型旋转蒸发仪,上海亚荣生化仪器厂;超声波清洗器,离心机等。
2 方法
2.1 霍山石斛多糖制备
新鲜霍山石斛,洗净,50 ℃烘干,粉碎过40目筛,烘干至恒重,乙醇脱脂、脱色,烘干,根据文献[9]方法提取霍山石斛多糖,采用硫酸-苯酚法测定霍山石斛多糖含量。
2.2 高脂乳剂的配制
按文献[10]方法,以猪油∶胆固醇∶熊去氧胆酸∶丙基硫氧嘧啶=100∶20∶1∶2的比例制备高脂乳,添加至小鼠饲料中。
2.3 动物分组及处理
选取健康雄性小鼠72只,随机分为6组,分别为正常对照组(12只)、高脂模型组,分别给予普通饲料、高脂饲料,喂养1周后,开始干预实验。每组动物均自由取食、饮水。
2.4 干预用药
在该例句中,“junk food”形容生活中不健康的食品,译语和源语都存在类似的意象,可以在译文中把源概念域“junk food”直译出来对应于目的概念域“垃圾食品”。
于给予高脂膳食1 w后,将高脂模型组小鼠随机分为模型组、霍山石斛多糖(高、中、低)剂量组、阳性药组(普罗布考),分别给予纯净水20 ml·kg-1·d-1、高、中、低剂量霍山石斛多糖(0.2 g·kg-1·d-1, 0.1 g·kg-1·d-1, 0.05 g·kg-1·d-1),普罗布考0.2 g·kg-1·d-1,正常组给予纯净水20 ml·kg-1·d-1、每天1次,连续干预7 w。
2.5 指标测定
2.5.1 肥胖测量指标
分别于实验初、终测体重(g),于末次药后测Lee’s指数(%)、体脂比(%)。测量方法如下:Lee’s指数(%)=体重1/3/体长×1000,[体重(g),体长(cm)为腹侧鼻尖到肛门];体脂比(%)=内脏脂肪(睾周脂肪重+肾周脂肪重)/空腹体重×1 00,[重量(g)]。
2.5.2 样本采集
禁食12 h,麻醉后摘眼球取血,检测血清游离脂肪酸、血清胰岛素、血糖等指标;迅速解剖腹腔取新鲜肝组织,生理盐水洗去残留血液后,滤纸拭干,液氮保存,测前低温状态下制成1%肝匀浆,测肝谷胱甘肽过氧化物酶(GSH-Px)、肝过氧化物歧化酶(SOD)、肝总抗氧化能力(T-AOC)和丙二醛(MDA)。
2.6 数据统计
3 结果
3.1 对高脂膳食诱导的肥胖小鼠体重、Lee’s、体脂比的影响
高脂膳食饲喂及用药期间,小鼠活动正常,精神尚可,模型组及普罗布考组由于灌胃不当死亡3只。随饲喂时间的延长,模型组小鼠终体重、Lee’s、体脂比显著升高(P<0.05,P<0.01对比正常组);而霍山石斛高剂量组、普罗布考组小鼠终体重、Lee’s、体脂比显著下降(P<0.05,P<0.01对比模型组)。见表1。
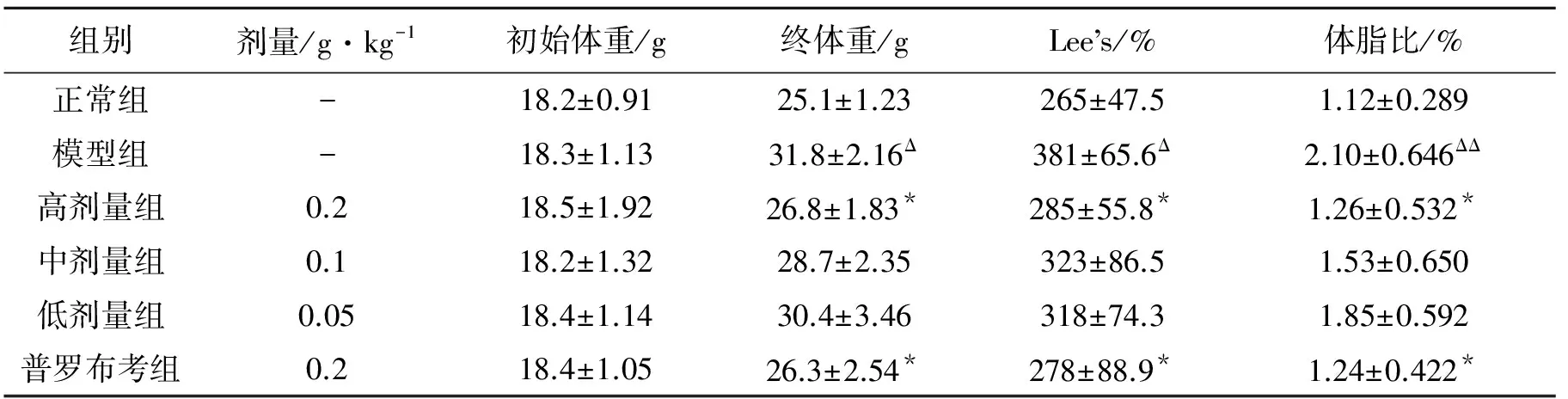
表1 霍山石斛多糖对高脂膳食诱导的肥胖小鼠体重、Lee’s、体脂比的影响
注:ΔP<0.05 ΔΔP<0.01与正常组比较;*P<0.05与模型组比较
3.2 对高脂膳食诱导的肥胖小鼠游离脂肪酸、胰岛素、血糖的影响
如表2。与正常组比较,模型组血清游离脂肪酸、胰岛素显著升高(P<0.01),空腹血糖有升高趋势,但不明显。与模型组比较,霍山石斛高剂量组、普罗布考组小鼠游离脂肪酸、胰岛素显著下降(P<0.05),空腹血糖有下降趋势,但不显著。
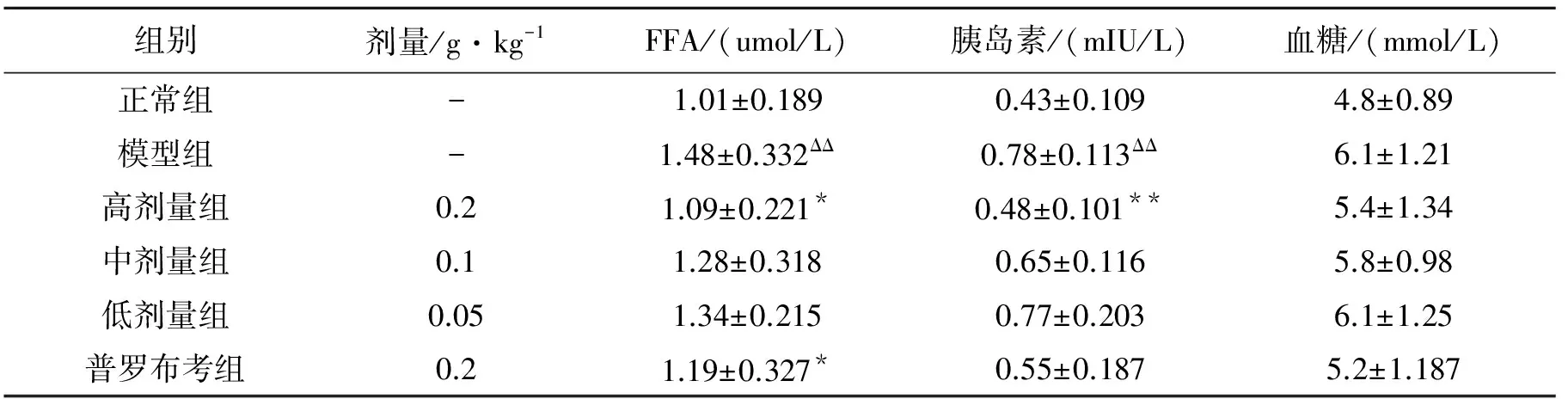
表2 霍山石斛多糖对高脂膳食诱导的肥胖小鼠游离脂肪酸、胰岛素、血糖的影响
注:ΔΔP<0.01对比正常组;*P<0.05, **P<0.01对比模型组
3.3 对高脂膳食诱导的肥胖小鼠肝组织氧化应激的影响
如表3。模型组小鼠肝组织GSH-Px、SOD、T-AOC显著降低,MDA显著升高(P<0.05,P<0.01对比正常组)。霍山石斛高剂量组、普罗布考组小鼠肝组织GSH-Px、SOD、T-AOC显著升高,MDA显著下降(P<0.05对比模型组)。
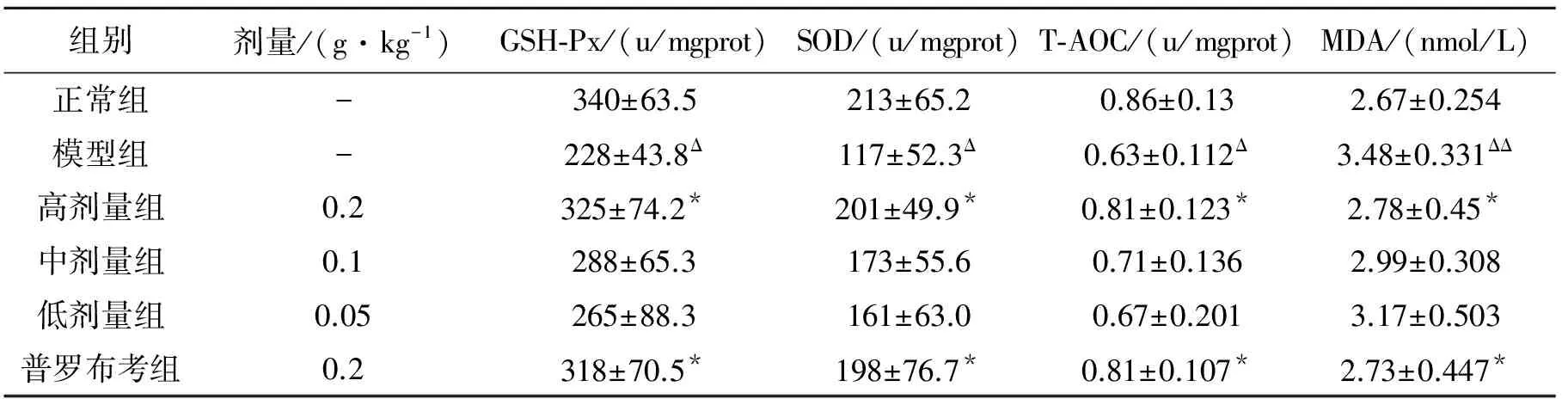
表3 霍山石斛多糖对高脂膳食诱导的肥胖小鼠肝组织氧化应激的影响
注: ΔP<0.05 ΔΔP<0.01对比正常组;*P<0.05 对比模型组
4 讨论
C57BL/6J小鼠经高脂饲料喂食4周即可形成肥胖模型,具有造模周期短、指标稳定、肥胖特征明显等特点[11]。本实验选C57BL/6J小鼠复制肥胖模型,经喂食8周高脂饲料后,模型小鼠终体重、Lee’s、体脂比显著升高,表明肥胖模型成功。
当机体摄入大量脂肪,脂肪分解增加使体内血清FFA升高,刺激活性氧产生[12],导致氧化应激,损伤肝、胰腺、心肌、血管等靶器官[13]。
正常情况下,肝组织抗氧化酶GSH-Px、SOD能将有毒的过氧化物转化为无毒物质,保护肝细胞;T-AOC的高低能反应机体总的抗氧化能力强弱;MDA是膜脂质过氧化反应最重要的产物之一,反应机体过氧化反应的强弱;当GSH-Px、SOD、T-AOC降低,MDA升高,表明肝组织受到了氧化应激损失。高脂饮食小鼠FFA升高,使肝脏产生氧化应激反应,引起模型小鼠肝GSH-Px、SOD、T-AOC显著降低,MDA显著升高;给予高剂量霍山石斛多糖干预7W后,小鼠肝GSH-Px、SOD、T-AOC显著升高,MDA显著降低,表明霍山石斛多糖具有良好抗高脂饮食诱导的肥胖小鼠氧化应激的功效。
胰腺产生氧化应激损伤,引起胰岛素分泌升高,导致胰岛素抵抗,长期致使机体血糖升高[12]。本实验中,模型小鼠血清FFA、胰岛素显著升高,血糖升高但不显著,可能小鼠刚产生胰岛素抵抗,还未引起血糖的显著升高;经霍山石斛多糖干预小鼠血清FFA、胰岛素显著降低,血糖有所降低,表明霍山石斛多糖减轻了高脂膳食对小鼠胰腺引起的氧化应激损伤。
综上所述,霍山石斛多糖可降低肥胖模型小鼠体重、Lee’s、体脂比、FFA、INS、FBG、MDA,升高GSH-Px、SOD、T-AOC,表明霍山石斛多糖可改善高脂饮食诱导的肥胖小鼠氧化应激反应。
[1]陈存武,戴军,姚厚军,等.霍山石斛资源与鉴定研究进展[J].现代中药研究与实践,2013,27(3):84-87.
[2]淳泽.药用石斛的资源危机与保护对策[J].生物资源,2005,21(2):139-140.
[3]Datta K, Sinha S, Chattopadhyay P. Reactive Oxygen Species in Health and Disease [J]. Natl Med J India, 2000,13(6):304-310.
[4]Valk M, Leibfritz D, Moncol J, et al. Free Radicals and Antioxidangts in Normal Physiological Functions and Human Disease[J]. Int J Biochem Cell Biol, 2007,39(1):44-84.
[5]Ceriello A, Quagliaro L, Piconi L, et al. Effect of Postprandial Hypertrigly Ceridemia and Hyperglycemia on Circulating Adhesion Molecules and Oxidative Stress Generation and the Possible Role of Simvstatin Treatment[J]. Diabetes, 2004(5):701-710.
[6]Frisard M, Ravussin E. Energy Metabolism and Oxidative Stress:Impact on the Metabolic Syndrome and the Aging Process[J]. Am J Physiol Ndocrinol Metan, 2002,282(1):E132-138.
[7]郝杰,查学强,鲍素华,等.霍山石斛不同分子量多糖体外抗氧化研究[J].食品科学,2009,30(15):94-98.
[8]陈凤芹,黄德武,何苗,等.霍山石斛胶囊抗过氧化作用的研究[J].动物医学进展,2007,28(10):54-58.
[9]谷仿丽,陈乃富,戴军.霍山石斛组培苗多糖的提取工艺研究[J].宿州学院学报,2011,26(11):68-70.
[10]谷仿丽,陈乃富,韦传宝.山楂总黄酮联合茶多酚对高脂膳食大鼠血脂及氧化应激的影响[J].生物学杂志,2012,29(3):24-26.
[11]刘摇芳,高南南,杨润梅,等.不同品系小鼠肥胖模型比较及C57BL/6J小鼠肥胖机制研究[J].中国药理学报,2013,29(3):360-365.
[12]Schönfeld P, Wifckowski M R, Lebiedzińska M, et al. Mitochondrial Fatty Acid Oxidation and Oxidative Stress:Lack of Reverse Electron Transfer-associated Producton of Reactive Oxygen Species[J]. Biochim Biophys Acta, 2010,1797(6-7):929-938.
[13]袁涛,赵建宁,包倪荣.游离脂肪酸与组织细胞损伤相关性的研究进展[J].医学研究生学报,2014,27(9):994-997.
Effects of Oxidative Stress of Polysaccharides from Dendrobidium Huoshanness on Obese Mice
GU Fangli1,2, CHEN Naifu1,2, YU Maoyun1, XU Haijun1,2
(1.DepartmentofBiologicalandPharmaceuticalEngineering,WestAnhuiUniversity,Lu’an237012,China; 2.SynergeticInnovationCenterofDendmbiaIndustrializationDevelopmentinAnhuiProvince,Lu’an237012,China)
Objective: To study on oxidative stress of polysaccharides fromDendrobiumhuoshanenseon obese mice. Methods: The polysaccharides fromDendrobiumhuoshanensewas ingested to mice whose obese models were given high fat diet with 8 weeks. These thymus indexes, detection of mouse body weight, Lee’s, body fat ratio, serum of free fatty acid(FFA), insulin, fasting blood glucose (FBG), glutathione peroxidase (GSH-Px), superoxide dismutase (SOD), total antioxidant capacity (T-AOC) and malondialdehyde (MDA), were measured to observe the effect of polysaccharides fromDendrobiumhuoshanense. Results: The high dose of polysaccharides fromDendrobiumhuoshanensegroup significantly decreased mice model of body weight, Lee’s, body fat ratio, FFA and INS, and the content of MDA, and improve the GSH-Px, SOD and T-AOC levels (P<0.05v model group), FBG has a decreasing trend, but not significant. Conclusion: The polysaccharides fromDendrobiumhuoshanensecan reduce the effect of oxidative stress in obese mice.
Dendrobiumhuoshanense; polysaccharide; mice; oxidative stress
2016-06-16
安徽省高等学校省级自然科学基金项目(KL2012B214);安徽省高等学校省级自然科学基金重大项目(KL2015ZD43)。
谷仿丽(1980-),女,安徽萧县人,副教授,硕士,研究方向:天然产物研究与开发。
R284
A
1009-9735(2016)05-0004-04
