不同运动方式上调FSTL1蛋白表达诱导心梗心脏血管新生
2016-12-14蔡梦昕田振军
席 悦,蔡梦昕,田振军
不同运动方式上调FSTL1蛋白表达诱导心梗心脏血管新生
席 悦,蔡梦昕,田振军
目的:探讨不同运动方式对内源性卵泡抑素样蛋白1(FSTL1) 诱导心梗心脏血管新生的作用。方法:雄性SD大鼠随机分为假心梗组(S)、心梗安静组(MI)、心梗+间歇运动组(ME)、心梗+抗阻训练组(MR) 和心梗+机械振动组(MV),每组12只。左冠状动脉前降支结扎制备心梗模型。ME组、MR组和MV组分别采用小动物跑台、负重爬梯和小动物振动台3种方式进行为期4周的训练。训练结束后采用免疫荧光染色法定位FSTL1蛋白表达并进行新生血管观察与分析, RT-qPCR和WB法检测心肌FSTL1基因与蛋白表达,血流动力学法评定心功能,Masson染色观察分析心肌胶原面积百分比(CVF)。结果:心梗导致心肌FSTL1蛋白表达上调,且出现内皮细胞增殖和血管新生,心肌fstl1基因表达不受心梗病理条件或运动方式的影响。不同运动方式均可进一步提高心肌FSTL1蛋白表达,显著促进内皮细胞增殖和血管新生,抗阻训练效果最显著,间歇运动次之,而机械振动效果最弱。不同运动方式均可降低CVF,有效改善心功能。结论:不同运动方式可有效刺激心梗心脏内源性FSTL1表达增加,促进心肌血管新生,降低心梗心肌纤维化,改善心功能,其中,抗阻训练的效果较间歇运动和机械振动更显著。探索不同运动方式对心梗心脏保护效应的差异,将为心梗心脏的运动康复机制研究和运动处方筛选与制定提供实验依据。
心肌梗死;运动;卵泡抑素样蛋白1;血管再生
心肌梗死(Myocardial infarction,MI)是心力衰竭致死的重要原因。目前,关于心梗心脏病理机制及药物干预已有诸多文献报道[15,14]。除药物干预外,运动具有改善缺血心脏损伤和加速其恢复的作用[44,41,19],但不同运动方式存在差别[4,39],其生物医学机制也尚未完全阐明。文献证实,运动可降低心梗心肌细胞凋亡和改善氧化应激及代谢功能[20]。间歇运动可有效降低梗死心脏病理性重塑[18],增加最大摄氧量[24]并改善慢性心力衰竭(CHF)心功能和生活质量[27];抗阻训练可显著增加血管和心脏的自律调节[11],增加心梗患者最大摄氧量并降低左室舒张和收缩末压[22];机械振动则可加速血管的再灌注[21],诱导血管再生调节因子如VEGF、MMP-2/9的循环水平[38]。但不同运动方式对心梗心脏血管新生作用是否有差异,缺少文献报道。
有文献报道,心肌可分泌促血管再生的卵泡抑素样蛋白1(FSTL1)[29],并作为慢性收缩性心衰左室重塑的标志物[6],可降低压力超负荷导致的病理性心脏肥大[36],并发现具有促进细胞增殖与分化、血管新生、创伤修复和抑制炎症反应等多种生物学效应[9]。心肌组织缺血缺氧可诱导FSTL1表达,促进血管代偿性重建[30];但运动干预能否上调心梗心肌FSTL1的表达,且是否存在运动方式差异,缺少文献报道。本文采用间歇运动、抗阻训练和机械振动等方式干预,探讨心肌FSTL1表征、内皮细胞增殖、心肌微血管重构与心梗心脏形态及功能的影响,为心梗患者临床康复手段与方法筛选提供实验依据。
1 材料与方法
1.1 主要仪器和试剂
主要仪器:Powerlab 8/30生理信号采集系统,BM-II型病理组织包埋机,LEICA-RM2126切片机,YT-6C生物组织摊烤片机,核酸/蛋白定量仪,Bio-Rad电泳仪和电泳槽,凝胶成像系统,BX51奥林巴斯光学显微镜,Nikon荧光显微镜,Bio-Rad RT-qPCR仪等。
主要试剂:TRIzol和BCA蛋白定量试剂盒(西安晶彩),TAKARA-RNA定量反转录试剂盒(日本TAKARA),TAKARA-PCR试剂盒(日本TAKARA),PCR引物(上海生工),Tween 20、兔多克隆抗体FSTL1(美国GeneTex),vWF(美国Merck Millipore),小鼠单克隆抗体PCNA(美国Cell Signaling),CD31(美国GeneTex),GAPDH(美国Bioworld)等。
1.2 心梗模型制备与动物分组
Sprague-Dawley大鼠60只[SPF级,购于西安交通大学实验动物管理中心,动物合格证号:SCXK(陕)2012-003],体重180~220 g,分笼饲养。适应饲养1周后,大鼠用戊巴比妥钠(30 mg/kg体重)进行麻醉。利用先前已建立的冠状动脉左前降支结扎法[25]制备心梗大鼠模型:利用小动物呼吸机辅助呼吸(60次/min,潮气量16 ml,呼吸比2∶1),连接心电图。开胸,用6.0缝合线沿左心耳和肺动脉圆锥交界下缘2 mm处进针结扎,观察到心电图ST段抬高或T波倒置,且心肌颜色变浅或变白作为建模成功的标准,逐层缝合关胸。大鼠心梗术后随机分为心梗安静组(MI)、心梗+间歇运动组(ME)、心梗+抗阻训练组(MR)、心梗+机械振动组(MV),每组12只。假心梗对照组(S,12只)经历上述手术过程但不结扎。
1.3 运动方案

1.4 血流动力学检测
4周训练后,大鼠以上述方法进行麻醉。自右颈总动脉逆向插入压力传感器导管进入左心室腔,利用Powerlab 8/30(ML 870,澳大利亚)生理信号采集系统记录心室内各项血流动力学参数,如左室收缩压(LVSP,mmHg)、左室舒张末压(LVEDP,mmHg)、心率(HR,bpm)、正负最大左室压力变化一阶导数(±dP/dt max,mmHg/s)、左室压力衰减时间常数(Tau,ms)等,以评价心功能。所有大鼠均在血流动力学检测后处死并取样。
1.5 组织学Masson染色
心脏样本用预冷的4%多聚甲醛固定24~48 h。浓度梯度乙醇脱水,石蜡包埋后切片(5 μm)以用来进行组织病理学检查。为了评价心肌纤维化程度,心脏组织切片进行Masson染色,光学显微镜观察、拍摄,并利用Image-Pro Plus软件进行分析并计算心肌胶原面积百分比(CVF%)。
1.6 免疫组织化学染色
FSTL1与CD31双标:切片脱蜡至水,抗原修复后用兔多克隆抗体FSTL1(1∶100)及小鼠单克隆抗体CD31(1∶25)或兔多克隆抗体vWF(1∶50)及小鼠单克隆抗体PCNA(1∶50)共同孵育,4℃过夜。TRITC结合的山羊抗兔IgG(1∶100)及FITC结合的山羊抗小鼠IgG(1∶100)或TRITC结合的山羊抗小鼠IgG(1∶100)及FITC结合的山羊抗兔IgG(1∶100)共同作为二抗进行标记。细胞核利用DAPI染色(1∶800)。光学显微镜观察、拍摄,利用Image-Pro Plus软件进行图像分析。
1.7 Western blot
取左室梗死边缘区(5 mm)组织进行匀浆。总蛋白提取及SDS-PAGE 方法依照先前研究进行[3]。FSTL1稀释浓度为1∶1 000,GAPDH稀释浓度为1∶10 000。利用辣根过氧化物酶标记的二抗(1∶5 000,美国Jackson ImmunoResearch)进行孵育后,蛋白条带利用增强化学发光底物(ECL)进行发光。利用Image Processing and Analysis in Java 1.48软件进行定量分析。
1.8 RT-qPCR
TRIzol提取左室梗死边缘区总RNA。取3 μg总RNA经TAKARA反转录试剂盒进行cDNA合成。利用TAKARA PCR试剂盒及其说明书进行CFX96TMReal-Time PCR系统检测。每个样本设立3组独立重复。引物序列:fstl1-F:5′-GCCTCTCTCTCCTCCTCTCTCT-3′;fstl1-R:5′-GCATAGGGTTTGTTGGTTT GTT-3′;gapdh-F:5′-CAGTGCCAGCCTCGTCTCAT-3′;gapdh-R:5′-AGGGGCCATCCACAGTCTTC-3′。用比较Ct法(2-△△Ct)进行基因表达定量,数据利用大鼠GAPDH 的mRNA水平进行标准化。1.9 数据处理
免疫荧光和Masson染色经显微镜观察并采集图片,免疫荧光染色的平均光密度值和Masson染色的CVF%数据用Image-Pro Plus 6.0软件进行计算。利用Image Processing and Analysis in Java 1.48软件采集Western blot数据,RT-qPCR结果采用Bio-Rad CFX manager软件分析。所有数据均以平均值±标准误表示,直方图和散点图利用GraphPad Prism 6.01软件作图。采用one-way ANOVA方差分析,SPSS 19.0进行显著性检验,显著性水平选择P<0.05和P<0.01。
2 实验结果
2.1 不同运动方式对心梗心脏FSTL1表征的影响
免疫荧光染色结果显示,FSTL1呈红色,细胞核DAPI呈蓝色,FSTL1表达位于心肌细胞质。阳性表达的平均光密度值统计结果显示,MI组与S组比较,FSTL1+表达显著增加(P<0.01);ME组和MR组与MI组比较,FSTL1+表达均显著增加(P<0.01),MR组更显著。MV组较ME组和MR组显著减少(P<0.01)。
RT-qPCR结果显示,各组fstl1 mRNA表达均呈降低趋势,组间无显著性差异。Western blot结果与免疫荧光染色统计结果相一致。表明,心梗心脏FSTL1表达出现代偿性显著升高,不同方式运动均可进一步上调FSTL1蛋白表达,不同运动方式间存在显著性差异,其效果为抗阻训练>间歇运动>机械振动(图1,图2)。
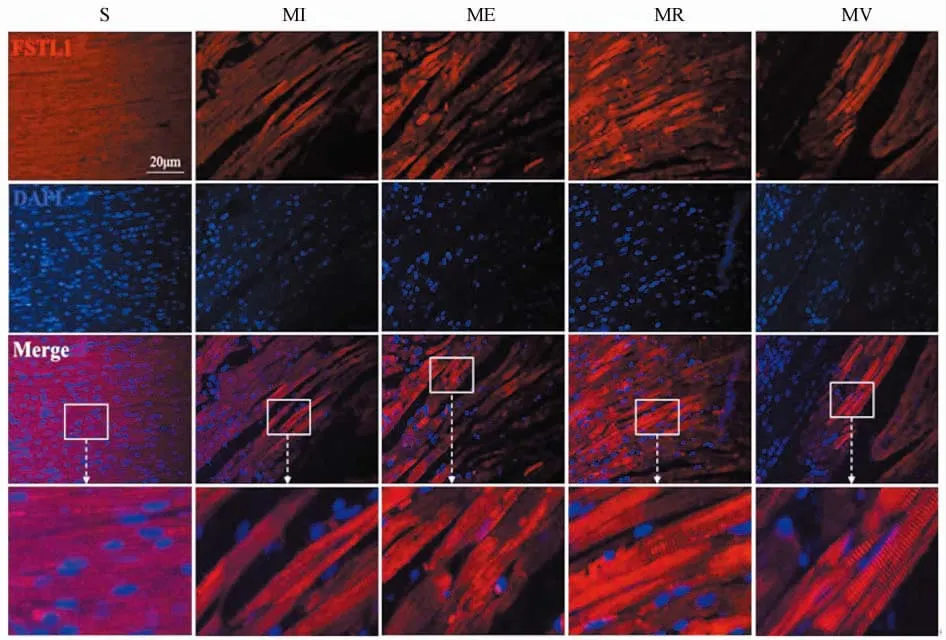
图1 心肌FSTL1表征的免疫荧光观察结果(×200)
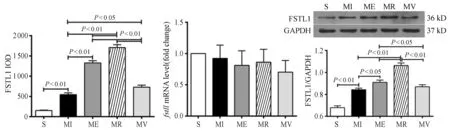
图2 心肌FSTL1的IOD值统计与FSTL1基因及蛋白定量结果
2.2 不同运动方式对心梗心肌血管新生的影响
vWF和CD31为内皮细胞标记物,PCNA为细胞增殖核抗原,双色荧光标记可反映血管新生。免疫荧光染色结果显示,vWF和CD31呈绿色,FSTL1和PCNA呈红色。MI组与S组比较,vWF+/PCNA+细胞数量和CD31+/FSTL1+血管平均数量显著增加(P<0.05)。ME组、MR组和MV组与MI组比较,vWF+/PCNA+细胞数量均显著增加(P<0.01:ME vs.MI、MR vs.MI;P<0.05:MV vs.MI)。表明,心梗心肌新生血管出现代偿性显著增加,不同方式运动均可进一步显著增加新生血管数量,不同运动方式间存在显著性差异,其效果为抗阻训练>间歇运动>机械振动(图3,图4)。


图3 心肌血管新生的免疫荧光观察结果(×200)
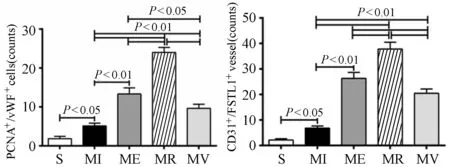
图4 心肌vWF+/PCNA+细胞数量和CD31+/FSTL1+血管平均数量统计结果
2.3 心肌组织学和心功能观察与检测结果
Masson染色观察显示,光镜下心肌间质胶原呈蓝色,心肌细胞呈粉红色,细胞核呈蓝褐色。心梗区心肌组织发生替代性纤维化,瘢痕区胶原纤维过度增生,并呈放射状分布,梗死边缘区和非梗死区胶原纤维向周围间质延伸(图5)。显微图像分析结果显示(图6),MI组与S组比较,心肌胶原面积百分比(CVF%)显著增加(P<0.01)。不同运动方式间存在显著差异,其效果为MI组>MV组>ME组>MR组。
血流动力学结果显示(图7),MI组与S组比较,LVSP和±dP/dt max均显著降低(P<0.01),LVEDP显著性升高(P<0.01);ME组、MR组和MV组与MI组比较,LVSP和±dP/dt max均显著升高(P<0.01:ME vs.MI、MR vs.MI;P<0.05:MV vs.MI),LVEDP显著性降低(P<0.01)。表明,心梗心脏发生心肌替代性纤维化,心功能显著降低,运动干预显著降低心肌纤维化,显著改善心功能,不同运动方式间存在差异。

图5 心肌Masson染色观察结果(×40)

图6 心肌胶原面积百分比(CVF%)统计结果
2.4 心肌组织FSTL1表征、血管新生与心肌胶原面积百分比(CVF%)及心功能的相关分析
相关性分析结果显示,FSTL1蛋白表达与vWF+/PC-NA+细胞数量之间存在显著正相关(r=0.945,P<0.01)。表明,内皮细胞增殖数量随心肌FSTL1蛋白表达量增加而增加。FSTL1蛋白表达与CVF%、vWF+/PCNA+细胞数量与CVF%之间均存在显著负相关(r=-0.763,P<0.01;r=-0.825,P<0.01)。表明,心肌纤维化程度随心肌FSTL1蛋白表达量及vWF+/PCNA+细胞数量的增加而降低(图8)。血管新生与血流动力学参数的相关分析显示,vWF+/PCNA+细胞数量与LVSP、+dP/dt max和-dP/dt max均存在显著正相关(r=0.747、0.851、0.887,P<0.01),而与LVEDP存在显著负相关(r=-0.769,P<0.01)。表明,随着心肌新生血管的增加,心功能显著改善(表1)。

图7 心脏血流动力学参数统计结果

图8 心肌组织FSTL1表征与血管新生及心肌胶原面积百分比(CVF%)的相关分析

表1 血管新生与血流动力学参数的相关分析
3 讨论与分析
3.1 不同运动方式刺激内源性FSTL1表征分析
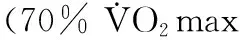
3.2 不同运动方式刺激血管新生的比较分析
研究表明,游泳运动可降低心肌纤维化,并通过激活VEGF通路,增加血管新生[8]。心力衰竭患者跟踪研究显示,3个月的有氧运动训练使内皮祖细胞(EPCs)数量和血清血管生成素-2(AP-2)蛋白水平显著升高[7]。不同强度和时间的有氧运动,如20~60 min、2周~6个月、75%~85%最大心率及60%~70%最大摄氧量等条件下,循环EPCs数量均显著增加,有助于血管再生和血管新生[32]。力量训练8周可使AP-1增加48%,VEGF和FST家族蛋白表达显著上调[16];不同强度和时间的抗阻训练可使CYR61、ANGPTL2和ANGPT2等血管新生相关基因的mRNA表达发生变化[26]。此外,生理性缺氧训练4周可改善VEC的迁移能力,增加循环EPCs,心肌毛细血管密度也显著升高[40]。给予糖尿病小鼠1周低强度震动可增加血管新生及肉芽组织形成,加速伤口愈合和创面上皮形成[42],全身性机械振动训练可显著升高循环MMP-2/9、VEGF和内皮抑素水平,刺激血管新生[1]。表明,不同运动方式均可诱导机体血管新生,但缺乏针对同一病理条件下不同运动方式作用效果的比较。本文结果表明,心梗后进行不同方式运动均可显著增加心脏内皮细胞的增殖,且抗阻训练效果最显著,为缺血心脏病的运动康复手段和方法筛选提供了实验依据。
3.3 运动上调FSTL1蛋白表达促进血管新生,改善心梗心脏功能的可能机制分析
规律运动可降低心梗急性期死亡率,其原因在于血管内皮细胞功能、心肌收缩力和心壁压力的改善[12]。研究指出,FSTL1在心血管功能改善中发挥重要作用[34]。四周压力超负荷的心肌细胞特异性fstl1敲除小鼠表现出心肌肥厚和心室功能的降低[36]。fstl1基因过表达可阻止心脏代偿性肥大和心力衰竭,并证实心肌fstl1基因表达与AMPK信号存在调控关系[36]。FSTL1不仅对心肌细胞营养发挥作用,还具有在动脉损伤后促血管新生和减少血管内膜形成的作用[23]。Görgens等[10]发现,C2C12骨骼肌细胞可分泌FSTL1到培养基并直接作用于内皮细胞信号通路,促进其功能和存活。内皮细胞过表达FSTL1可提高内皮细胞的分化和迁移,并减少细胞凋亡[30]。运动训练可通过增强循环促血管生成细胞的功能及增加循环EPCs数量,改善心力衰竭患者的血管内皮功能[35]。在运动刺激下,具有增殖和分化能力的EPCs会被动员释放入外周血,参与修复损伤的血管内皮,促进缺血组织血管再生,维护血管内皮的完整性及功能[32]。表明,FSTL1可调控运动对心血管的保护作用,并改善血管损伤造成的不良影响。本文实验发现,运动干预后心梗心脏FSTL1能够与CD31+细胞共定位,并形成血管样组织。相关性分析证实,内皮细胞增殖数量、心肌纤维化程度与心脏FSTL1表达呈高度相关。提示,FSTL1可促进内皮细胞增殖和心肌血管新生,改善心梗心脏纤维化和心功能。除了心源性FSTL1可诱导心肌血管新生外,推测心肌FSTL1或许部分来源于远隔器官入血循环至靶器官,但缺乏实验证据。FSTL1改善内皮细胞功能已有报道,但循环水平FSTL1是否参与EPCs的迁移、分化及归巢还需进一步验证。
4 结论
不同运动方式可有效刺激心梗心脏内源性FSTL1表达增加,促进心肌血管新生,降低心梗心肌纤维化,改善心功能,其中,抗阻训练的效果较间歇运动和机械振动更显著。探索不同运动方式对心梗心脏保护效应的差异,将为心梗心脏的运动康复机制研究和运动处方筛选与制定提供实验依据。
[1]BEIJER A,ROSENBERGER A,BOLCK B,etal.Whole-body vibrations do not elevate the angiogenic stimulus when applied during resistance exercise[J].PLoS One,2013,8(11):e80143.
[2]CHAN X C,MCDERMOTT J C,SIU K W.Identification of secreted proteins during skeletal muscle development[J].J Proteome Res,2007,6(2):698-710.
[3]CHEN T,CAI M X,LI Y Y,etal.Aerobic exercise inhibits sympathetic nerve sprouting and restores beta-adrenergic receptor balance in rats with myocardial infarction[J].PLoS One,2014,9(5):e97810.
[4]CONVISER J M,NG A V,ROCKEY S S,etal.Cardio-protection afforded by beta-blockade is maintained during resistance exercise[J].J Sci Med Sport,2016.[DOI 10.1016/j.jsams.2016.01.003].
[5]DE SOUZA R W,AGUIAR A F,CARANI FR,etal.High-intensity resistance training with insufficient recovery time between bouts induce atrophy and alterations in myosin heavy chain content in rat skeletal muscle[J].Anat Rec(Hoboken),2011,294(8):1393-1400.
[6]EL-ARMOUCHE A,OUCHI N,TANAKA K,etal.Follistatin-like 1 in chronic systolic heart failure:a marker of left ventricular remodeling[J].Circ Heart Fail,2011,4(5):621-627.
[7]ELEUTERI E,MEZZANI A,DI STEFANO A,etal.Aerobic training and angiogenesis activation in patients with stable chronic heart failure:a preliminary report[J].Biomarkers,2013,18(5):418-424.
[8]FERNANDES T,BARAUNA V G,NEGRAO C E,etal.Aerobic exercise training promotes physiological cardiac remodeling involving a set of microRNAs[J].Am J Physiol Heart Circ Physiol,2015,309(4):H543-552.
[9]GENOVESE J A,SPADACCIO C,RIVELLO H G,etal.Electrostimulated bone marrow human mesenchymal stem cells produce follistatin[J].Cytotherapy,2009,11(4):448-456.
[10]GÖRGENS S W,RASCHKE S,HOLVEN K B,etal.Regulation of follistatin-like protein 1 expression and secretion in primary human skeletal muscle cells[J].Arch Physiol Biochem,2013,119(2):75-80.
[11]GRANS C F,FERIANI D J,ABSSAMRA M E,etal.Resistance training after myocardial infarction in rats:its role on cardiac and autonomic function[J].Arq Bras Cardiol,2014,103(1):60-68.
[12]HAYKOWSKY M,SCOTT J,ESCH B,etal.A meta-analysis of the effects of exercise training on left ventricular remodeling following myocardial infarction:start early and go longer for greatest exercise benefits on remodeling[J].Trials,2011.[DOI 10.1186/1745-6215-12-92].
[13]HENNINGSEN J,RIGBOLT K T,BLAGOEV B,etal.Dynamics of the skeletal muscle secretome during myoblast differentiation[J].Mol Cell Proteomics,2010,9(11):2482-2496.
[14]HOSSEINI S H,GHAEMIAN A,MEHDIZADEH E,etal.Levels of anxiety and depression as predictors of mortality following myocardial infarction:A 5-year follow-up[J].Cardiol J,2014,21(4):370-377.
[15]ICKS A,CLAESSEN H,KIRCHBERGER I,etal.Mortality after first myocardial infarction in diabetic and non-diabetic people between 1985 and 2009.The MONICA/KORA registry[J].Eur J Epidemiol,2014,29(12):899-909.
[16]JANG K S,KANG S,WOO S H,etal.Effects of combined open kinetic chain and closed kinetic chain training using pulley exercise machines on muscle strength and angiogenesis factors[J].J Phys Ther Sci,2016,28(3):960-966.
[17]KRAEMER W J,FLANAGAN S D,VOLEK J S,etal.Resistance exercise induces region-specific adaptations in anterior pituitary gland structure and function in rats[J].J Appl Physiol(1985),2013,115(11):1641-1647.
[18]KRALJEVIC J,MARINOVIC J,PRAVDIC D,etal.Aerobic interval training attenuates remodelling and mitochondrial dysfunction in the post-infarction failing rat heart[J].Cardiovasc Res,2013,99(1):55-64.
[19]LI Y,CAI M,CAO L,etal.Endurance exercise accelerates myocardial tissue oxygenation recovery and reduces ischemia reperfusion injury in mice[J].PLoS One,2014,9(12):e114205.
[20]LU K,WANG L,WANG C,etal.Effects of high-intensity interval versus continuous moderate-intensity aerobic exercise on apoptosis,oxidative stress and metabolism of the infarcted myocardium in a rat model[J].Mol Med Rep,2015,12(2):2374-2382.
[21]MARZENCKI M,KAJBAFZADEH B,KHOSROW-KHAVAR F,etal.Low frequency mechanical actuation accelerates reperfusion in-vitro[J].Biomed Eng Online,2013.[DOI 10.1186/1475-925X-12-121].
[22]MCGREGOR G,GAZE D,OXBOROUGH D,etal.Reverse left ventricular remodeling:effect of cardiac rehabilitation exercise training in myocardial infarction patients with preserved ejection fraction[J].Eur J Phys Rehabil Med,2016,52(3):370-378.
[23]MIYABE M,OHASHI K,SHIBATA R,etal.Muscle-derived follistatin-like 1 functions to reduce neointimal formation after vascular injury[J].Cardiovasc Res,2014,103(1):111-120.
[24]MOHOLDT T,AAMOT IL,GRANOIEN I,etal.Aerobic interval training increases peak oxygen uptake more than usual care exercise training in myocardial infarction patients:a randomized controlled study[J].Clin Rehabil,2012,26(1):33-44.
[25]MUTHURAMU I,LOX M,JACOBS F,etal.Permanent ligation of the left anterior descending coronary artery in mice:a model of post-myocardial infarction remodelling and heart failure[J].J Vis Exp,2014.[DOI 10.3791/52206].
[26]NADER G A,VON WALDEN F,LIU C,etal.Resistance exercise training modulates acute gene expression during human skeletal muscle hypertrophy[J].J Appl Physiol(1985),2014,116(6):693-702.
[27]NILSSON B B,WESTHEIM A,RISBERG M A.Effects of group-based high-intensity aerobic interval training in patients with chronic heart failure[J].Am J Cardiol,2008,102(10):1361-1365.
[28]NORHEIM F,RAASTAD T,THIEDE B,etal.Proteomic identification of secreted proteins from human skeletal muscle cells and expression in response to strength training[J].Am J Physiol Endocrinol Metab,2011,301(5):E1013-1021.
[29]OSHIMA Y,OUCHI N,SATO K,etal.Follistatin-like 1 is an Akt-regulated cardioprotective factor that is secreted by the heart[J].Circulation,2008,117(24):3099-3108.
[30]OUCHI N,OSHIMA Y,OHASHI K,etal.Follistatin-like 1,a secreted muscle protein,promotes endothelial cell function and revascularization in ischemic tissue through a nitric-oxide synthase-dependent mechanism[J].J Biol Chem,2008,283(47):32802-32811.
[31]OXLUND B S,ORTOFT G,ANDREASSEN T T,etal.Low-intensity,high-frequency vibration appears to prevent the decrease in strength of the femur and tibia associated with ovariectomy of adult rats[J].Bone,2003,32(1):69-77.
[32]RIBEIRO F,RIBEIRO I P,ALVES A J,etal.Effects of exercise training on endothelial progenitor cells in cardiovascular disease:a systematic review[J].Am J Phys Med Rehabil,2013,92(11):1020-1030.
[33]RODRIGUES M F,STOTZER U S,DOMINGOS M M,etal.Effects of ovariectomy and resistance training on oxidative stress markers in the rat liver[J].Clinics(Sao Paulo),2013,68(9):1247-1254.
[34]SANCHIS-GOMAR F,PEREZ-QUILIS C,LUCIA A.Overexpressing FSTL1 for Heart Repair[J].Trends Mol Med,2016,22(5):353-354.
[35]SCHIER R,EL-ZEIN R,CORTES A,etal.Endothelial progenitor cell mobilization by preoperative exercise:a bone marrow response associated with postoperative outcome[J].Br J Anaesth,2014,113(4):652-660.
[36]SHIMANO M,OUCHI N,NAKAMURA K,etal.Cardiac myocyte follistatin-like 1 functions to attenuate hypertrophy following pressure overload[J].PNAS,2011,108(43):E899-906.
[38]SUHR F,BRIXIUS K,DE MAREES M,etal.Effects of short-term vibration and hypoxia during high-intensity cycling exercise on circulating levels of angiogenic regulators in humans[J].J Appl Physiol(1985),2007,103(2):474-483.
[39]TSCHAKERT G,KROEPFL J M,MUELLER A,etal.Acute Physiological Responses to Short- and Long- Stage High-Intensity Interval Exercise in Cardiac Rehabilitation:A Pilot Study[J].J Sports Sci Med,2016,15(1):80-91.
[40]WAN C,LI J,YI L.Enhancement of homing capability of endothelial progenitor cells to ischaemic myocardium through physiological ischaemia training[J].J Rehabil Med,2011,43(6):550-555.
[41]WANG Y,LI M,DONG F,etal.Physical exercise-induced protection on ischemic cardiovascular and cerebrovascular diseases[J].Int J Clin Exp Med,2015,8(11):19859-19866.
[42]WEINHEIMER-HAUS E M,JUDEX S,ENNIS W J,etal.Low-intensity vibration improves angiogenesis and wound healing in diabetic mice[J].PLoS One,2014,9(3):e91355.
[43]WISLØFF U,LOENNECHEN JP,CURRIE S,etal.Aerobic exercise reduces cardiomyocyte hypertrophy and increases contractility,Ca2+sensitivity and SERCA-2 in rat after myocardial infarction[J].Cardiovasc Res,2002,54(1):162-174.
[44]WU G,RANA J S,WYKRZYKOWSKA J,etal.Exercise-induced expression of VEGF and salvation of myocardium in the early stage of myocardial infarction[J].Am J Physiol Heart Circ Physiol,2009,296(2):H389-395.
[45]YOON J H,YEA K,KIM J,etal.Comparative proteomic analysis of the insulin-induced L6 myotube secretome[J].Proteomics,2009,9(1):51-60.
Different Exercise Modes Up-regulate FSTL1 and Induce Angiogenesis in the Heart with Myocardial Infarction
XI Yue,CAI Meng-xin,TIAN Zhen-jun
Objectives:The aim of this study is to investigate the effects of different exercise modes on endogenous follistatin like-1(FSTL1) induced angiogenesis in the heart with myocardial infarction(MI).Methods:3-month old adult male sprague-dawley rats were randomly divided into 5 groups(n=12):Sham-operated group(S),sedentary MI group(MI),MI with interval exercise group(ME),MI with resistance training group(MR) and MI with mechanical vibration group(MV).The MI model was established by ligation of the left anterior descending(LAD) coronary artery.Rats in ME,MR and MV group were underwent 4 weeks’ training using small animal treadmill,weighted climbing up ladder and small animal vibrating platform,respectively.FSTL1 protein location and neovascularization were observed and analyzed by immunofluorescence staining;FSTL1 gene and protein expression were measured by RT-qPCR and Western blot;Heart function was evaluated by hemodynamics;Collagen volume fraction(CVF) of myocardium was observed and analyzed by Masson’s trichrome staining.Results:MI resulted in the up-regulation of myocardium FSTL1,endothelial cell(EC) proliferation and angiogenesis.Myocardial fstl1 gene expression was not affected by MI pathological conditions or exercise modes.Different exercise modes could further increase myocardial FSTL1 protein expression,significantly improve EC proliferation and angiogenesis.The effect of resistance training was more significant than interval exercise,and the mechanical vibration was the weakest.The CVF was reduced and the heart function was effectively improved by different exercise modes after MI.Conclusion:Different exercise modes effectively stimulate endogenous FSTL1 expression and myocardial angiogenesis,decrease myocardial fibrosis and improve heart function after MI.The effect of resistance training is better than interval exercise and mechanical vibration.Comparing the effects of different exercise modes on MI heart protection will provide the experimental basis for exercise rehabilitative mechanism research and the filtration and formulation of exercise prescription of MI patient.
myocardialinfarction;exercise;follistatinlike-1;angiogenesis
1000-677X(2016)10-0032-08
10.16469/j.css.201610005
2016-07-11;
2016-08-02
国家自然科学基金资助项目(31371199)。
席悦(1988-),男,陕西西安人,在读博士研究生,主要研究方向为运动心血管生物学,E-mail:tianzj2013@hotmail.com;蔡梦昕(1987-),女,河南商丘人,在读博士研究生,主要研究方向为运动心血管生物学;田振军(1965-),男,陕西绥德人,教授,博士研究生导师,主要研究方向为运动心血管生物学,E-mail:tianzj611@hotmail.com。
陕西师范大学 体育学院暨运动生物学研究所,陕西 西安 710119 Shaanxi Normal University,Xi’an 710119,China.
G804.7
A
