培养条件对酿酒酵母细胞甘露聚糖含量的影响
2016-12-13岳晓安季小莉赵国群
岳晓安,季小莉,赵国群,2,*
(1.河北科技大学生物科学与工程学院,河北石家庄050018;2.河北省发酵工程技术研究中心,河北石家庄050018)
培养条件对酿酒酵母细胞甘露聚糖含量的影响
岳晓安1,季小莉1,赵国群1,2,*
(1.河北科技大学生物科学与工程学院,河北石家庄050018;2.河北省发酵工程技术研究中心,河北石家庄050018)
研究培养条件对酿酒酵母细胞甘露聚糖含量的影响。研究发现,不同酿酒酵母菌株的细胞甘露聚糖含量差别很大。在所筛选的10株酿酒酵母中,菌株KD10甘露聚糖含量最高,达到93.44mg/g。葡萄糖与乳糖作复合碳源、酵母粉与蛋白胨复合作氮源时均可提高细胞甘露聚糖含量。培养基碳氮比较低时细胞甘露聚糖含量较高。叶酸可明显促进细胞甘露聚糖的合成,使得KD10甘露聚糖含量提高了11.16%。在最适培养温度(34℃)下,细胞合成甘露聚糖的能力最大,产生的甘露聚糖最多。培养基中添加8%氯化钠会造成菌体生长下降,但却利于甘露聚糖的合成,使得细胞甘露聚糖含量提高了8.21%。
甘露聚糖;酿酒酵母;筛选;培养
甘露聚糖是酵母细胞壁的主要成分之一,占酵母细胞壁干重的40%左右[1]。甘露聚糖相对分子质量为20 000Da~200 000Da,其主链由甘露糖以α-1,6糖苷键形成的糖链组成,主链上连有丰富的支链,由甘露糖、甘露二糖、甘露三糖和甘露四糖组成,糖苷键形式为α-1,2或α-1,3连接[2]。酵母甘露聚糖是免疫功能最强的酵母细胞壁多糖,能增加细胞免疫能力,调节肠道菌群平衡,结合吸附外源性病原菌,并且具有抗肿瘤、抗氧化、抗病毒、降血脂等作用,是一种极具潜力的功能性食品配料[3-6]。酵母甘露聚糖在国际市场的售价达为70美元/克,食品级酵母甘露聚糖国内尚没有大规模生产。
鉴于显著的生理活性和广泛的应用前景,酵母甘露聚糖成为一个研究热点。酵母细胞壁中甘露聚糖含量的高低是甘露聚糖生产的核心问题之一。然而,从
提高细胞壁中甘露聚糖含量的角度,研究酵母的发酵培养条件却鲜有报道[7-8]。酵母细胞壁的合成是一个及其复杂的过程,它涉及1 200多种基因[9]。培养基成分能影响酵母细胞的生物活性以及细胞壁的合成,从而影响其结构[10-11]。其它培养条件如温度、pH值等也对酵母细胞壁的结构有显著影响[12]。本文从酿酒酵母的种类、培养基成分、发酵温度等方面,研究了培养条件对细胞甘露聚糖含量的影响,以期提高酵母甘露聚糖的产量。
1 材料与方法
1.1 材料与仪器
安琪酿酒酵母:湖北安琪酵母股份有限公司;酿酒酵母1416:中国工业微生物菌种保藏中心;酿酒酵母M14S、M2S、M12S、KD7、KD8、KD10、KD7、KD11、KD14:河北省发酵工程技术研究中心;甘露糖(色谱纯):Sigma公司;酵母粉、蛋白胨:上海国药集团,BR级;叶酸、肌醇、维生素H、天冬氨酸:北京索莱宝科技有限公司,AR级。
LG16-B型高速离心机:北京雷勃尔设备有限公司;安捷伦LC1100液相色谱仪:安捷伦科技有限公司;液相色谱柱Sugar-Pak I:沃特世公司;ZHWY-2102C恒温培养振荡器:上海智城分析仪器制造有限公司;752型紫外可见分光光度计:上海光谱仪器有限公司。
1.2 方法
1.2.1 种子培养基
葡萄糖10 g/L、蛋白胨5 g/L、酵母粉5 g/L、MgSO40.5 g/L、KH2PO40.3 g/L、K2HPO40.3 g/L,自然pH。
1.2.2 发酵基本培养基
葡萄糖50g/L、酵母粉10 g/L、MgSO40.5 g/L、KH2PO40.3 g/L、K2HPO40.3 g/L,自然pH。
1.2.3 种子液的制备
将2~3环酿酒酵母斜面培养物接种至装有100mL种子培养基的250mL三角瓶中,30℃、200 r/min摇床振荡培养12 h。
1.2.4 高产甘露聚糖菌株的筛选
分别将制备好的安琪酿酒酵母、酿酒酵母1416、酿酒酵母 M14S、M2S、M12S、KD7、KD8、KD10、KD7、KD11、KD14种子液,以5%(体积比)的接种量,接种到装有100mL发酵基本培养基的250mL三角瓶中,于30℃、200 r/min的摇床中培养至菌体生长稳定期(定时取样,测定发酵液OD值,直至到发酵液OD值不再升高)。
1.2.5 碳源对酵母生长及甘露聚糖含量的影响
将发酵基本培养基的碳源分别调整为:葡萄糖50 g/L、蔗糖50 g/L、葡萄糖30 g/L+蔗糖20 g/L、葡萄糖30 g/L+麦芽糖20 g/L、葡萄糖30 g/L+乳糖20 g/L、葡萄糖30 g/L+可溶性淀粉20 g/L。按5%接种量接入菌株KD10种子液,30℃、200 r/min摇床培养至菌体生长稳定期。
1.2.6 氮源对酵母生长及甘露聚糖含量的影响
将发酵基本培养基的氮源分别调整为:酵母粉10 g/L;酵母粉5 g/L+蛋白胨5 g/L、酵母粉5 g/L+氯化铵5 g/L、酵母粉5 g/L+尿素5 g/L、酵母粉5g/L+硫酸铵5 g/L。按5%接种量接入菌株KD10种子液,30℃、200 r/min摇床培养至菌体生长稳定期。
1.2.7 碳氮比酵母生长及甘露聚糖含量的影响
在固定葡萄糖用量的情况下,分别将发酵培养基中的碳氮比调整为1∶1、5∶1、10∶1、20∶1、50∶1(质量比)。接入菌株KD10种子液,30℃、200 r/min摇床培养至菌体生长稳定期。
1.2.8 生长因子对酵母生长及甘露聚糖含量的影响
向发酵基本培养基分别添加下列生长因子(0.2 g/L):维生素H、天冬氨酸、叶酸、肌醇、L-赖氨酸、DL-丙氨酸、L-组氨酸、甘氨酸。没有添加生长因子的发酵基本培养基设为对照。接入菌株KD10种子液,30℃、200 r/min摇床培养至菌体生长稳定期。
1.2.9 培养温度对酵母生长及甘露聚糖含量的影响
按5%接种量,将菌株KD10种子液接种到装有100mL发酵基本培养基的250mL三角瓶中。将三角瓶放入200 r/min摇床进行培养。培养温度分别控制为20、25、30、34、37℃。当菌体生长至稳定期时,停止发酵。
1.2.10 环境胁迫对酵母生长及甘露聚糖含量的影响
按5%接种量,将菌株KD10种子液接入100mL发酵基本培养基中,30℃、200 r/min摇床培养12 h。然后,分别向发酵基本培养基中添加8%氯化钠、10%乙醇,继续培养至菌体生长稳定期。
1.2.11 酵母细胞生物量的测定
取1.0mL发酵液,8 000 r/min离心10min,所获得的沉淀在80℃烘箱中烘干至恒重,称量得菌体干重。每个样品重复3次,取其平均值。
1.2.12 酵母细胞甘露聚糖含量的测定
称取干酵母0.02g于试管中,加10mL的3.5mol/L浓硫酸溶液,混匀,至酵母完全溶解;吸取1mL溶解液至试管中,加入去离子水调节稀释管内硫酸浓度至3mol/L,于水浴锅中100℃水浴水解10 h,甘露聚糖被降解为甘露糖。冷却后用粉末BaCO3调节pH值至中
性,离心取上清液,再用去离子水定容至10mL,0.22μm膜过滤,得到滤液。以甘露糖为标准品,采用HPLC法测定滤液中甘露聚糖的浓度。色谱条件为:WatersSugar-PakTM I色谱柱(6.5mm×300mm);示差折光检测器(RID);流动相:超纯水;流速:0.5mL/min;柱温:80℃;进样量:20μL/次。每个样品重复3次,取其平均值。
1.2.13 甘露聚糖产量的计算
甘露聚糖产量/(mg/L)=细胞甘露聚糖含量/(mg/ g)×菌体干重/(g/L)。
2 结果与讨论
2.1 高产甘露聚糖菌株的筛选
10株酿酒酵母的生长情况及细胞甘露聚糖含量如表1所示。
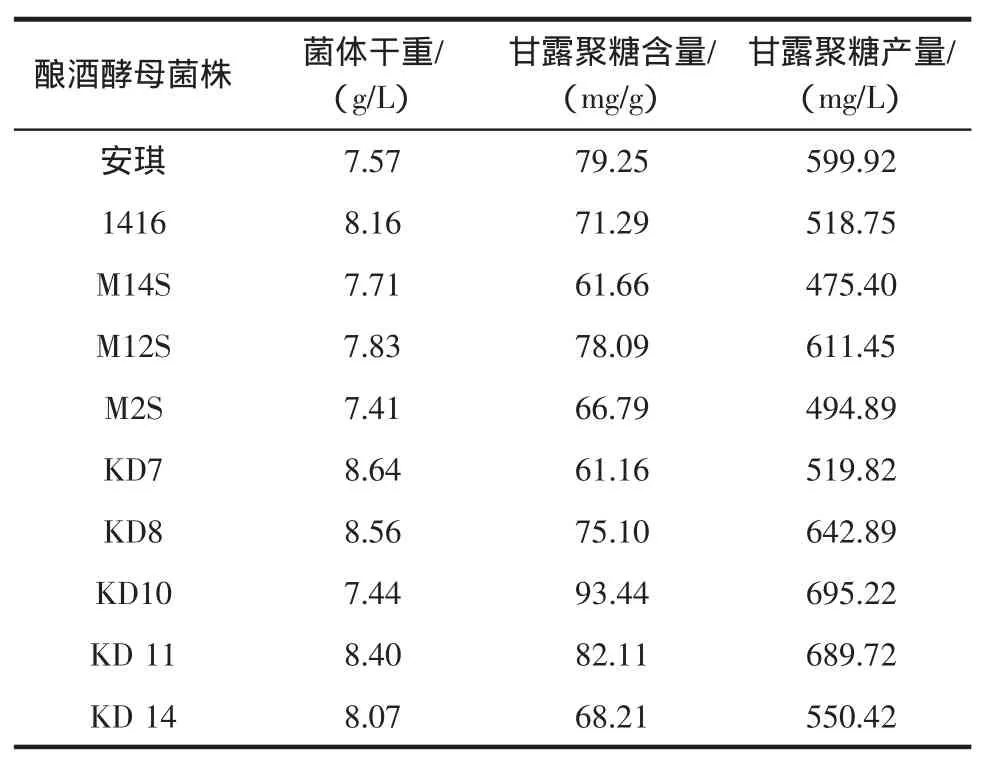
表1 高产甘露聚糖菌株的筛选结果Tab le1 The screening resultof yeast strainsw ith higher mannan yield
从表1中可以看出,不同的酿酒酵母菌株,其甘露聚糖含量差别很大。菌株KD7的甘露聚糖含量最低(61.16mg/g),菌株KD10甘露聚糖含量最高(93.44mg/g),二者相差达32.28mg/g。酿酒工业常用的安琪酿酒酵母其甘露聚糖含量居中。从表1中还可发现,菌株KD7的菌体干重最大,而菌株KD10的菌体干重最低,这表明菌株KD7的生长要好于菌株KD10,但不能因此推断出甘露聚糖的生物合成与细胞生长呈负相关。例如,菌株M2S-3的菌体干重与菌株KD10很接近,但其甘露聚糖含量却很低,66.79%。甘露聚糖含量与菌体干重之间没有一定的规律可言,因此,胞壁上甘露聚糖的生物合成与菌体的生长是否存在关联性尚难以确定。由于菌株KD10的甘露聚糖含量及甘露聚糖产量均为最高,因此,选择菌株KD10进行下一步研究。
2.2 碳源对酵母生长及甘露聚糖含量的影响
碳源是微生物培养的重要营养物质,是细胞和各种代谢产物的主要元素,同时又是微生物生长的能量来源。碳源种类对酵母生长及甘露聚糖含量的影响见表2。
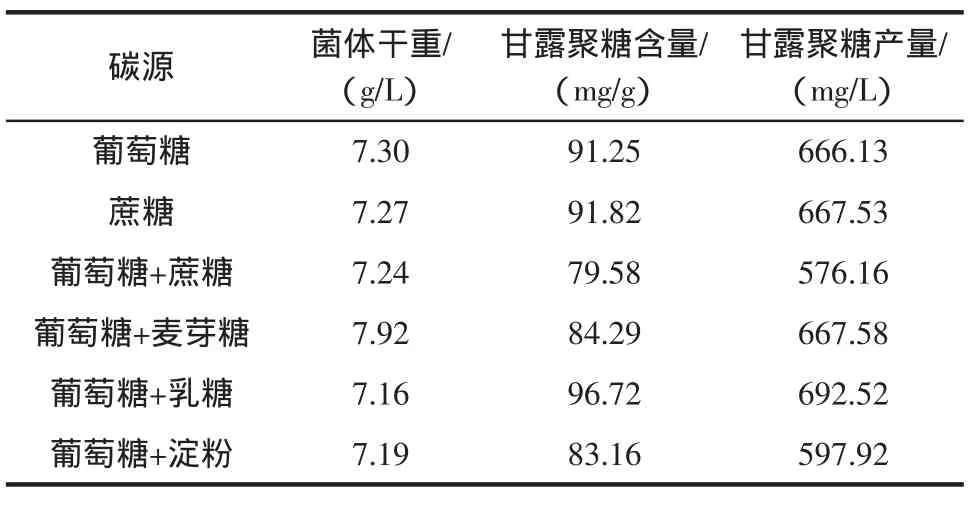
表2 碳源对酵母生长及甘露聚糖含量的影响Table2 Effectof carbon sourceson the yeast cellgrow th and the mannan content
葡萄糖是培养酵母最常用的碳源。与葡萄糖相比,当蔗糖为碳源时,其甘露聚糖含量略高于葡萄糖,二者差异并不显著。刘红芝[13]研究发现,以蔗糖为碳源时更有利于甘露聚糖的生成,与本研究的结果不同,其原因可能是所使用的酿酒酵母菌株的不同。当葡萄糖与二糖或多糖组成复合碳源时,它们的菌体干重及甘露聚糖含量有了显著差异。与葡萄糖相比,葡萄糖+蔗糖、葡萄糖+麦芽糖、葡萄糖+淀粉均使得细胞甘露聚糖含量明显下降。仅有葡萄糖+乳糖可使得细胞甘露聚糖含量显著增加,达5.47mg/g(5.99%)。尽管,葡萄糖+乳糖作碳源时,会造成菌体生长稍有下降,但其甘露聚糖产量仍高于葡萄糖,因此,从甘露聚糖含量及产量的角度考虑,菌株KD10最适碳源为葡萄糖+乳糖作碳源。
2.3 氮源对酵母生长及甘露聚糖含量的影响
氮源主要用于构成菌体细胞和含氮目的产物,其中无机氮源是微生物生长的速效氮源,有机氮源为菌体生长提供氮元素和必需的生长因子[14]。酵母粉是一种优良的有机氮源,是酵母细胞培养最常用培养基成分之一。氮源对酵母生长及甘露聚糖含量的影响见表3。

表3 氮源对酵母生长及甘露聚糖含量的影响Table3 Effectofnitrogen sourceson the yeast cellgrow th and the mannan content
从表3中可以看出,同酵母粉相比,酵母粉与蛋白胨复合作氮源时,其甘露聚糖含量稍有增加。然而,酵母粉+蛋白胨复合作氮源时,菌体生长要好于酵母粉单独作碳源,使得甘露聚糖产量增加。刘红芝[13]也发现酵母粉与蛋白胨复合作氮源时,甘露聚糖产量增加。从表3中还可以发现,酵母粉与氯化铵、尿素、硫酸铵3种无机氮源复合作氮源时,菌体干重和甘露聚糖含量均明显下降,从而使得甘露聚糖产量大幅度降低。这表明无机氮源不但抑制酵母菌体生长,而且抑制细胞甘露聚糖的合成。根据上述试验结果,菌株KD10的最适氮源为酵母粉+蛋白胨。
2.4 碳氮比对酵母生长及甘露聚糖含量的影响
碳源和氮源利用之间有密切的关系,二者之间的比例能够直接影响微生物的生长和发酵产物的积累[15]。氮源过多则会使菌体生长过于旺盛,容易引起菌体的衰老和自溶;碳源过多则容易形成较低的pH值,不利于菌体生长[16]。在固定葡萄糖用量的情况下,分别设计碳氮比为1∶1、5∶1、10∶1、20∶1、50∶1(质量比),探讨碳氮比对菌株KD10生长及甘露聚糖含量的影响,结果见表4。
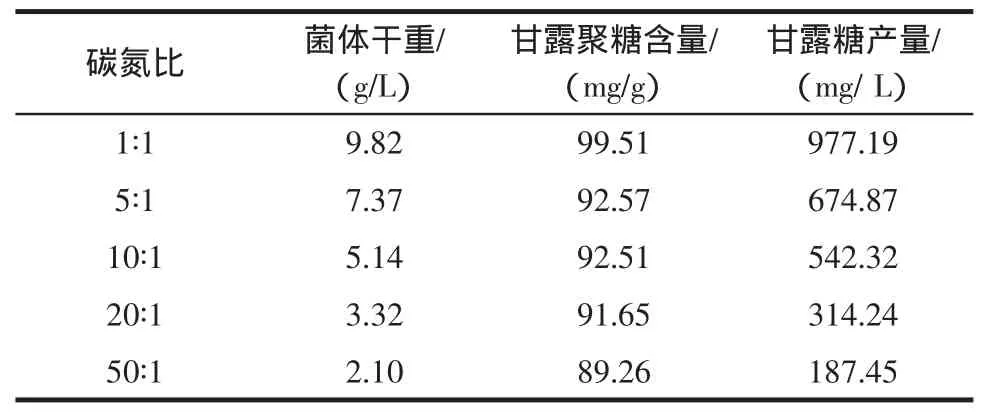
表4 碳氮比对酵母生长及甘露聚糖含量的影响Table4 Effectof C/N ratio on theyeast cellgrow th and the mannan content
从表4中可以发现,碳氮比对细胞生长有很大的影响。如表4所示,随着培养基碳氮比的增加,KD10菌体干重呈快速下降趋势。当碳氮比≥5∶1时,由于氮源供给不足而严重影响菌株KD10的生长。碳氮比对甘露聚糖含量也很大的影响。当碳氮比由1∶1增加至5∶1时,细胞甘露聚糖含量有了明显的下降,这表明充足的氮源供给有利于甘露聚糖的合成。然而,当碳氮比由5∶1增加至50∶1时,细胞甘露聚糖含量几乎保持不变。由于细胞壁是酵母的基本结构,也是细胞存活的基本条件,因此,尽管氮饥饿会使得酵母细胞数量相差很大,但酵母细胞壁厚度不会有较大差异,其甘露聚糖含量自然会比较接近。
2.5 生长因子对酵母生长及甘露聚糖含量的影响
在发酵基本培养基中添加了几种生长因子,观察其对酵母菌株KD10生长和甘露聚糖合成的影响,结果见表5。
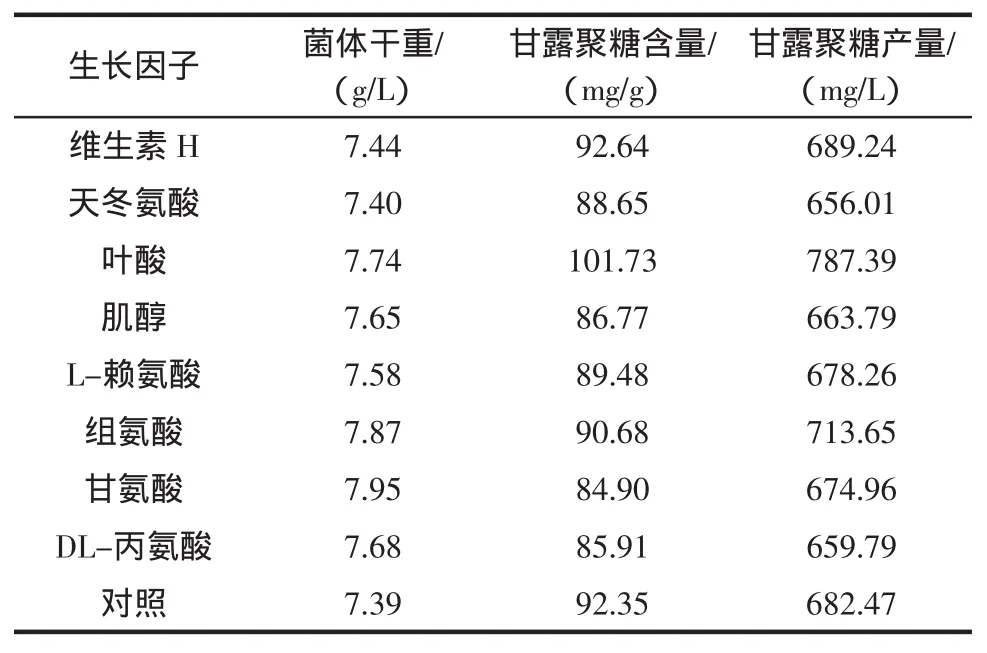
表5 生长因子对酵母生长及甘露聚糖含量的影响Table5 Effectof grow th factorson theyeast cellgrow th and the mannan content
从表5中可以看出,与培养基中没有添加生长因子的对照相比,维生素H、天冬氨酸、叶酸、肌醇、L-赖氨酸、组氨酸、甘氨酸和DL-丙氨酸对KD10的生长均有不同程度的促进作用,其中促生作用最强的是甘氨酸。然而,对于甘露聚糖的合成而言,天冬氨酸、肌醇、L-赖氨酸、组氨酸、甘氨酸和DL-丙氨酸却表现出了不同程度的抑制作用,其中抑制作用最强的也是甘氨酸,其甘露聚糖含量降低了7.45mg/g(8.07%)。维生素H对甘露聚糖的合成几乎没有影响。在所研究的8种生长因子中,只有叶酸可明显促进甘露聚糖的合成,使得细胞甘露聚糖含量提高了11.16%。
2.6 培养温度对酵母生长及甘露聚糖含量的影响
温度是影响微生物生长及代谢的最重要环境因素之一,影响见图1。

图1 培养温度对酵母生长及甘露聚糖含量的影响Fig.1 Effectof tem peratureon the yeast cellgrow th and the m annan content
如图1所示,随着培养温度的升高,菌体生物量逐渐增加,细胞甘露聚糖含量也随之增加。当培养温度为34℃时,菌体生物量和甘露聚糖含量均达到最大
值,这表明在最适培养温度下,酵母细胞合成甘露聚糖的能力最大,产生的甘露聚糖最多。当培养温度进一步升高至37℃时,菌体生长明显下降,而细胞的甘露聚糖合成也显著降低。因此,菌株KD10的最适培养温度为34℃。
2.7 环境胁迫对酵母生长及甘露聚糖含量的影响
当酵母菌株KD10生长至指数生长期中后期时,向培养基中分别加入8%氯化钠和10%乙醇后继续培养,考察环境胁迫对细胞甘露聚糖合成的影响,结果见表6。
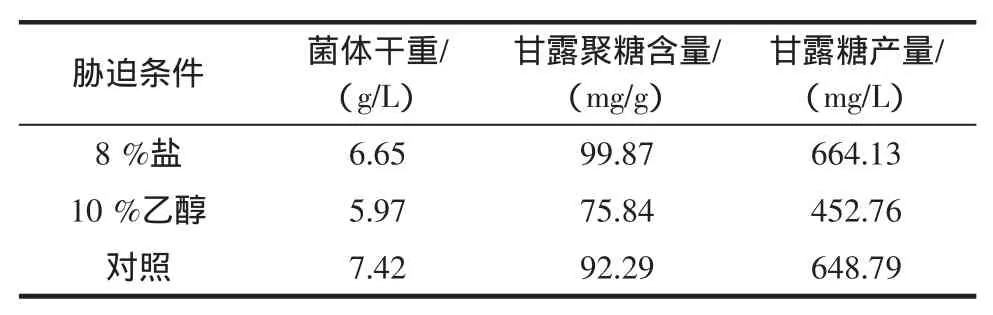
表6 环境胁迫对酵母生长及甘露聚糖含量的影响Table6 Effectof environm entalstresson the yeast cellgrow th and themannan content
如表6所示,与对照相比,添加8%氯化钠后,菌体生长下降,但却利于甘露聚糖的合成,使得细胞甘露聚糖含量提高了8.21%。10%乙醇的添加,不但造成菌体干重明显降低,而且也使得甘露聚糖含量大幅度降低。10%乙醇有利于甘露聚糖向培养环境中释放[3],但却不利用胞壁甘露聚糖合成。
3 结论
本试验从酿酒酵母的种类、培养基成分、发酵温度、环境胁迫几个方面,研究了培养条件对胞壁甘露聚糖含量的影响。研究发现,不同酿酒酵母菌株的甘露聚糖含量差别很大。在所筛选的10株酿酒酵母中,菌株KD10的甘露聚糖含量最高,达到93.44mg/g。培养基成分对细胞甘露聚糖含量有着显著的影响。葡萄糖与乳糖作复合碳源、酵母粉与蛋白胨复合作氮源时均可提高菌株KD10甘露聚糖含量。胞壁上甘露聚糖的生物合成与酵母细胞生长是否存在关联性尚难以确定。碳氮比对细胞甘露聚糖含量有很大的影响。碳氮比较低时,有利于甘露聚糖的合成,细胞甘露聚糖含量较高。叶酸可明显促进菌株KD10甘露聚糖的合成,使得甘露聚糖含量提高了11.16%。在最适培养温度(34℃)下,菌株KD10合成甘露聚糖的能力最大,产生的甘露聚糖最多。试验还发现,培养基中添加8%氯化钠,会造成菌体生长下降,但却利于甘露聚糖的合成,使得细胞甘露聚糖含量提高了8.21%。
[1] 刘红芝,王强,周素梅.酵母甘露聚糖分离提取及功能活性研究进展[J].食品科学,2008,29(5):465-468
[2]段胜林,王雪,苑鹏,等.采用催化自溶和生物破壁技术提取啤酒酵母细胞壁多糖[J].食品与发酵工业,2012,38(5):138-144
[3] 刘金龙,倪靖岳,赵国群,等.四种酵母甘露聚糖合成与释放特性的比较[J].食品工业科技,2015,36(2):199-202
[4]杨晓红,王元秀,郑明洋,等.酵母甘露聚糖的降血脂作用研究[J].食品与药品,2013,15(2):92-93
[5]Shashidhara RG,Devegowda G.Effect of dietarymannan oligosaccharide on broiler breeder production traitsand immunity[J].Poultry Science,2003,82(8):1319-1325
[6]MachováE,BystrickýS.Yeastmannans protect liposomes against peroxidationbutdonotscavenge free radicals[J].Carbohydrate Polymers,2012,88(2):793-797
[7]孔凌云,史咏华,吴炜,等.从啤酒废酵母中提取甘露聚糖的工艺条件优化[J].食品与机械,2014,30(5):216-219
[8] 刘红芝,王强,周素梅.酵母甘露聚糖分离提取及功能活性研究进展[J].食品科学,2015,29(5):465-468
[9]De Groot PW J,Ruiz C,Vazquez de Aldana CR,et al.A genomic approach for the identification and classification of genes involved in cellwall formation and its regulation in Saccharomyces cerevisiae[J].Comparativeand FunctionalGenomics,2001,2(3):124-142
[10]Abramov SA,Kotenko ST,Ramazanov A S,etal.Dependence of vitamin content in saccharomyces yeasts on the composition of nutrientmedia[J].Applied Biochemistry and Microbiology,2003,39 (4):385-387
[11]Stanislaw B,Wanda DR,Malgorzata G,et al.Impact ofmagnesium andmannose in the cultivationmediaon themagnesium biosorption, the biomass yield and on the cell wall structure of Candida utilis yeast[J].European Food Research and Technology,2008,227(3): 695-700
[12]Klis FM,Mol P,Hellingwerf K,etal.Dynamicsof cellwall structure in Saccharomyces cerevisiae[J].FEMSMicrobiology Review 2002,26(3):239-256
[13]刘红芝.酿酒酵母甘露聚糖的制备、结构鉴定及免疫活性研究[D].北京:中国农科院,2009
[14]黄静,史建明,霍文婷,等.氮源对L-色氨酸发酵的影响[J].食品与发酵工业,2011,37(5):21-25
[15]曹军卫,马辉文.微生物工程[M].2版.北京:科学出版社,2007:80-88
[16]余龙江.发酵工程原理与技术应用[M].北京:化学工业出版社, 2006:9-11
Effect of Cultivation Conditions on M annan Content in the Yeast Cells of Saccharomyces Cerevisiae
YUEXiao-an1,JIXiao-li1,ZHAOGuo-qun1,2,*
(1.CollegeofBioscienceand Bioengineering,HebeiUniversity of Scienceand Technology,Shijiazhuang 050018,Hebei,China;2.Fermentation Engineering CenterofHebeiProvince,Shijiazhuang050018,Hebei,China)
Effectofcultivation conditionsonmannan content in the yeastcellsof SaccharomycesCerevisiae was investigated in thiswork.Itwas found that themannan contents in the cells from different typesof S.Cerevisiae were greatly different.Among screened 10 strainsof S.Cerevisiae,strain KD10 had the highestmannan content in the cellsand wasup to 93.44mg/g.Themannan contentof the cells increasedwhen glucose and lactosewere used asmixed carbon source,and yeastextractand peptonewere used asmixed nitrogen source.When C/N in the culturemedium was lower,themannan content in the cellswas higher.Folic acid could stimulate themannan biosynthesisandmademannan contentof the cells increase 11.16%.Under the optimal cultivation temperature(34℃),the cellsofstrain KD10 had the biggestability to synthesizemannan and produced themaximum mannan.Addition of8%sodium chloride into the culturalmedium made the cell growth decrease,butwas in favourof themannan biosynthesisand themannan contentof the cells increased 8.21%.
mannan;SaccharomycesCerevisiae;screening;cultivation
10.3969/j.issn.1005-6521.2016.23.039
2015-09-22
岳晓安(1990—),女(汉),硕士研究生,发酵工程专业。
*通信作者:赵国群(1963—),男,教授,研究方向:食品生物技术。
