HPLC法测定黑绿豆中花青素的含量
2016-12-13陈长应
陈长应
(江苏省徐州医药高等职业学校,江苏徐州221116)
HPLC法测定黑绿豆中花青素的含量
陈长应
(江苏省徐州医药高等职业学校,江苏徐州221116)
为准确测定黑绿豆提取物中花青素的含量提供一种有效的测定方法。用HPLC法测定黑绿豆提取物中花青素的主要成分及其含量,色谱柱:250mm×4.6mm ZORBAXSB-C18,5μm;柱温:室温;流动相:甲醇+水,按甲醇∶水=5∶1(体积比);流速:1.0mL/min;进样量:10μL,检测波长:520 nm。黑绿豆中花青素的含量在1.50 g/mL~13.5 g/mL范围内与峰面积呈良好的线性关系,相对标准偏差为1.25%(N=6),平均回收率达98.4%。该方法简便快速,结果重现性好,定量准确,准确度、精密度高,适用于黑绿豆提取物中花青素的高效液相色谱分析。
HPLC;黑绿豆;花青素
黑绿豆顾名思议就是黑色的绿豆,又叫屏南黑绿豆,屏南特产黑绿豆籽粒中人体所必需的8种氨基酸的含量在0.244%~2.000%。屏南黑绿豆中脂肪含量在1%以下,含有丰富的维生素、矿物质等营养素,屏南黑绿豆中的黑色作物中含有多种微量元素,多种氨基酸、碘、硒、支链淀粉、可溶性色素等均为普通作物的几倍。花青素为黑绿豆中的主要黄酮类物质,这是一种广泛存在于自然界植物中的水溶性天然色素,在自然状态下常与各种单糖形成糖苷,称为花色苷[1-2]。目前,国内对黑绿豆提取物中花青素含量测定方面的研究报道极少,更鲜见到采用高效液相色谱法测定黑绿豆针中花青素含量的相关报道。笔者采用高效液相色谱法对黑绿豆提取物中花青素的含量的测定,该方法简便准确,可用于测定黑绿豆中花青素含量,是一种有效的检测方法。
1 材料与方法
1.1 材料
1.1.1 主要仪器
LC-20AT高效液相色谱仪、SPD-20A紫外-可见检测器:日本岛津公司;TP150超声波清洗机:天鹏电子新技术(北京)有限公司;GM-0.33II真空泵(无油)、溶剂过滤器(1 000mL):天津市津腾实验设备有限公司;MEL-204E电子分析天平:梅特勒-托利多仪器(上
海)有限公司;HH-S恒温水浴锅:江苏省金坛市正基仪器有限公司;DHG-9240烘干箱:上海一恒科学仪器有限公司;HL-28多功能食品粉碎机:上海海菱电器有限公司。
1.1.2 主要试剂
黑绿豆:市售;纯品原花青素(纯度98.3%):河北天福园生物科技有限公司;甲醇、无水乙醇、浓盐酸,均为分析纯;纯净水:杭州娃哈哈集团。
1.2 方法
1.2.1 花青素提取溶剂的配制
用量筒准确量取1mL的浓盐酸,沿着玻璃棒注入100mL容量瓶中,用甲醇定容至100mL,摇匀,配成浓度为1%的盐酸—甲醇溶液。
1.2.2 样品前处理
称取一定量的黑绿豆,用去离子水洗净后,在烘箱内低温烘干,备用。称取100 g烘干的黑绿豆,用多功能食品粉碎机粉碎,用80目的筛子过筛。准确称取干粉0.5 g(精确至0.001 g),于250mL锥形瓶中,加入100mL 1%的盐酸—甲醇提取液,摇匀,充分混匀,将浸泡液避光置于室温下保存12 h,然后使用0.45μm滤纸过滤浸泡液后,将过滤液放置在4℃冰箱中保存,残渣再使用100mL的提取液浸泡12 h,并重复上述操作,将2次的滤液移入棕色瓶中,备用[3-4]。
1.2.3 标准溶液配制
常温下,精确称取原花青素对照品0.01 g,于10mL容量瓶中,加入甲醇溶液,定容于10mL,摇匀,得到1mg/mL原花青素对照品溶液。用0.45μm针筒式滤膜过滤器过滤,滤液于10mL容量瓶中备用[5]。
1.2.4 样品溶液的制备
准确量取样品上清液10mL,置于50mL容量瓶中,加入甲醇至刻度定容,摇匀,超声处理20min,冷至室温后用0.45μm针筒式滤膜过滤器过滤,滤液于10mL容量瓶中,供高效液相色谱(HPLC)分析。
1.2.5 色谱条件
色谱柱:250mm×4.6mm ZORBAXSB-C18,5μm;柱温:室温;流动相:甲醇+水,按甲醇∶水=5∶1(体积比);流速:1.0mL/min;进样量:10μL,检测波长:520nm。
2 结果
2.1 标准曲线
精确吸取2、4、6、8、10、12 mL标准品储备液(1 mg/mL),用甲醇溶液分别配制成0.02、0.04、0.06、0.08、0.10、0.12mg/mL几种溶液。按仪器色谱条件测其峰面积,以进样浓度为横坐标,峰面积为纵坐标,绘制标准曲线。得回归方程Y=74.124X+5.246,R2=0.999 4。花青素在1.50μg/mL~13.5μg/mL范围内与峰面积呈良好的线性关系,如图1。
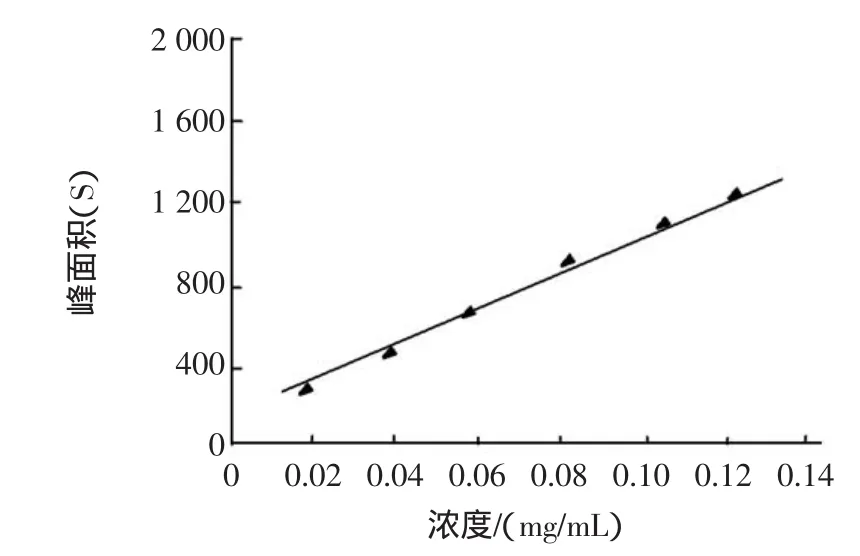
图1 原花青素标准曲线Fig.1 Anthocyanin standard curve
2.2 样品含量测定
准确量取样品溶液1mL,置于100mL容量瓶中,加入甲醇定容至100mL,吸取样品溶液10μL进入液相色谱仪,在1.2.5项色谱条件下,测定其峰面积,与标准系列比较,测定样品中花青素的含量,含量为2.64μg/mL。色谱图如图2、图3所示。
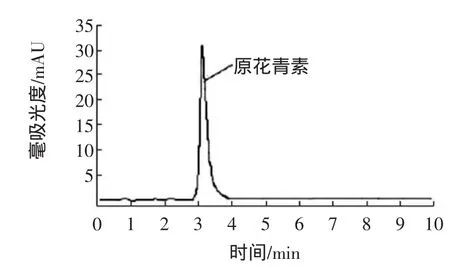
图2 花青素标准色谱图Fig.2 Anthocyanin standard chromatogram
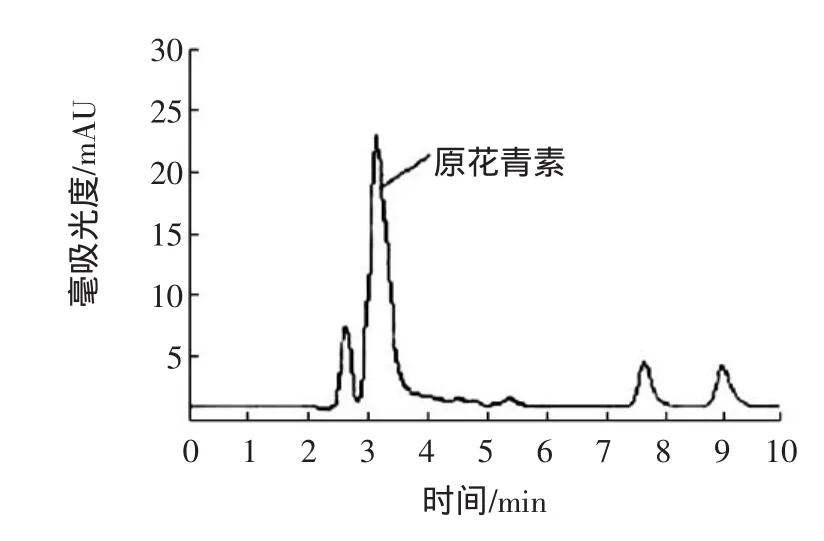
图3 样品色谱图Fig.3 Sam ple chromatogram s
由于采用不同比例的甲醇/水为流动相进行研究,结果发现,流动相中甲醇含量增加时,原花青素的保留时间缩短,峰形对称性好,在此流动相中,甲醇含量增加,保留时间缩短,峰形更加对称,灵敏度高,当甲醇
含量减少,保留时间延长,灵敏度降低,峰形出现拖尾现象。
3 分析与讨论
3.1 黑绿豆中花青素提取条件优化
3.1.1 提取溶剂的选择
准确量取黑绿豆提取液1mL,共4份,分别置于100mL容量瓶中,再分别加入甲醇、95%乙醇、1%盐酸甲醇溶液和1%盐酸乙醇溶液各50mL,定容至100mL,超声处理20min,冷至室温后,用0.45μm针筒式滤膜过滤器过滤,分别取1mL过滤液,按照1.2.5项色谱条件下,测定其峰面积,根据峰面积,计算黑绿豆中花青素的提取率,最后确定1%的盐酸甲醇溶液作为提取溶剂。
3.1.2 提取溶液中盐酸用量的选择
准确量取黑绿豆提取液1mL,共5份,分别置于100mL容量瓶中,再分别加入甲醇50mL、0.5%盐酸甲醇溶液(体积分数)50mL、1%盐酸甲醇溶液(体积分数)50mL、1.5%盐酸甲醇溶液(体积分数)50mL和2%盐酸甲醇溶液(体积分数)50mL,定容至100mL,超声处理20min,冷至室温后,用0.45μm针筒式滤膜过滤器过滤,分别取1mL,按照1.2.5项色谱条件下,测定其峰面积,根据峰面积,计算黑绿豆中花青素的提取率[7]。在提取溶剂中加入一定浓度的盐酸是为了防止提取过程中非酰基化的花青素降解,但花青素在中性条件下与金属离子发生络合沉淀,不利于提取,通过酸化处理才能断裂花青素与蛋白质、多糖及本身离子间的氢键和疏水键,及金属离子络合键,提高提取率,随着酸浓度增加,提取率随之降低[6-7]。最后确定提取溶液盐酸浓度为1%。
3.1.3 黑绿豆中花青素提取时间的选择
准确量取黑绿豆提取液1mL,共6份,分别置于6个100mL容量瓶中,再分别加入1%盐酸甲醇50mL于6份样品中,定容至100mL,密封状态下,超声处理,时间分别为5、10、15、20、25、30min,冷至室温后,用0.45μm针筒式滤膜过滤器过滤,分别取1mL,然后按照1.2.5项色谱条件下,测定其峰面积。超声处理时间过短,原花青素不能充分提取,若时间加长,加速了紫甘薯中原花青素的浸提,但是,随着时间越长,糊化现象出现机率很高,使提取剂和废渣难以通过抽滤分离,浸提量反而下降,这可能是随着超声处理时间的延长,使料液温度增高,导致原花青素酚羟基结构破坏,低聚原花青素被破坏,影响提取率[8-9],因此,确定超声处理时间最后确定为20min。
3.1.4 黑绿豆中花青素提取温度的选择
准确量取黑绿豆提取液1mL,共5份,分别置于100mL容量瓶中,再分别加入1%盐酸甲醇50mL,定容至100mL,分别在20、30、40、50、60℃条件下超声处理20min,冷却后,用0.45μm针筒式滤膜过滤器过滤,分别取滤液1mL,然后按照1.2.5项色谱条件下,测定其峰面积,根据峰面积,计算黑绿豆中花青素的提取率。随着反应温度的升高,提取率先增大然后略有降低,在50℃时达到最大值。随温度升高,分子运动速度加快,原花青素浸出速度加快,提取率增加,但原花青素为热不稳定物质,高温会使原花青素氧化破坏,稳定性减弱,高温下低聚原花青素被破坏,提取率下降[10-11]。最后确定提取温度确定为50℃。
3.1.5 黑绿豆中花青素提取料液比的选择
准确量取黑绿豆提取液1mL,共5份,分别置于100mL容量瓶中,分别加入1%盐酸甲醇50mL,定容至100mL,分别选取料液比1∶10、1∶15、1∶20、1∶25、1∶30(g/mL)条件下,超声处理20 min,冷却后,用0.45μm针筒式滤膜过滤器过滤,分别取滤液1mL,然后按照1.2.5项色谱条件下,测定其峰面积。根据峰面积,计算黑绿豆中花青素的提取率。试验结果显示,提取率先增大然后降低,当料液比为1∶20(g/mL)时,提取率最高,若再增大料液比,在过滤过程中,就会增大溶剂与过滤仪器的接触面积,延长过滤时间,从而增加原花青素的过滤损耗,最后提取料液比确定为1∶20(g/mL)[12-13]。
3.2 精密度试验
准确移取1.0mL同一样品溶液6份,于6个10mL容量瓶中,分别用流动相稀释至刻度,摇匀,超声处理20min,冷却后,用0.45μm针筒式滤膜过滤器过滤,按1.2.5方法进行HPLC分析,计算相对标准偏差为1.25%(N=6),结果表明本方法精密度良好[14]。精密度试验见表1,精密度标准误差线见图4。

表1 精密度试验Table1 Precision experiment results

图4 精密度标准误差线Fig.4 The precision of standard error of the line
3.3 回收率试验
精密量取已知准确含量的样品溶液5mL 6份,于6个100mL容量瓶中,分别加入已知含量的花青素标准溶液,加流动相稀释至刻度,摇匀,超声处理20min,冷却后,用0.45μm针筒式滤膜过滤器过滤,分别取滤液1mL,然后按照1.2.5项色谱条件下记录色谱图,测定其峰面积,计算回收率[15]。回收率达98.4%,RSD值为3.46%。加标回收试验结果见表2,回收率标准误差线见图5。
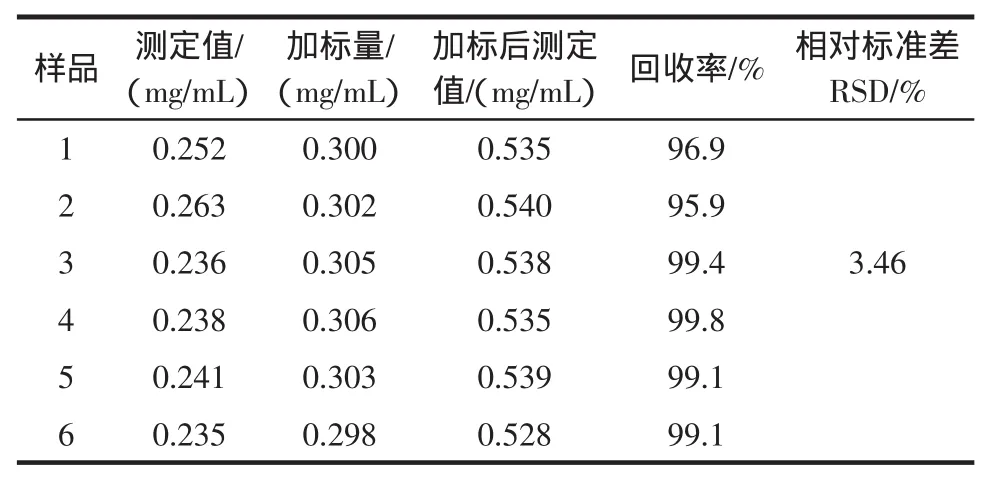
表2 加标回收试验结果Tab le2 The resultsof standard addition recovery

图5 回收率标准误差线Fig.5 Recovery rateof standard error of the line
3.4 重现性试验
精确量取同一批次的样品6份,每份5mL,分别置50mL容量瓶中,加流动相稀释至刻度,摇匀,摇匀,超声处理20min,冷却后,用0.45μm针筒式滤膜过滤器过滤,分别取滤液1mL,然后按照1.2.5项色谱条件下记录色谱图,测定其峰面积,依次操作。得到结果:92.331 8、93.311 9、92.421 8、91.877 6、92.351 7、92.509 5,得均值92.467 4,RSD为0.184%,表明方法重现性良好[16]。峰面积标准误差线见图6。
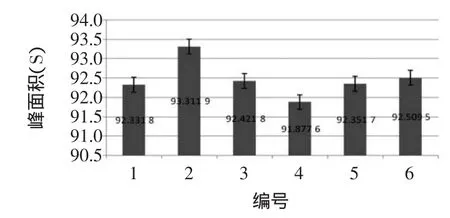
图6 峰面积标准误差线Fig.6 Thepeak area of standard error of the line
3.5 稳定性试验
精确量取同一批次的样品5mL,分别置50mL容量瓶中,加流动相稀释至刻度,摇匀,摇匀,超声处理20min,冷却后,用0.45μm针筒式滤膜过滤器过滤,分别取滤液1mL,然后按照1.2.5项色谱条件下分别在0、6、12、24、36、72 h测定一次峰面积,结果其峰面积的RSD为1.02%,表明样品溶液在72 h内稳定。
4 结论
在提取溶剂为1%盐酸甲醇溶液(体积分数)、超声处理20min、提取温度为50℃、提取料液比为1∶20(g/mL),在色谱柱为250mm×4.6mm ZORBAXSBC18,5μm;柱温:室温;流动相:甲醇+水,按甲醇∶水= 4∶1(体积比);流速:1.0mL/min;进样量:10μL的条件下,对黑绿豆中花青素含量进行测定,测定结果表明:花青素线性范围1.50μg/mL~13.5μg/mL,相对标准偏差为1.25%(N=6),加标平均回收率为98.4%,重现性较好,该方法简便准确,可作为黑绿豆中花青素含量的测定方法。
[1]薛晓丽.HPLC法测定黑米中花青素的主要成分及含量[J].安徽农业科学,2009,37(11):4854-4855
[2] 杨大进,方从容,魏润蕴.保健食品中前花青素的高效液相色谱测定[J].中国卫生检验杂志,2003(4):448-449
[3]蔡晓,杨长晓.紫外分光光度法测定保健食品中原花青素的研究[J].中国卫生检验杂志,2010(4):744-45
[4]马自超,吴伟志.高效液相色谱测定花青素色素含量[J].林业科技开发,1988(4):29-30
[5] 毛建霏,周虹,雷绍荣,等.高效液相色谱法测定紫甘薯花青素含量[J].西南农业学报,2012(1):123-127
[6] 刘桂玲,李海霞,郭宾会.不同提取方法对甘薯花青素含量测定的影响[J].中国农学通报,2007(4):91-94
[7]陈新,周宏,薛蒙.紫甘薯中花青素提取工艺及测定方法研究[J].南京晓庄学院学报,2010(6):57-60
[8]李文红,赵新涛.高效液相色谱法测定紫薯中的原花青素[J].河南预防医学杂志,2014(2):181-182
[9]赵平,宋学娟,张月萍,等.葡萄籽原花青素含量测定[J].河北化工, 2007(1):46-48
[10]傅武胜,赵道辉,黄剑锋.紫外分光光度法测定葡萄籽提取物中的原花青素含量[J].食品研究与开发,2002(6):90-92
[11]王庆,郭红辉,张名位,等.高效液相色谱法分析黑米皮花青素及其体内代谢产物[J].食品科学,2006(5):212-215
[12]韩永斌.紫甘薯花色苷提取工艺与组分分析及其稳定性和氧化性研究[D].南京:南京农业大学,2007
[13]孙芸,谷文英.硫酸2-香草醛法测定葡萄籽原花青素含量[J].食品与发酵工业,2003(9):43-46
[14]张泽生,林纪伟,王志平,等.比色法测定不同产地黑豆皮中花青素含量[J].食品研究与开发,2012,33(5):151-153,164
[15]刘占云,刘晓秋,白淑芳,等.HPLC法测定不同产地黑豆皮中矢车菊素-3-O-葡萄糖苷的含量[J].食品科学,2011,9(25):264-267
[16]陈晨,文怀秀,赵晓辉,等.黑果枸杞色素中原花青素含量测定[J].光谱实验室,2011,28(4):1767-1769
Determ ining the Content of Anthocyanins in Black M ung Bean by HPLC
CHENChang-ying
(Jiangsu Xuzhou High MedicalVocationalSchool,Xuzhou 221116,Jiangsu,China)
This article is to provide an effectivemethod which can accurately determine the anthocyanins content in black mung bean extract.Under high performance liquid chromatography(HPLC)method,themain composition of anthocyanins and its content in blackmung bean extractwas determined.Themain conditions used in themethodwere as follows:chromatographic column:250mm×4.6mm ZORBAXSB-C18,5μm;column temperature:room temperature;mobilephase:methanol+waterwith volume ratiobeingmethanol:water= 5∶1;flow rate:1.0mL/min;sample quantity:10μL,detection wavelength:520 nm.The Anthocyanins content in blackmung beanwasaround 1.5 g/mL-13.5 g/mL and ithad good linear relationship with the peak area,the relative standard deviationwas1.25%(N=6)and the average recovery ratewas98.4%.Thismethod issimple,efficient and quantitatively accurate with high reproducibility and precision,which makes it suitable for HPLCanalysisofanthocyaninsin blackmungbean extract.
HPLC;blackmungbean;anthocyanins
10.3969/j.issn.1005-6521.2016.23.035
2016-02-19
陈长应(1965—),男(汉),副教授,硕士,主要从事化学教学、分析工作。
