福林酚比色法测定酸浆宿萼中总多酚含量
2016-12-13张洋婷郗艳丽葛红娟冯小雨马洪波
张洋婷,郗艳丽,葛红娟,冯小雨,马洪波
(吉林医药学院公共卫生学院,吉林吉林132013)
福林酚比色法测定酸浆宿萼中总多酚含量
张洋婷,郗艳丽,葛红娟,冯小雨,马洪波*
(吉林医药学院公共卫生学院,吉林吉林132013)
优化福林酚法测定酸浆宿萼总多酚含量的条件,并对其进行分析评价。结果表明:样本0.5mL,福林酚用量1.0mL,10%Na2CO3用量8mL,当反应时间为2.5 h,反应温度为20℃,在波长760 nm处测定时,总多酚的含量与吸光度呈良好的线性关系,该方法操作简便、灵敏度高、精密度高,稳定性好,适宜酸浆宿萼总多酚含量的测定。
酸浆宿萼;福林酚;多酚
酸浆 (Physalis alkekengi L.var.franchetii(Mast)Makino)是茄科酸浆属,多年生宿根草本植物,又名红姑娘、挂金灯等[1]。成熟时红似玛瑙,外观美丽,酸甜可口,全身可入药[2]。酸浆宿萼为药典中明确规定的药用部位,其味酸、苦,性寒,具有清热解毒、利咽化痰、利尿等作用[3]。在我国部分地区,有将酸浆宿萼晒干后当茶饮的习俗,可清热去火。植物多酚是一类具有独特生理活性和药理活性的天然产物,广泛存在于水果、蔬菜、茶叶和咖啡等植物体内[4-5]。大量研究表明,植物多酚在抗肿瘤、抗病毒、抗氧化、抗炎杀菌、保护心血管等很多方面具有显著的作用[6-11],因而,在制药、生化、日化、食品以及精细化工等领域具有广泛的应用前景[12]。
多酚类物质含量的测定方法较多,例如高锰酸钾法、酒石酸亚铁比色法、福林酚比色法、紫外分光光度法、原子吸收法和高效液相色谱法等[13-17],相比较而言,福林酚法操作简单,重现性好,是目前测多酚的通用方法。但福林酚法目前尚未有统一的实验条件,文献报道各种植物提取物的测定条件,例如福林酚用量,碳酸钠的浓度和用量、反应体系体积、反应时间及温度等都不尽相同。因此,本试验旨在优化福林酚法测定酸浆宿萼总多酚含量的条件,建立一种便捷、准确的测定方法,为进一步研究酸浆宿萼总多酚生物活性提供理论参考。
1 材料与方法
1.1 材料与试剂
酸浆宿萼:采购于吉林省吉林市丰满区,经自然风干后,粉碎,置于干燥器中,备用。
碳酸钠、无水乙醇、没食子酸、福林酚:均为分析纯,市购。
1.2 仪器与设备
AF-20A型高速粉碎机:温岭市奥力中药机械有限公司;FA1104N电子天平:上海精密科学仪器有限公司;KQ-100DB型数控超声波清洗器:昆山市超声仪器有限公司;HHS型电热恒温水浴锅:上海博讯实业有限公司;722可见分光光度计:上海欣茂仪器有限公司。
1.3 方法
1.3.1 条件的优化
1.3.1.1 测定波长的确定
分别移取样品液和没食子酸标准溶液各0.5mL于具塞试管中,加入5mL蒸馏水,混匀后加入1.0mL福林酚试剂,静置1min后加入10mL10%Na2CO3溶液,加蒸馏水定容至25mL,室温下避光反应2.5 h,在500 nm~900 nm波长范围内测定吸光值,从而选择最佳测定波长。
1.3.1.2 10%Na2CO3溶液用量的确定
精密移取5份0.5mL样品液于25mL具塞试管中,加入5mL蒸馏水,混匀后加入福林酚显色剂1.0mL,静置1min后分别加入10%Na2CO3溶液2.0、4.0、6.0、8.0、10.0mL,蒸馏水定容至25mL,室温下避光反应2.5 h后,在最佳波长处测定吸光值,以确定10% Na2CO3溶液的用量。
1.3.1.3 福林酚用量的确定
取6份0.5mL样品液于25mL具塞试管中,加入5mL蒸馏水,混匀后加入福林酚显色剂0.2、0.4、0.6、0.8、1.0、1.2mL,静置1min后加入10mL10%Na2CO3溶液,加蒸馏水定容至25mL,室温下避光反应2.5 h后,在最佳波长处测定吸光度,以确定福林酚的用量。
1.3.1.4 显色温度的确定
取5份0.5mL样品液于25mL具塞试管中,加入5mL蒸馏水,混匀后加入福林酚试剂1.0mL混匀,静置1min后加入10mL10%Na2CO3溶液,加蒸馏水定容至25mL,分别在15、20、25、30、35℃条件下水浴避光反应2.5 h,在最佳测量波长处进行吸光度,以确定适宜的反应温度。
1.3.1.5 显色时间的确定
取6份0.5mL样品液于25mL具塞试管中,加入5mL蒸馏水,混匀后加入福林酚显色1.0 mL,静置1min后加入10mL10%Na2CO3溶液,蒸馏水定容至刻度,在最佳温度下避光反应1.0、1.5、2.0、2.5、3.0、3.5 h后,在最佳测量波长处进行吸光度,以确定适宜的反应时间。
1.3.2 样品中总多酚含量的测定
分别移取没食子酸标准液0.2、0.4、0.6、0.8、1.0、 1.2mL,置于25mL具塞试管中,加入5mL蒸馏水,混匀后加入1.0mL福林酚显色剂,静置1min后加入10%Na2CO3溶液8mL,加蒸馏水定容至刻度,20℃下避光反应2.5 h后,在760 nm处测定吸光度,以没食子酸溶液质量浓度为横坐标,吸光度值为纵坐标绘制标准曲线。取待测样品0.5mL于具塞试管中,其他操作同上,根据标准曲线计算出样品中总多酚的含量。
1.3.3 分析方法的评价
1.3.3.1 精密度试验
取5份0.5mL样品于具塞试管中,按优化后的条件测定吸光度。计算相对标准偏差,评价分析方法的精密度。
1.3.3.2 稳定性试验
取0.5mL样品于具塞试管中,按优化后的条件进行操作,于20℃条件下避光分别放置0.5、1、1.5、2、2.5、3、4 h后在760 nm处测定吸光度。计算相对标准偏差,评价分析方法的稳定性。
1.3.3.3 加标回收试验
取5份0.5mL样品于具塞试管中,分别加入0.1、0.2、0.3、0.4、0.5mL没食子酸标准溶液,按优化的条件测定吸光度。计算没食子酸的平均回收率和试验结果的相对标准偏差,评价试验方法的可靠性。
2 结果与讨论
2.1 单因素试验
2.1.1 最佳测定波长的确定
研究表明福林酚试剂与多酚物质的反应在680 nm~780 nm处有较大吸收。取样品适量,经过溶剂提取后,得到供试原液。常温避光反应2.5 h后,以蒸馏水为空白,500 nm~900 nm可见光区下扫描,样品和没食子酸标准溶液的光谱吸收曲线见图1。
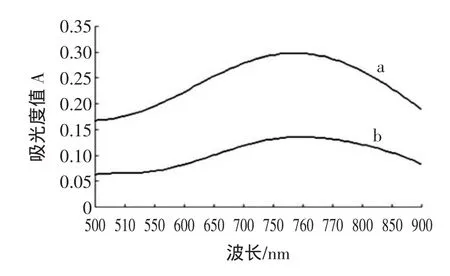
图1 样品(a)和没食子酸标准溶液(b)的光谱吸收曲线Fig.1 Spectralabsorption curveof sample(a)and standard gallic acid solution(b)
从图1可以看出两者均在760 nm有最大吸收,故选760 nm为检测波长。
2.1.2 10%Na2CO3溶液用量的确定
碳酸钠溶液是福林酚法测定多酚反应的缓冲液,碳酸钠对显色效果的影响见图2。
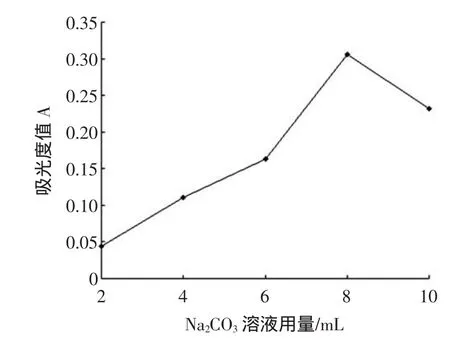
图2 10%Na2CO3用量对反应的影响Fig.2 Effectsof volum esof 10%Na2CO3on absorbance
从图2可知,吸光度值随着10%Na2CO3用量的增加而增大,当10%Na2CO3溶液用量为8mL时,吸光度值达到最大;此时,继续增加10%Na2CO3用量,吸光度值则减少,所以10%Na2CO3溶液的最佳用量为8mL。
2.1.3 福林酚用量的确定
福林酚试剂与多酚物质结合在碱性条件下呈蓝色,福林酚试剂对反应显色效果的影响如图3所示。
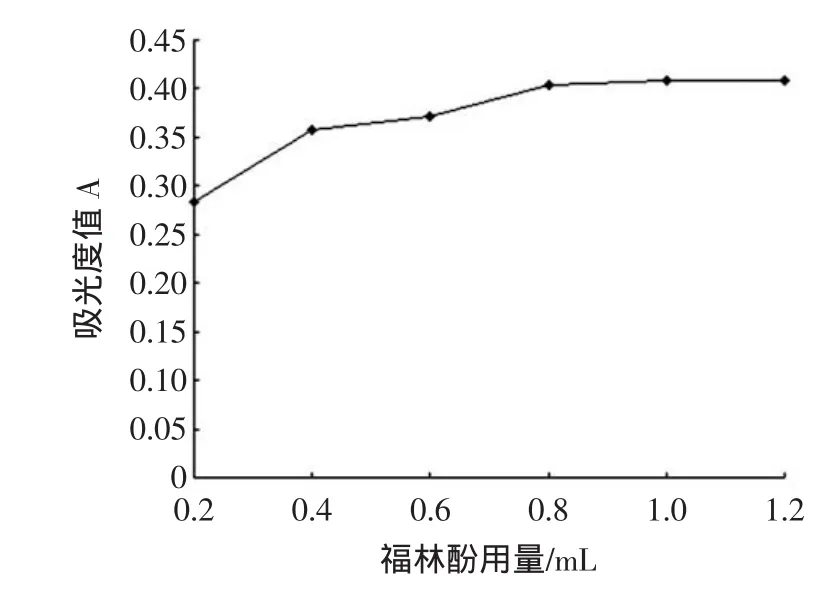
图3 福林酚用量对反应的影响Fig.3 Effectsof volum esof Folin Ciocalten reagenton absorbance
由图3可以看出,福林酚试剂用量小于1.0mL时,吸光值增加明显,福林酚试剂大于1.0mL时,吸光值增加不明显,趋于稳定。因此,选择选择福林酚试剂加入量为1.0mL。
2.1.4 显色温度的确定
温度会影响多酚物质的稳定性。在相同的反应条件下,温度对显色效果的影响见图4。
由图4可知,反应温度在15℃~20℃范围内时,吸光度值随着温度的增加而降低;当显色温度大于20℃时,吸光值则随着温度的增加而降低。所以,最佳反应温度确定为20℃。
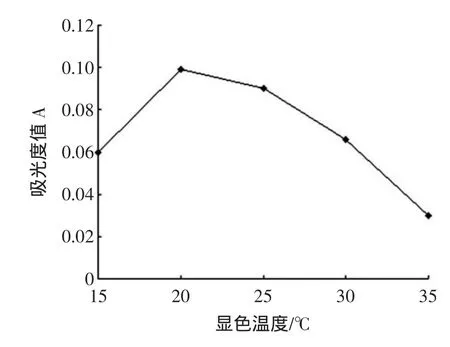
图4 显色温度对反应的影响Fig.4 Effectof tem peratureon absorbance
2.1.5 显色时间的确定
显色时间不足会影响测量结果的准确性,显色时间对显色效果的影响如图5所示。
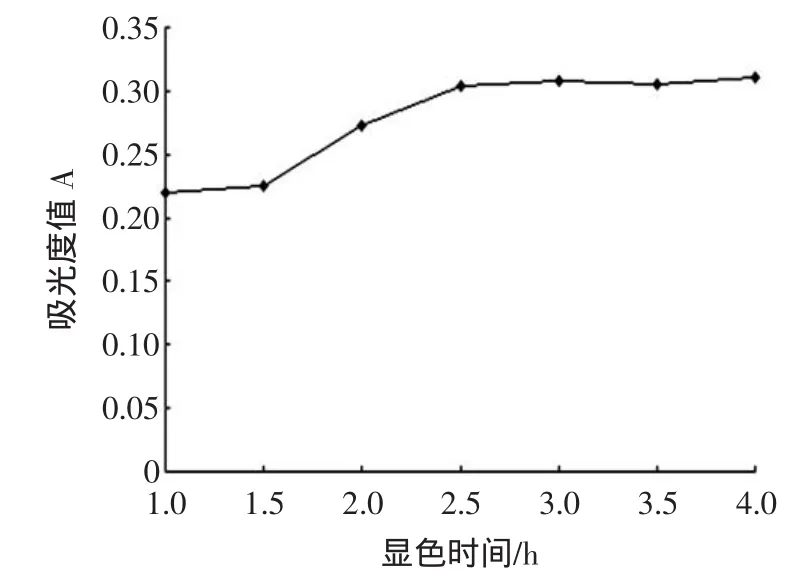
图5 显色时间对反应的影响Fig.5 Effectof reaction timeon absorbance
由图5可知,当显色时间在1.0 h~2.5 h内时,吸光度值随着显色时间的增加且逐渐增大,2.5 h对应的吸光度值最大;当显色时间大于2.5 h时,吸光度值的变化幅度不大,基本持平。考虑到时间过长不利于试验操作,因此,确定反应时间为2.5 h。
2.2 样品中总多酚含量的测定
以没食子酸溶液质量浓度为横坐标,吸光度值为纵坐标绘制标准曲线。回归方程为y=0.116x-0.028 5,相关系数R2=0.998 9。取0.5mL待测样品,按照上述方法测定其的吸光度为0.059,计算出酸浆宿萼提取物总多酚含量为9.495mg/g。
2.3 分析方法评价
2.3.1 精密度试验
将同一份样品反应液连续测定6次吸光度值,相对标准偏差RSD为0.82%,说明该仪器精密度良好。
2.3.2 稳定性试验
按照已确定的反应条件制备5份平行样品溶液,分别测定其吸光度值,相对标准偏差(RSD)为2.78%,
说明该方法重现性良好。
2.3.3 加标回收试验
加标回收试验结果见表1。
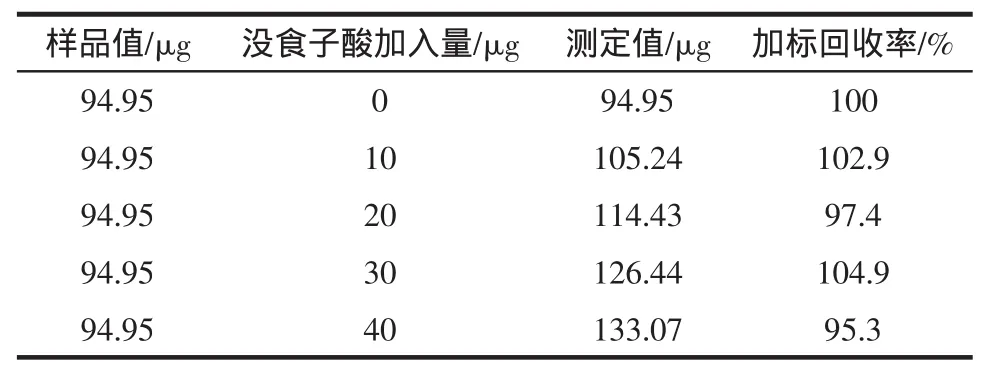
表1 加标回收试验结果Table1 Resultof average recovery experim ent
从表1可以看出各组的回收率在95.3%~104.9%,平均回收率100.1%,相对标准偏差(RSD)为3.89%,说明该分析方法可靠,可用于酸浆宿萼多酚含量的测定。
3 结论
在参考GB/T 8313-2008《茶叶中茶多酚和儿茶素类含量的检测方法》[18]的基础上,对福林酚法测定酸浆宿萼总多酚含量的条件进行探索。得出福林酚比色法测定酸浆宿萼的适宜条件为:10%Na2CO3溶液用量8mL,福林酚试剂用量为1.0mL,20℃避光反应2.5 h,在760 nm处检测酸浆宿萼中多酚类物质的吸光度值。并且该方法的平均回收率为100.1%,相对标准偏差为3.89%,可用于酸浆宿萼中总多酚含量的测定。
[1]帕提古丽·马合木提,高莉,史博,等.酸浆花萼色素的提取及理化性质研究[J].食品科学,2004,25(9):35-38
[2]张岚,葛红娟,温武略,等.酸浆宿萼总黄酮体外对羟基自由基的抑制作用[J].时珍国医国药,2011,8(22):1936-1937
[3]国家药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2005:250-251
[4]石碧,狄莹.植物多酚[M].北京:科学出版社,2000:1-2
[5]Fialho E.Polyphenol availability in fruits and vegetables consumed in Brazil[J].Rev SaúdePública,2009,43:1-8
[6]Padurariu M,A Ciobica,LHritcu,etal.2010.Changes of some oxidative stressmarkers in the serum of patients with mild cognitive impairmentand Alzheimer'sdisease[J].Neuroscience Letters,2010, 469(1):6-10
[7]BARREIRA C,ISABELC F,BEATRIZ PO,et al.Antioxidant activities of the extracts from chestnut flower,leaf,skins and fruit[J]. Food Chemistry,2008,107:1106-1113
[8]Vita JA.Polyphenols and cardiovascular disease:effects on endothelialand platelet function[J].Am JClin Nutr,2005,81:292-297
[9]Wolfe K L,R H Liu.Structure-activity relationshipsof flavonoids in the cellular antioxidant activity assay[J].Journalofagriculturaland food chemistry,2008,56(18):8404-8411
[10]LETICIA X,ROSA M,VALERIO-ALFARO G,et al.Antioxidant activity,phenolic compounds and anthocyanins content of eighteen strainsofMexicanmaize[J].Food Science and Technology,2009, 42:1187-1192
[11]JESUSNS,EVALDOM S,ADELINE L,etal.Antioxidant capacity of four polyphenol-rich Amazonian plant extracts:a correlation study using chemical and biological in vitro assays[J].Food Chemistry,2008,106:331-339
[12]宋立江,狄莹,石碧,等.植物多酚研究与利用的意义及发展趋势[J].化学发展.2000,12(2):161-170
[13]王烨军,徐奕鼎,黄建琴,等.酒石酸亚铁比色法和高锰酸钾滴定法测定茶多酚的比较[J].茶业通报,2010(2):61-63
[14]李巨秀,王柏玉.福林-酚比色法测定桑椹中总多酚[J].食品科学, 2009,30(18):292-295
[15]MEDINA-REMON A,BARRIONUEVO-GONZALEZ A,ZAMORA-ROSR,et al.Rapid Folin-Ciocalteu method usingmicrotiter 96-well plate cartridges for solid phase extraction to assess urinary totalphenolic compounds,asabiomarkerof totalpolyphenols intake [J].Analytica Chimica Acta,2009,634(1):54-60
[16]郎惠云,廖晓玲,董发昕,等.间接原子吸收法测定茶叶中茶多酚的含量[J].西北大学学报,2003,33(6):683-685
[17]KARAMAN S,TUTEM E,SOZGEN BASKAN K,et al.Comparison of totalantioxidantcapacity and phenolic composition ofsome apple juices with combined HPLC-CUPRAC assay[J].Food Chemistry, 2010,120(4):1201-1209
[18]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 8313-2008茶叶中茶多酚和儿茶素类含量的检测方法[S].北京:中国标准出版社,2008:6
Determ ination of Total Polyphenols in Calyx Physalis by Folin-ciocalteu M ethod
ZHANGYang-ting,XIYan-li,GEHong-juan,FENGXiao-yu,MA Hong-bo*
(SchoolofPublic Health,Jilin MedicalUniversity,Jilin 132013,Jilin,China)
Theoptimum condition on determining totalpolyphenols content in calyx physalisby Folin-ciocalteu method was studied.The results indicated that the optimum conditions for total polyphenols determination by Folin-Ciocalteu were as follows:1.0mL of Folin-ciocalteu reagentwas added in 0.5mL of sample,and then 8mL of10%sodium carbonate solution wasadded.After the coloration reactionwas for2.5 h at20℃,the opticaldensitywasmeasured at760 nm.Under theoptimum conditions,theabsorbance increased linearlywith the concentration of gallic acid.Themethod is fast,highly precise and stable,and suitable for determining total polyphenol contentin calyx physalis.
calyx physalis;Folin-ciocalteu;polyphenol
10.3969/j.issn.1005-6521.2016.23.032
2016-09-13
吉林省教育厅“十二五”科学技术研究项目(2013360);吉林省卫生计生课题(2014ZC063);吉林省教育厅项目(2015403)
张洋婷(1986—),女(汉),助教,硕士,研究方向:营养与食品卫生。
*通信作者:马洪波(1969—),男(汉),副教授,硕士。
