响应曲面试验优化猕猴桃中SOD的提取工艺
2016-12-13刘海英
刘海英
(内蒙古商贸职业学院食品工程系,内蒙古呼和浩特010070)
响应曲面试验优化猕猴桃中SOD的提取工艺
刘海英
(内蒙古商贸职业学院食品工程系,内蒙古呼和浩特010070)
优化猕猴桃中超氧化物岐化酶(SOD)提取工艺,旨在进一步开发植物SOD酶源。选取猕猴桃为原料,在单因素试验基础上,应用Box-Behnken响应曲面设计,以热变性温度、热变性时间、丙酮沉淀处理为试验因素,以SOD酶活性为响应变量,分析并优化SOD的提取工艺。试验确立了最佳的SOD提取工艺参数为热变性温度57.5℃、热变性时间27min、V丙酮∶VSOD酶液=0.93,此条件下,SOD酶活性为(835±25)U/mL。
超氧化物岐化酶;响应曲面设计;提取工艺
超氧化物歧化酶(SuperoxideDismutase,EC1.15.11)简称SOD,是一种广泛存在于动物、植物、好氧微生物细胞中的金属酶,是唯一能够特异性清除超氧阴离子自由基的抗氧化酶[1]。SOD水平高低直接影响着生物体的衰老与死亡,SOD主要生理功能为平衡机体的氧自由基,从而有效预防活性氧对生物体的毒害作用。当前SOD主要应用于医药、食品、农业、化妆品及人和动植物许多疾病的监测等领域。当前,常用的SOD主要为动物源性,其具有价格昂贵、常温保存时间短、存在病毒等生物活性物质的交叉感染风险,国际卫生组织已停止动物源性SOD的使用[2]。人们日常食用的瓜果蔬菜、野生植物中含有大量的植物性SOD,由于植物中的SOD纯属植物天然蛋白,不含对人体有害物质,避免了交叉感染发生的可能,使用安全性高,具有明显的社会和经济效益,市场前景广阔。近年来发现猕猴桃中含有一定量的超氧化物歧化酶,因此,笔者选择猕猴桃作为试验原材料优化SOD的提取工艺。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 原材料与试剂
猕猴桃:市售。
KH2PO4、Na2HPO4·12H2O、柠檬酸、KCl、NaCl、丙酮、邻苯三酚等:试剂均为分析纯,均来自国药集团化学试剂有限公司。
1.1.2 仪器与设备
BT2202S型电子天平:德国赛多利斯;H2500R-2高速冷冻离心机:湘仪离心机仪器有限公司;HH-S8恒温水浴锅:常州国宇仪器制造有限公司;UV1102型
紫外分光光度计:上海天美;HYC-360医用冷藏柜:海尔集团;漩涡振荡仪:海门市其林贝尔仪器厂;研钵;过滤系统;量筒;烧杯等。
1.2 方法
1.2.1 工艺流程[3]
猕猴桃→研磨→浸提→过滤、离心→粗酶液→热变性处理→离心取上清液→等电点沉淀处理去除杂蛋白→丙酮沉淀处理去除杂蛋白→蛋白酶。
1.2.2 SOD的活力测定
采用Mark lund邻苯三酚自氧化法[4-6]进行测定。酶活力单位的定义为:在1mL反应液中,每分钟抑制邻苯三酚自氧化速率50%时的酶量为1个活力单位。
1.2.3 单因素试验
根据猕猴桃中SOD的性质,选取浸提缓冲溶液的pH值、浸提时间、热处理温度、热处理时间、等电点沉淀pH值、丙酮沉淀处理6个单因素进行分析。

表1 试验设计单因素及其水平Table1 Thesingle factor and the levelof theexperimentaldesign
粗酶液提取:称取500g市售猕猴桃,在冰浴环境下研磨充分,将所有研磨所得物一并倒入1000mL烧杯中,加入2倍体积50mmol/L磷酸盐缓冲液置于医用冷藏柜中浸提,过滤系统过滤,然后将滤液在10000 r/min的条件下高速冷冻离心(4℃)15min,最后将离心液通过滤纸过滤,制成SOD粗酶液。
热变性处理:取试管加入SOD粗酶原液3mL,在试验设计温度的恒温水浴锅中加热指定时间,倒入离心管中进行10 000 r/min冷冻离心20min后,去除沉淀杂蛋白,将上清液置于25℃恒温水浴锅中20min后进行酶活性测定,每次操作重复3次。
等电点沉淀处理:取热变性后的SOD酶液2mL,分别加入试验设计的pH值的磷酸盐缓冲液,迅速混匀置于4℃医用冷藏柜中沉淀30min,倒入离心管中,10 000 r/min冷冻离心20min,去除沉淀杂蛋白,将上清液放于25℃恒温水浴锅中20min后进行酶活性测定,每次操作重复3次。
丙酮沉淀处理:取试管加入3mL等电点沉淀的SOD酶液,然后试管中加入指定体积的丙酮,混匀后立即置于4℃医用冷藏柜中沉淀30min,倒入离心管中,10 000 r/min冷冻离心20min,去除沉淀杂蛋白,将上清液放于25℃恒温水浴锅中20min后进行酶活性测定,每次操作重复3次。
1.2.4 SOD提取工艺的响应曲面优化[7-8]
根据单因素试验结果,选择热变性温度、热变性时间、丙酮沉淀处理为主要因素,设计三因素三水平响应曲面试验,并对试验结果进行分析和优化。
1.2.5 数据分析
采用Excel2007对单因素试验中的各因素进行比较分析。各组间试验数据以x±s表示。采用minitab15进行响应曲面试验设计、分析及优化,以α=0.05作为显著性水平。所有试验均重复3次。
2 结果与分析
2.1 单因素对SOD酶活性的影响
浸提缓冲溶液的pH值、浸提时间、热处理温度、热处理时间、等电点沉淀pH值、丙酮沉淀处理6个单因素试验结果见图1。
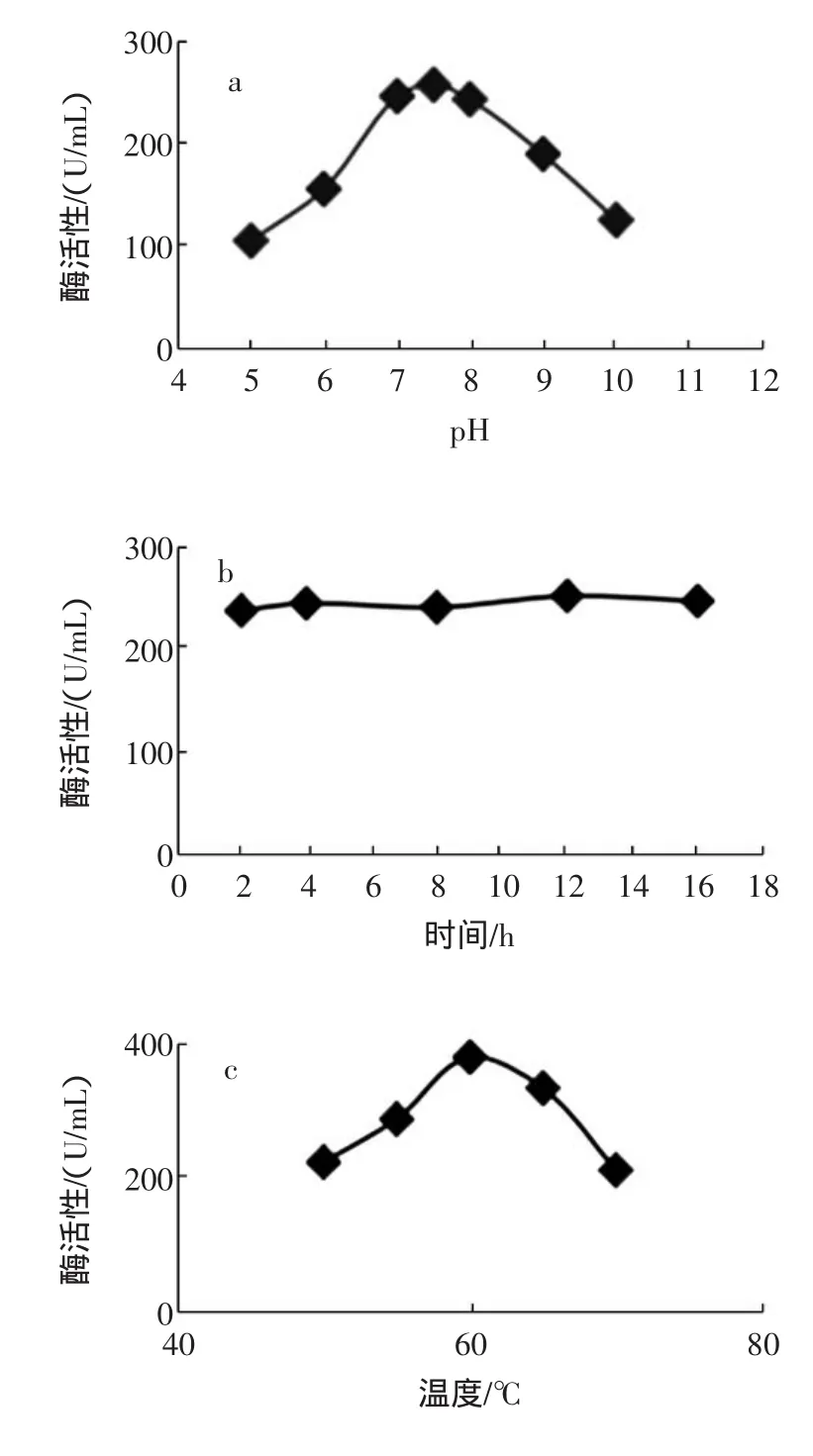
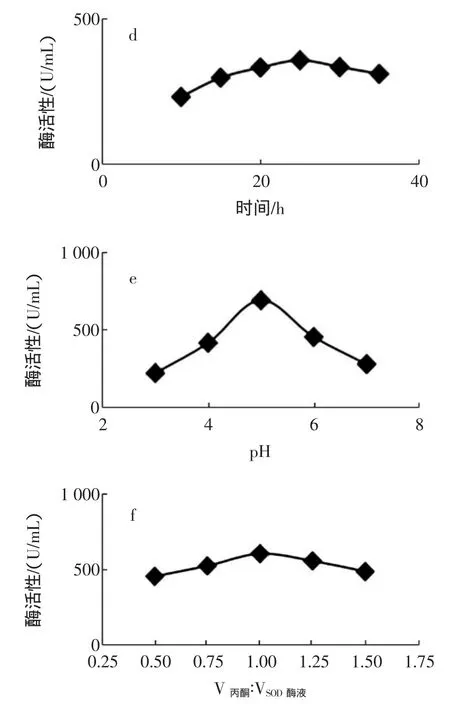
图1 单因素试验结果Fig.1 Single factor test results
由图1-a看出,SOD粗酶液活性随着pH值的升高出现先升高后降低的趋势,在pH=7.4时,粗酶液具有最佳的活性,过高或过低pH造成部分酶失活。图1-b显示,浸提时间对SOD粗酶液活性无显著性影响。图1-c、1-d、1-e、1-f显示,SOD酶液活性均随着热变性温度、热变性时间、等电点沉淀pH值、丙酮沉淀处理的升高而呈现先升高后降低的趋势,分别在热变性温度60℃、热变性时间25min、等电点沉淀pH= 5.0、V丙酮∶VSOD酶液=1.0时,SOD酶液具有最佳活性。
综合以上数据,固定浸提缓冲溶液的pH值=7.4,浸提时间12 h(过夜浸提)、等电点沉淀pH=5.0 3个单因素水平,选取热变性温度、热变性时间、和丙酮沉淀处理3个因素,以酶活性为响应值进行响应曲面分析。
2.2 SOD提取工艺的响应曲面优化
2.2.1 回归模型的建立与方差分析
由Box-Behnken试验设计,在单因素试验基础上选取热变性温度、热变性时间和丙酮沉淀处理3个因素进行响应曲面分析,以SOD酶活性为响应值,试验结果见表2。

表2 Box-Behnken试验设计方案与结果Table2 Box-Behnken design and corresponding experimental results
每个组合重复试验3次,取其平均值作为SOD酶活性结果,采用minitab15软件分析试验结果。对表2试验结果进行多元回归拟合,得SOD酶活性对热变性温度(A)、热变性时间(B)和丙酮沉淀处理(C)的二次多项式回归模型:

对回归模型进行方差分析和系数显著性检验,结果如表3、表4所示。

表3 回归系数的显著性检验Table3 Significance testof regression coefficient
由回归模型方差分析的结果(表4)可以看出,模型具有极高显著性(P<0.01),失拟项检验P值不显著(P>0.05),表明模型不失拟;同时回归系数的显著性检验表明,该模型的相关系数r2=0.998 4(表3),说明该模型与实际试验拟合较好,自变量与响应值线性关系显著。意味着所建立的回归二次模型成立,可用此模型来分析和预测SOD酶活性提取工艺条件。从回归模型系数显著性检验结果可得知:热变性温度、热变性时间和丙酮沉淀处理的一次项、二次项的P值均小于0.01,说明对SOD酶活性的影响极显著;热变性温度、热变性时间的交互项P值小于0.01,说明对SOD酶活性影响极显著;热变性温度与丙酮沉淀处理以及热变性时间与丙酮沉淀处理的交互项P值均>0.05,对SOD酶活性影响不显著。

表4 回归模型的方差分析Table4 Variance Analysisof regressionm odel
2.2.2 模型双因素交互作用分析
由方差分析可知,热变性温度、热变性时间的交互作用对SOD酶活性有显著的影响,用minitab15软件根据相应绘制二者的等值线图及响应曲面图,如图2所示。
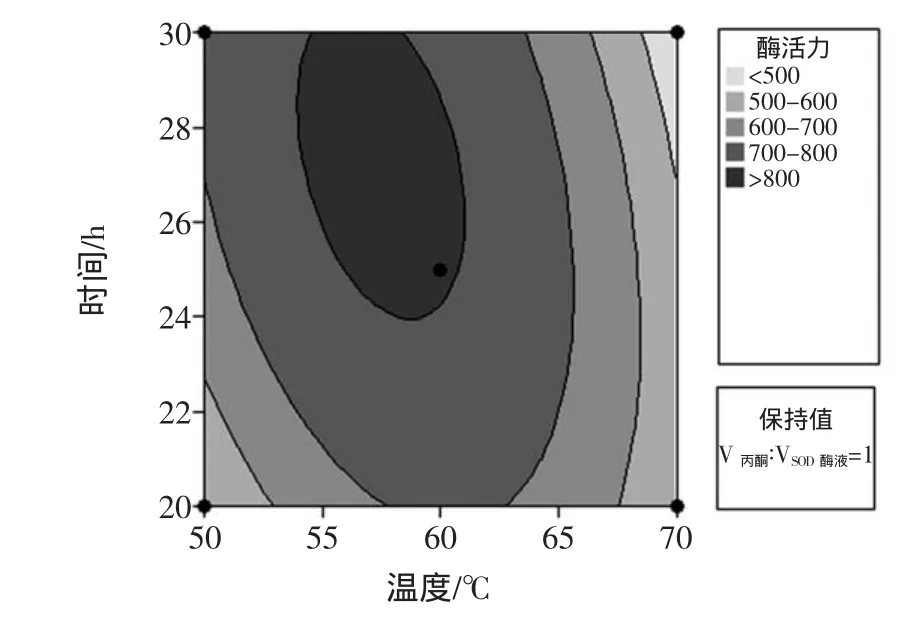

图2 因素交互作用的等值线图及响应曲面图Fig.2 Contour plotsand response surfacep lotsof the interaction of factors
由表3的P值和图2中响应曲面图可知,热变性温度、热变性时间的交互作用为显著水平(P<0.01)。当热变性温度一定时,随着热变性温度的升高,SOD酶活性呈现先升高后降低趋势。这可能是由于热变性促使杂蛋白的沉淀需要一定的时间,随着热变性时间的增加,杂蛋白逐渐沉淀,但是当热变性的时间继续延长,热变性的高温同样会促使部分SOD失去活性,最终造成酶活性降低。由图2中等值线图可以看出,固定V丙酮∶VSOD酶液=1,当热变性温度在60℃左右,热变性时间在25min时,SOD具有较高的酶活性。
2.2.3 验证试验
采用minitab15响应优化器进行分析,得出SOD最优工艺参数为热变性温度57.5℃、热变性时间27min、V丙酮∶VSOD酶液=0.93(如图3所示)。

图3 SOD提取最佳工艺参数Fig.3 Optimalp rocessparam eters for SOD extraction
按照上述最优工艺参数,重复5次试验,结果SOD酶活性为(835±25)U/mL,与理论值824相对偏差1.33%,验证了响应面设计的准确性。
3 结论
本研究以猕猴桃为主要原料,在单因素试验的基础上,采用Box-Behnken响应曲面设计对SOD提取工艺中的热变性温度、热变性时间、丙酮沉淀处理3个因素进行优化,最终得到的最佳SOD提取工艺参数为热变性温度57.5℃、热变性时间27min、V丙酮∶VSOD酶液=
0.93,此条件下所得到的SOD酶活性为(835±25)U/mL。
本研究所用所用仪器设备均为实验室常规仪器设备,所用试剂实验室常规试剂,价格低廉、化学危害性很小。另外本研究所采用的的工艺流程简单、易于操作,因此该试验所确定的提取路线不失为一条较为廉价的提取纯化SOD的工艺路线,值得推广。
[1] 李珺,马力通,高书良.番茄中超氧化物歧化酶提取工艺的优化[J].安徽农业科学,2012,40(7):3997-3998
[2]金绍黑.植物超氧化物歧化酶的提取、修饰制备工艺及其应用研究[J].成都航空职业技术学院学报,2005,21(1):44
[3]魏瑞锋,魏桃英.猕猴桃中SOD提取工艺研究[J].安徽农业科学, 2013,41(32):12716-12717,12757
[4]LIY L,ZHANG Y.Determination of SOD activity bymeans of pyogallolautoxidationmethod[J].Chinese Lab Tech,2000,10:673
[5]朱广廉,钟诲文,张爱琴.植物生理学实验[M].北京:北京大学出版社,1990:242
[6]张宏,谭行钧.四种邻苯三酚自氧化法测定超氧化物歧化酶活性方法的比较[J].内蒙古大学学报(自然科学版),2002,33(6):677-681
[7]热孜耶·喀日,米丽班·霍家艾合买提,热合满·艾拉,等.响应面法优化马血中SOD超声波提取工艺研究[J].食品工业科技,2012, 33(2):249-251
[8]王燕华,武福华,郭昭涵,等.响应面试验优化丹参中多糖的超声波提取工艺及其抗氧化活性[J].食品科学,2015,36(18):7-12
Optim ization of the Extraction Process of Superoxide Dismutase(SOD)from K iw iby Response Surface Experiment
LIUHai-ying
(Departmentof Food Engineering,InnerMongolia Businessand VocationalCollege,Hohhot010070,InnerMongolia,China)
Optimization ofkiwifruitsuperoxide dismutase(SOD)extraction process,to further develop the SOD enzyme source plant.Selection ofkiwi fruitas rawmaterial,based on single factor test,the application of Box-Behnken response surface design,the thermal denaturation temperature,thermal denaturation time,acetone precipitation as test factors,with SOD activityas the response variable,analyzeand optimize theextraction processofSOD.The optimum extraction processparametersofSODwereestablished in the experiment.The parametersofwere heatdenaturation temperature 57.5℃,heatdenaturation time 27min,Vacetone∶VSODenzymeliquid=0.93. Under thiscondition,theactivityofSODwas(835±25)U/mL.
superoxide dismutase;response surface design;extraction technology
10.3969/j.issn.1005-6521.2016.23.028
2016-07-19
刘海英(1981—),女(汉),讲师,硕士,研究方向:食品加工技术。
