内质网应激介导的凋亡在PBDE-47致大鼠海马损伤中的作用
2016-12-12马儒林张舜李蓓杨露张潇汪超李佩夏涛王爱国
马儒林,张舜,李蓓,杨露,张潇,汪超,李佩,夏涛,王爱国,*
1. 华中科技大学同济医学院公共卫生学院劳动卫生与环境卫生学系,武汉 430030 2. 环境与健康教育部重点实验室 省部共建国家重点实验室培育基地--湖北省环境卫生学重点实验室 国家环境保护环境与健康重点实验室(武汉),武汉 430030 3.石河子大学医学院预防医学系,石河子 832000
内质网应激介导的凋亡在PBDE-47致大鼠海马损伤中的作用
马儒林1,2,3,张舜1,2,李蓓1,2,杨露1,2,张潇1,2,汪超1,2,李佩1,2,夏涛1,2,王爱国1,2,*
1. 华中科技大学同济医学院公共卫生学院劳动卫生与环境卫生学系,武汉 430030 2. 环境与健康教育部重点实验室 省部共建国家重点实验室培育基地--湖北省环境卫生学重点实验室 国家环境保护环境与健康重点实验室(武汉),武汉 430030 3.石河子大学医学院预防医学系,石河子 832000
为了明确内质网应激(endoplasmic reticulum stress, ERS)介导的凋亡在2,2’,4,4’-四溴联苯醚(2,2’,4,4’-tetrabromodiphenylether, PBDE-47)致大鼠神经毒性中的作用,在脑发育的突增期(出生第10天),分别用0 mg·kg-1、1 mg·kg-1、5 mg·kg-1和10 mg·kg-1PBDE-47进行单次灌胃染毒,并从出生第8天开始每天给予150 mg·kg-1ERS抑制剂4-苯基丁酸(phenylbutyric acid, PBA),持续3周。仔鼠出生第8周末,从对照组、10 mg·kg-1PBDE-47处理组、150 mg·kg-1PBA处理组和150 mg·kg-1PBA+10 mg·kg-1PBDE处理组中随机选取8只大鼠进行水迷宫实验。然后将所有动物断头处死,分离大鼠海马组织,观察其海马组织形态学改变、测定ERS标志分子(GRP78、IRE1和CHOP)和凋亡相关蛋白Cyt c的表达水平。结果显示,10 mg·kg-1PBDE-47处理可导致雌性大鼠海马CA4区细胞排列紊乱、锥形神经细胞数量减少甚至消失,尼氏小体数量减少,大鼠逃避潜伏期延长(P < 0.05)。5和10 mg·kg-1PBDE-47处理可显著上调ERS相关蛋白IRE1和CHOP的表达水平(P < 0.05),并明显增强海马组织凋亡相关蛋白Cyt c的表达。PBA干预可明显降低PBDE-47诱导的IRE1和CHOP以及Cyt c蛋白的表达水平,提示PBDE-47可通过ERS介导凋亡,导致大鼠海马组织损伤,从而影响大鼠学习记忆功能。
2,2’,4,4’-四溴联苯醚;雌性SD大鼠;神经毒性;海马损伤;水迷宫实验;内质网应激;凋亡
Received 30 November 2015 accepted 5 April 2016
2,2’,4,4’-四溴联苯醚(2,2’,4,4’-tetrabromodiphenylether, PBDE-47)是溴代阻燃剂多溴联苯醚(polybrominated diphenyl ethers, PBDEs)在环境介质中最常见、毒性最强的同系物之一[1],目前在土壤、空气及人体脂肪、血清、乳汁和胎盘组织等环境介质中均检测到其存在[2]。PBDE-47进入机体后对其靶部位如甲状腺、脂肪组织、神经系统、生殖系统等均可产生损害[3]。已有研究证实在大脑发育突增期PBDE-47暴露可导致大鼠和小鼠神经系统发育受损,表现为成年后学习记忆能力下降、自主活动增多等[4],但其机制尚未完全阐明。
包括氧化应激在内的多种刺激均可造成内质网稳态紊乱,从而导致未折叠蛋白/错误折叠蛋白在内质网积聚,引起内质网应激(endoplasmic reticulum stress, ERS),但机体可通过未折叠蛋白反应(unfolded protein response, UPR)防御ERS的有害作用。然而,当ERS持续时间过长或UPR适应功能不足,严重或慢性的UPR活化会导致细胞凋亡[5]。本实验室前期实验结果发现,PBDE-47可诱导原代培养的大鼠海马神经元和人神经母细胞瘤细胞SH-SY5Y凋亡水平升高[6-7],而且PBDE-47可以激活SH-SY5Y细胞发生UPR[8]。基于前期实验结果,我们选择在大脑发育突增期(出生第10天)对大鼠进行一次性PBDE-47灌胃染毒,构建PBDE-47发育期暴露的大鼠模型[1]并用ERS抑制剂4-苯基丁酸(phenylbutyric acid, PBA)进行干预[9],观察PBDE-47对大鼠神经系统的毒性作用及其对海马组织细胞凋亡相关蛋白Cyt c和ERS标志分子(GRP78、IRE1和CHOP)表达水平的影响,以期探讨内质网应激在PBDEs发育神经毒性中的作用,为PBDEs发育神经毒性机制研究提供依据。
1 材料与方法(Materials and methods)
1.1 主要试剂
PBDE-47应用液配制:称取PBDE-47(纯度100%,美国Accustandard公司)40 mg,溶解于20 mL玉米油,室温下,超声处理30 min,配制成母液,4 ℃保存备用。临用时,用玉米油稀释到设定浓度,按10 μL·g-1灌胃。
PBA应用液配制:将3 g PBA(美国Sigma公司)溶于1 L生理盐水中,40 ℃水浴溶解,配制成终浓度3 mg·mL-1的应用液,4 ℃储存备用。临用时,按25 μL·g-1腹腔注射,每天2次,注射终剂量是150 mg·kg-1。
1.2 动物分组及处理
220~270 g成年清洁级Sprague-Dewley(SD)大鼠(雌性20只,雄性10只),由华中科技大学同济医学院动物中心提供(许可证号SCXK(鄂)2010-0009)。适应性喂养1周后,按雄雌1:2合笼。仔鼠出生当天记为第0天,仔鼠出生第5天,将雌性大鼠随机分为6组:对照组、1 mg·kg-1PBDE-47处理组、5 mg·kg-1PBDE-47处理组、10 mg·kg-1PBDE-47处理组、150 mg·kg-1PBA处理组和150 mg·kg-1PBA+10 mg·kg-1PBDE-47处理组,每组10只。在仔鼠出生第8天给予150 mg·kg-1PBA处理组和150 mg·kg-1PBA+10 mg·kg-1PBDE-47处理组大鼠150 mg·kg-1PBA腹腔注射,持续3周。在出生第10天,各处理组通过腹腔注射方法分别给予相应剂量的PBDE-47进行一次性染毒,仔鼠隔天称重一次。
1.3 水迷宫实验
仔鼠出生第8周,从对照组、10 mg·kg-1PBDE-47处理组、150 mg·kg-1PBA处理组和150 mg·kg-1PBA+10 mg·kg-1PBDE-47处理组中每组随机选取8只大鼠进行水迷宫实验,前4天进行定位航行实验,记录大鼠寻找平台的潜伏期和游泳路径以评价其空间认知功能。第5天将平台撤除进行空间探索实验,以平台所在象限时间和游泳路径占总时间和总路径的比值评价大鼠的空间记忆能力。
1.4 标本采集及处理
仔鼠出生第8周末颈椎脱臼处死,分离脑组织,每组取3只大鼠的大脑组织,用4%多聚甲醛固定24 h后常规石蜡包埋用于形态学观察;余下的大脑组织分离海马组织经液氮处理后-80 ℃保存,用于蛋白提取。
1.5 海马组织形态学观察
将固定于多聚甲醛的大脑组织取出,常规切片后,经HE染色后于光学显微镜下观察海马组织形态。1.6 IRE1、GRP78、CHOP及Cyt c蛋白表达水平测定
提取海马组织蛋白并测定浓度;每孔加入80 μg总蛋白进行电泳,转膜封闭后加入IRE1抗体(英国Abcam公司,1:800)、GRP78抗体(美国Proteintech公司,1:500)、CHOP(美国Santa Cruz公司,1:300)及Cyt c抗体(美国Proteintech公司,1:1000),4 ℃孵育过夜,洗脱缓冲液漂洗后,加入辣根过氧化物酶标记的羊抗兔或羊抗鼠Ig G(美国Pierce公司),室温孵育1 h,使用发光试剂进行显色,采用Quantity One软件(美国Bio-Rad公司)分析目的蛋白条带,以GAPDH作为内参。
1.7 统计分析
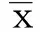
2 结果(Results)
2.1 PBDE-47暴露可致SD大鼠青春期体重增长加快
各组动物出生后增重速度呈加快趋势,40 d前后到达峰值,随后增重速度开始下降。如表1所示,在增重最快的第40天,10 mg·kg-1PBDE-47组大鼠增重较对照组快,并持续到出生后60 d,而150 mg·kg-1PBA+10 mg·kg-1PBDE组大鼠从出生后第50天开始,增重较对照组快,提示一定剂量的PBDE-47暴露可导致SD大鼠青春期体重增长加快。
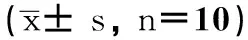
表1 PBDE-47暴露和4-苯基丁酸(PBA)干预对大鼠不同时间点增重的影响
注:与Control比较,*P < 0.05;与10 mg·kg-1PBDE处理组比较,#P < 0.05。
Note: Compared with Control,*P < 0.05; Compared with 10 mg·kg-1PBDE group,#P < 0.05.
2.2 PBA干预可拮抗PBDE-47暴露导致的SD大鼠学习和记忆能力损伤
如表2所示,10 mg·kg-1PBDE-47处理会延长定位航行实验时大鼠找到平台的平均潜伏期和平均路径,而150 mg·kg-1PBA干预可拮抗PBDE-47对平均潜伏期和平均路径的延长。如表3所示,在空间探索实验中,虽然各组动物之间在平台所在象限的活动时间和路径百分比的差别均无统计学意义,但是10 mg·kg-1PBDE-47处理组大鼠在中心区域活动的时间和路径百分比较对照组低(P<0.05),而150 mg·kg-1PBA处理组大鼠在中心区域的活动时间和路径百分比较对照组高(P<0.05),150 mg·kg-1PBA+10 mg·kg-1PBDE处理组大鼠在中心区域的活动时间和路径百分比较10 mg·kg-1PBDE处理组高,提示PBA干预可改善PBDE-47染毒所致大鼠长时程记忆损伤。
2.3 PBA干预可改善PBDE-47对SD大鼠海马组织形态结构的损伤
HE染色结果显示,对照组大鼠海马组织齿状回和CA3区细胞排列紧密,有大量核染色较深的神经胶质细胞,10 mg·kg-1PBDE-47处理可导致海马组织齿状回和CA3区神经细胞排列散乱,锥形神经细胞数量减少甚至消失。与10 mg·kg-1PBDE-47 处理组相比,150 mg·kg-1PBA+10 mg·kg-1PBDE处理组大鼠海马组织齿状回和CA3区神经细胞排列较紧密且锥形神经细胞数量增多(图1)。
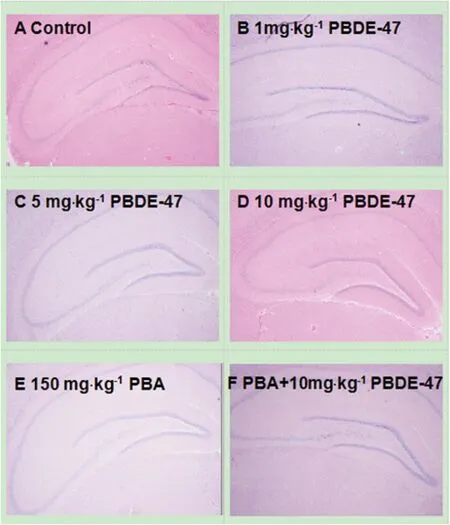
图1 PBDE-47处理与PBA干预对SD大鼠海马结构的影响(HE染色 ×40)Fig. 1 Effects of PBDE-47 and PBA on morphological structure of hippocampus of SD rats (HE×40)

表2 PBDE-47及PBA处理对水迷宫定位航行实验的影响
注:与对照组比较,*P < 0.05;与10 mg·kg-1PBDE处理组比较,#P < 0.05。
Note: Compared with Control,*P < 0.05; Compared with 10 mg·kg-1PBDE group,#P < 0.05.

表3 PBDE-47及PBA处理对水迷宫空间探索实验的影响
注:与对照组比较,*P < 0.05;与10 mg·kg-1PBDE处理组比较,#P < 0.05。
Note: Compared with Control,*P < 0.05; Compared with 10 mg·kg-1PBDE group,#P < 0.05.
2.4 PBDE-47暴露和PBA干预对海马组织内质网应激相关蛋白表达的影响
如图2所示,与对照组相比,10 mg·kg-1PBDE-47处理组大鼠海马组织中IRE1、GRP78和CHOP等ERS相关蛋白的表达水平升高,而1和5 mg·kg-1PBDE-47处理的大鼠海马组织中,仅CHOP蛋白表达水平升高,表明一定剂量的PBDE-47可诱导海马组织发生内质网应激,导致UPR的过度激活。PBA干预后,IRE1、GRP78和CHOP蛋白的表达水平相对于10 mg·kg-1PBDE-47处理组显著下降(P< 0.05),表明PBA可拮抗PBDE-47所导致的内质网应激。
2.5 PBDE-47暴露和PBA干预对海马组织凋亡相关蛋白Cyt c表达的影响
如图3所示,与对照组相比,5 mg·kg-1PBDE-47处理组、10 mg·kg-1PBDE-47处理组和150 mg·kg-1PBA+10 mg·kg-1PBDE-47处理组Cyt c表达水平升高(P < 0.05),提示细胞凋亡水平升高,而1 mg·kg-1PBDE-47处理组和150 mg·kg-1PBA组Cyt c蛋白表达水平差别无统计学意义。相较于10 mg·kg-1PBDE-47处理组,150 mg·kg-1PBA+10 mg·kg-1PBDE-47处理组海马Cyt c蛋白表达水平降低(P< 0.05),提示PBA干预可拮抗PBDE-47所致大鼠海马组织凋亡水平的升高。
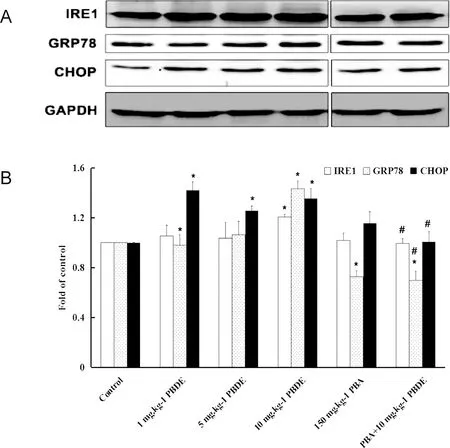
图2 PBDE-47处理与PBA干预对SD大鼠海马内质网应激相关蛋白表达水平的影响 注:A,IRE1、GRP78和CHOP蛋白条带;B,IRE1、GRP78和CHOP蛋白表达统计条图;与对照组比较,* P < 0.05;与10 mg·kg-1 PBDE-47处理组比较,# P < 0.05。Fig. 2 Effects of PBDE-47 and PBA on the expression levels of ERS related protein in hippocampus of SD ratsNote: A, protein bands of IRE1, GRP78 and CHOP; B, Straight bar chart of IRE1, GRP78 and CHOP expression level; Compared with Control, *P < 0.05; compared with 10 mg·kg-1 PBDE-47, # P < 0.05.

图3 PBDE-47处理和PBA干预对海马凋亡相关蛋白Cyt c表达水平的影响 注:A,Cyt c蛋白条带;B,Cyt c蛋白表达统计条图;与对照组比较, P < 0.05;与10 mg·kg-1 PBDE-47处理组比较,# P < 0.05。Fig. 3 Effects of PBDE-47 and PBA on the expression levels of Cyt c in hippocampus of SD rats Note: A, protein bands of Cyt c; B, Straight bar chart of Cytc expression level; Compared with Control, *P < 0.05; compared with 10 mg·kg-1 PBDE-47, # P < 0.05.
3 讨论(Discussion)
潜伏期是Morris水迷宫实验一个很重要的参照指标,可以反映动物空间学习记忆能力的好坏。潜伏期短,预示着动物的学习记忆能力好,但是潜伏期和动物自身的游泳速度有关,因此,潜伏期并不能作为判断动物记忆力好坏的最终指标,还需要结合诸如游泳速度、上台前路程等指标进行综合评价。啮齿类动物游泳有绕边性,而平台是靠近水池中心的,如果动物在水池中心区域内活动时间和路程长,反映其空间记忆能力好,反之,则反映其空间记忆能力差。本实验的水迷宫结果显示,通过训练,对照组、150 mg·kg-1PBA处理组和150 mg·kg-1PBA+10 mg·kg-1PBDE-47处理组大鼠平均潜伏期迅速下降而10 mg·kg-1PBDE-47处理组大鼠平均潜伏期变化不大。在正式实验时,10 mg·kg-1PBDE-47处理组大鼠平均潜伏期大于对照组大鼠,而游泳速度与对照组大鼠无差异,并且在中心区域的活动时间构成比和活动路径构成比均较对照组大鼠低,表明10 mg·kg-1PBDE-47处理可损害大鼠空间学习记忆能力,该结果与多个实验室的研究结果一致[1, 3],也与人群流行病学研究中PBDE-47导致儿童智力发育障碍[10]的结果相吻合。使用PBA干预后,10 mg·kg-1PBDE-47处理组大鼠平均潜伏期和平均路径以及中心区域活动时间占比等与对照比相比无明显差别,表明PBA干预可减轻PBDE-47染毒对大鼠空间学习记忆能力的损伤。
随着对海马功能认识的不断深入,人们发现海马齿状回和CA1区和CA3区一样,对形成与学习和记忆及空间信息编码有关的长时程增强(long term potentiation, LTP)发挥重要的作用[11]。本研究发现,在大鼠出生后60 d,对照组大鼠海马组织神经细胞排列紧密,齿状回和CA3区有大量核染色较深的锥形神经细胞,神经元内尼氏小体较为丰富且染色较深,随着PBDE-47染毒剂量的增加,海马组织齿状回和CA3区神经细胞排列散乱,齿状回和CA3区染色较深的胶质细胞数量减少甚至消失,神经元内尼氏小体数量减少,且染色较浅,表明神经元蛋白合成能力下降。而150 mg·kg-1PBA+10 mg·kg-1PBDE-47处理组大鼠海马组织神经细胞排列较10 mg·kg-1PBDE-47处理组大鼠整齐,且齿状回和CA3区胶质细胞数量更多。这些结果表明,PBDE-47导致的学习记忆能力下降与其引起的脑内认知相关区域损伤密切相关,PBA干预可改善PBDE-47染毒所致的海马组织形态结构及功能异常。
PBA通过稳定肽键结构,提高内质网腔内蛋白质的折叠和转运能力而增强内质网适应能力[11]。在内质网应激状态下,PBA可以下调GRP78、IRE1和CHOP的表达,抑制内质网应激并上调抗凋亡因子Bcl-2表达从而降低凋亡水平[12]。活化后的IRE1可促进GRP78等内质网伴侣的转录,从而提高内质网的蛋白折叠能力,也可激活凋亡信号调节激酶1(apoptosis signal-regulating kinase 1, ASK1)进而活化c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)诱导凋亡的发生[13];IRE1还可激活CHOP的表达,在ERS状态下,CHOP可下调抗凋亡因子Bcl-2的表达,使胞浆中的Beclin-1从Bcl-2-Beclin-1复合物中解离而启动自噬,促进错误折叠蛋白的降解,保护细胞度过应激状态[14-15]。CHOP也可通过诱导BAX、p53正向细胞凋亡调节因子(p53 upregulated modulator of apoptosis, PUMA)等促凋亡因子导致细胞凋亡的发生[16],在本研究中,不同染毒剂量的PBDE-47均导致大鼠海马CHOP的表达上调,提示PBDE-47染毒可导致海马组织发生内质网应激并激活UPR通路导致CHOP的表达增加,10 mg·kg-1PBDE-47处理导致大鼠海马IRE1和GRP78蛋白表达升高,且凋亡相关蛋白Cyt c蛋白表达水平升高,表明随着PBDE-47染毒剂量的增加,海马组织神经细胞内质网应激程度逐渐加重,导致凋亡水平升高,该结果与海马组织形态学检测结果以及水迷宫实验结果相吻合。
综上所述,结合大鼠神经行为、海马组织形态学以及凋亡水平和ERS标志分子的实验结果,我们认为过度内质网应激导致的凋亡参与了PBDE-47致大鼠发育神经毒性,PBA干预可降低PBDE-47导致的大鼠海马组织病理及其功能分子表达的异常改变而保护大鼠海马神经细胞。
致谢:本项目由国家自然科学基金项目(No.81273021,81430076)资助。
[1] He P, Wang A, Niu Q, et al. Toxic effect of PBDE-47 on thyroid development, learning, and memory, and the interaction between PBDE-47 and PCB153 that enhances toxicity in rats [J]. Toxicology and Industrial Health, 2011, 27(3): 279-288
[2] Dingemans M M, van den Berg M, Westerink R H. Neurotoxicity of brominated flame retardants: (In)Direct effects of parent and hydroxylated polybrominated diphenyl ethers on the (developing) nervous system [J]. Environmental Health Perspectives, 2011, 119(7): 900-907
[3] Eriksson P, Jakobsson E, Fredriksson A. Brominated flame retardants: A novel class of developmental neurotoxicants in our environment?[J]. Environmental Health Perspectives, 2001, 109(9): 903-908
[4] Shy C G, Huang H L, Chang-Chien G P, et al. Neurodevelopment of infants with prenatal exposure to polybrominated diphenyl ethers [J]. Bulletin of Environmental Contamination and Toxicology, 2011, 87(6): 643-648
[5] Schroder M, Kaufman R J. ER stress and the unfolded protein response [J]. Mutation Research, 2005, 569(1-2): 29-63
[6] He P, He W, Wang A, et al. PBDE-47-induced oxidative stress, DNA damage and apoptosis in primary cultured rat hippocampal neurons [J]. Neurotoxicology, 2008, 29(1): 124-129
[7] He P, Wang A G, Xia T, et al. Mechanism of the neurotoxic effect of PBDE-47 and interaction of PBDE-47 and PCB153 in enhancing toxicity in SH-SY5Y cells [J]. Neurotoxicology, 2009, 30(1): 10-15
[8] Jiang C, Zhang S, Liu H, et al. The role of the IRE1 pathway in PBDE-47-induced toxicity in human neuroblastoma SH-SY5Y cells in vitro [J]. Toxicology Letters, 2012, 211(3): 325-333
[9] Ayala P, Montenegro J, Vivar R, et al. Attenuation of endoplasmic reticulum stress using the chemical chaperone 4-phenylbutyric acid prevents cardiac fibrosis induced by isoproterenol [J]. Experimental and Molecular Pathology, 2012, 92(1): 97-104
[10] Roze E, Meijer L, Bakker A, et al. Prenatal exposure to organohalogens, including brominated flame retardants, influences motor, cognitive, and behavioral performance at school age [J]. Environmental Health Perspectives, 2009, 117(12): 1953-1958
[11] Fa M, Xia L, Anunu R, et al. Stress modulation of hippocampal activity--Spotlight on the dentate gyrus [J]. Neurobiology of Learning and Memory, 2014, 112: 53-60
[12] Kim D S, Li B, Rhew K Y, et al. The regulatory mechanism of 4-phenylbutyric acid against ER stress-induced autophagy in human gingival fibroblasts [J]. Archives of Pharmacal Research, 2012, 35(7): 1269-1278
[13] Chakrabarti A, Chen A W, Varner J D. A review of the mammalian unfolded protein response [J]. Biotechnology and Bioengineering, 2011, 108(12): 2777-2793
[14] Yan F, Li J, Chen J, et al. Endoplasmic reticulum stress is associated with neuroprotection against apoptosis via autophagy activation in a rat model of subarachnoid hemorrhage [J]. Neuroscience Letters, 2014, 563: 160-165
[15] Wang Z Y, Lin J H, Muharram A, et al. Beclin-1-mediated autophagy protects spinal cord neurons against mechanical injury-induced apoptosis [J]. Apoptosis, 2014, 19(6): 933-945
[16] Cazanave S C, Elmi N A, Akazawa Y, et al. CHOP and AP-1 cooperatively mediate PUMA expression during lipoapoptosis [J]. American Journal of Physiology. Gastrointestinal and Liver Physiology, 2010, 299(1): G236-G243
◆
Roles of Endoplasmic Reticulum Stress Mediated Apoptosis in SD Rat’s Hippocampus Injure Induced by PBDE-47
Ma Rulin1,2,3, Zhang Shun1,2, Li Bei1,2, Yang Lu1,2, Zhang Xiao1,2, Wang Chao1,2, Li Pei1,2, Xia Tao1,2, Wang Aiguo1,2,*
1. Department of Occupational and Environmental Health, School of Public Health, Tongji Medical College, Huazhong University of Science & Technology, Wuhan 430030, China 2. MOE (Ministry of Education) Key Lab of Environment and Health; State Key Laboratory of Environment Health (Incubation); Key Laboratory of Environment and Health (Wuhan) of Ministry of Environmental Protection, Wuhan 430030, China 3. Department of Preventive Medical, Medical College, Shihezi University, Shihezi 832000, China
To investigate the roles of endoplasmic reticulum stress mediated apoptosis in neurotoxicity of SD rats induced by 2,2’,4,4’-tetrabromodiphenylether (PBDE-47), 60 neonatal female Sprague-Dawley rats were randomly divided into 6 groups, and 2 groups of them were injected by intraperitoneal two times a day to give 4-phenylbutyric acid (PBA), an inhibitor of endoplasmic reticulum stress, for a total dose of 150 mg·kg-1continued for 3 weeks from the eighth day after birth. At the tenth day, they were administered with 0 and 10 mg·kg-1PBDE-47 in single gavage respectively. Similarly, animals in the other 4 groups received 0 mg·kg-1, 1 mg·kg-1, 5 mg·kg-1and 10 mg·kg-1PBDE-47 respectively. At the eighth weekend, 8 rats in Control, 10 mg·kg-1PBDE-47 group, 150 mg·kg-1PBA group, and 150 mg·kg-1PBA+ 10 mg·kg-1PBDE-47 group were administrated Morris water maze experiment to test their spatial learning and memory ability. Then all animals were sacrificed and hippocampus were isolated. HE staining was observed in hippocampus, the apoptosis levels and ERS markers (GRP78, IRE1 and CHOP) expression levels in hippocampus were observed with Western blooting. The results of Morris water maze experiment showed that 10 mg·kg-1PBDE-47 damaged the learning and memory ability, and the PBDE-47 exposed group needed more time and longer distance to find the platform (P<0.05). Histology detection found that PBDE-47 caused the disordered arrangement of the cells in hippocampal CA3 region, the decrease and even disappearing of deeply stained conical neurons and the reduction of Nissl body. The protein expression levels of Cyt c, IRE1 and CHOP were significantly increased in the 5 and 10 mg·kg-1PBDE-47 groups as compared to control. Moreover, PBA ameliorated the increase expression of ERS relative proteins, and the level of cell apoptosis were decreased evidently. Collectively, these results approve that PBDE-47 could damage the hippocampal neuron and disturb the learning and memory ability through the endoplasmic reticulum mediated apoptosis.
PBDE-47; female SD rat; neurotoxicity; hippocampus injure; water maze experiment; endoplasmic reticulum stress; apoptosis
10.7524/AJE.1673.5897.20151130021
国家自然科学基金项目(81430076,81273021)
马儒林(1978-),男,博士研究生,讲师,研究方向为环境毒理学,Email:marulin@126.com;
*通讯作者(Corresponding author), E-mail: wangaiguo@mails.tjmu.edu.cn
2015-11-30 录用日期:2016-04-05
1673-5897(2016)2-387-07
X171.5
A
简介:王爱国(1963—),男,医学博士,教授,主要研究方向为环境毒理学,发表学术论文80余篇。
马儒林, 张舜, 李蓓, 等. 内质网应激介导的凋亡在PBDE-47致大鼠海马损伤中的作用[J]. 生态毒理学报,2016, 11(2): 387-393
Ma R L, Zhang S, Li B, et al. Roles of endoplasmic reticulum stress mediated apoptosis in SD rat’s hippocampus injure induced by PBDE-47 [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 387-393 (in Chinese)
