海参蒸煮废液多糖提取优化研究*
2016-12-12张朝晖耿元生姜玉宝
衣 丹, 李 梅,张朝晖,耿元生, 姜玉宝
(1. 国家海洋局 第一海洋研究所, 山东 青岛 266061; 2. 江苏大学, 江苏 镇江 212013;3. 青岛佳日隆海洋食品有限公司,山东 青岛266700 )
海参蒸煮废液多糖提取优化研究*
衣 丹1, 李 梅2,张朝晖1,耿元生3, 姜玉宝3
(1. 国家海洋局 第一海洋研究所, 山东 青岛 266061; 2. 江苏大学, 江苏 镇江 212013;3. 青岛佳日隆海洋食品有限公司,山东 青岛266700 )
从海参蒸煮废液有效利用出发,采用胃蛋白酶提取废液中海参多糖。在单因素实验基础上,选择酶解pH、酶解温度、酶用量为自变量,酶解后多糖质量浓度为响应值,利用Box-Benhnken中心组合实验及响应面分析法,研究各自变量交互作用对多糖提取的影响。确定最佳提取工艺条件为:酶解pH=1.50、酶解温度47.00 ℃、酶用量2.00%,在此条件下提取海参多糖质量浓度为2.31 g/L。经体积分数为50%的乙醇沉淀后回收海参多糖,总回收率为39.5%。
海参;蒸煮废液;酶解;多糖;响应面分析
海参属于棘皮动物门海参纲,具有较高的经济价值、营养价值和药用价值,近年来海参产量大大增加,随之而来的是海参加工业的繁盛。在海参加工蒸煮步骤中会产生大量的废液,而此废液中存在可观的多糖等营养成分。海参多糖是海参重要的活性成分之一,具有抗凝血、抗肿瘤、免疫调节等多种活性[1-3]。目前鲜有从海参蒸煮废液回收多糖详细工艺的研究。本实验选取胃蛋白酶进行酶解,通过单因素实验,并采用响应面分析方法以多糖质量浓度为响应优化值分析得到酶解工艺最优条件,为蒸煮废液海参多糖的提取、纯化及其他相关研究提供基础。与从海参中寻找生物活性物质,以及加工功能性食品和开发新药相比,建立海参蒸煮废液活性物质回收方法是经济有效的。山东省是我国海参的主要生产区,从蒸煮废液回收多糖对提高海参加工企业的经济效益、减少污染物排放具有重要意义。
1 实验材料和方法
1.1 实验材料与仪器
青岛佳日隆海洋食品有限公司提供海参蒸煮废液。Amresco 0685胃蛋白酶(1∶3 000),0458胰蛋白酶(1∶250)。Sigma木瓜蛋白酶,D-葡萄糖,岩藻聚糖硫酸酯,D-葡萄糖醛酸,D-氨基葡萄糖。苯酚,考马斯亮蓝G-250,次甲基蓝,咔唑,盐酸,硫酸,硝酸,氢氧化钠溶液,活性炭,过氧化氢,明胶,氯化钡,硫酸钾等均为分析纯。
实验仪器包括:GSY-Ⅱ型不锈钢电热恒温水浴锅,北京医疗设备厂;HS1002型电子天平,余姚华胜天平有限公司;HJ-2A型双头磁力加热搅拌器,常州国华电器有限公司;V-5000 型分光光度计,上海元析仪器有限公司;PSH-25型酸度计,上海仪电科学仪器股份有限公司;GR22GⅡ型离心机,日立工机株式会社。
1.2 实验方法
1.2.1 最适蛋白酶筛选和多糖提取实验流程
取适量过滤后海参蒸煮废液于烧杯中搅拌均匀,调节pH值,将烧杯置于磁力加热搅拌器上,调节到适合的温度后,将称取好的蛋白酶倒进蒸煮废液之中,酶解一段时间后终止反应,静置、过滤得多糖滤液(最适蛋白酶筛选步骤相同)。滤液加入体积分数为95%乙醇并充分摇匀,4 ℃静置过夜后离心得海参多糖。
1.2.2 多糖提取的单因素实验
考察酶用量(0.80%,1.00%,1.20%,1.50%,1.80%,2.00%,2.50%),酶解pH值(0.70,0.80,1.20,1.50,1.80,2.00),酶解温度(35.00,37.50,40.00,42.50,45.00,47.50,50.00,52.50,57.50,65.00 ℃),酶解时间(1,2,3,4,5,6,7,8 h)四个因素对海参多糖提取的影响。
1.2.3 响应面法优化多糖提取工艺[4-5]
依据多糖提取单因素实验结果,根据Box-Benhnken中心组合实验设计原理和Design-Ewpert 8.0.5软件,采用三因素三水平响应面分析法,多糖质量浓度为响应值,各条件的影响因子通过回归分析确定,作图分析后优化最佳提取条件。
1.2.4 多糖质量浓度测定及多糖得率的计算
多糖质量浓度采用苯酚硫酸法测定[6];岩藻聚糖质量浓度采用次甲基蓝比色法测定[7];硫酸基质量浓度采用明胶BaC12法测定[8];糖醛酸采用9-氮杂芴比色法(咔唑比色法)测定[9];氨基糖质量浓度采用Elson-Morgan 法测定[10]。
多糖得率的计算公式如下:
多糖得率(%)=多糖回收量/(多糖质量浓度×溶液体积)×100%,
(1)
式中,多糖回收量单位为g;多糖质量浓度单位为g/mL;溶液体积单位为mL。
2 结果与分析
2.1 蛋白酶种类对海参多糖提取的影响
取相同量的海参蒸煮废液,考察不同蛋白酶的酶解效果,进行最适蛋白酶筛选,蛋白酶用量依据相关海参多糖提取实验。结果由表1可见,海参蒸煮废液经胃蛋白酶、木瓜蛋白酶、胰蛋白酶酶解后,以胃蛋白酶的酶解效果最佳,酶解后多糖质量浓度达1.82 g/L。这与徐逯等[11]的实验结果相近,所以选取胃蛋白酶进行酶解条件优化。
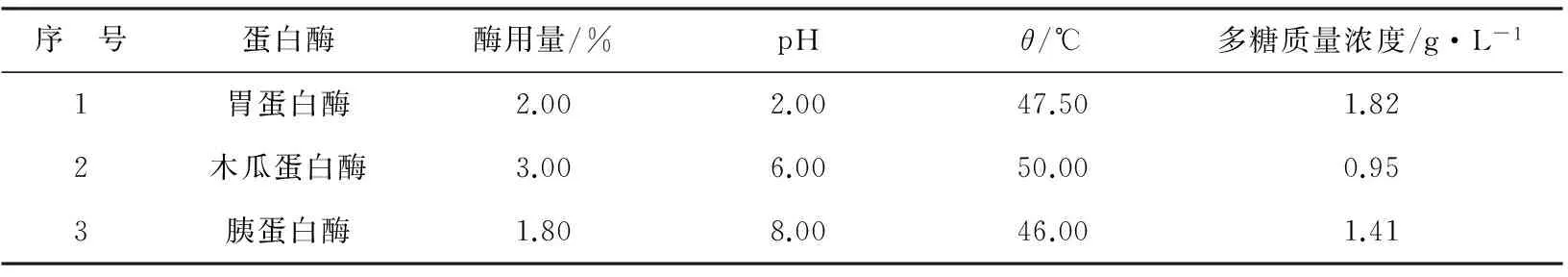
表1 蛋白酶种类对多糖提取的影响Table 1 Influence of different enzymatic proteases on polysaccharide yield
2.2 单因素实验
2.2.1 酶用量对海参多糖提取的影响
如图1显示, 随着酶解时胃蛋白酶用量的增加,得到的多糖质量浓度呈逐渐增加趋势,而当胃蛋白酶的用量超过1.8%时,多糖质量浓度开始下降。这可能是因为底物的浓度达到饱和,再增加酶用量反而由于大分子之间的位阻等作用抑制了酶促反应的进行。所以选择的最佳酶用量为1.80%。
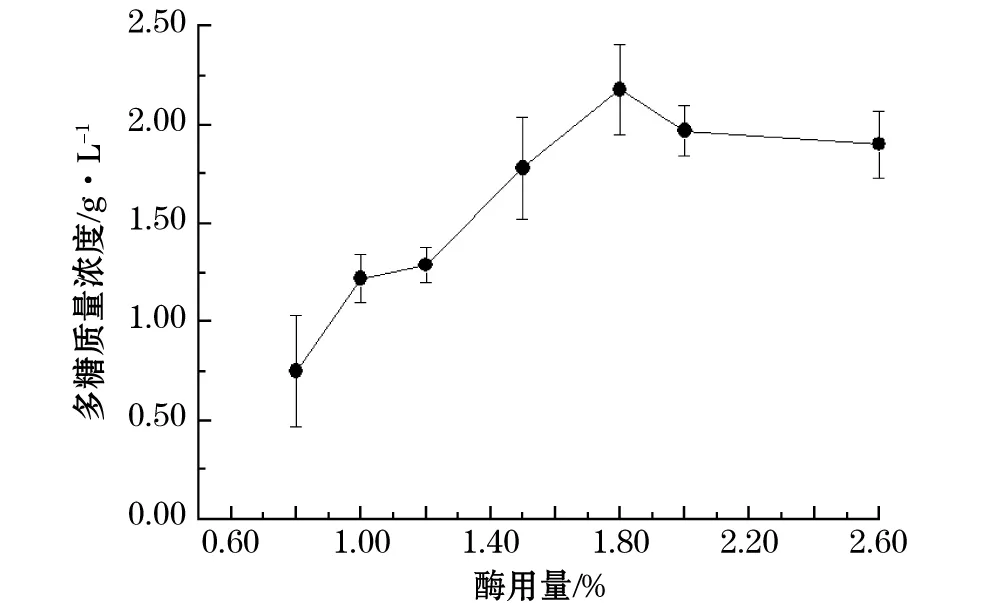
图1 酶用量对多糖质量浓度的影响
2.2.2 pH值对海参多糖提取的影响
酶解时,pH值过低或过高都会影响胃蛋白酶的活性。在确定酶用量为1.8%条件下,考察在不同pH值对所得多糖质量浓度的影响(图2)。当pH值在0.70~1.20变化时多糖的质量浓度变化不大;pH值由1.20增至1.50时,多糖质量浓度明显增加;当pH值达到1.50后,随pH值的继续增大,所得多糖质量浓度呈下降趋势。当超过最适pH值后胃蛋白酶的活性受到抑制,因此选择pH值1.50为最佳的酶解pH。

图2 pH值对多糖质量浓度的影响
2.2.3 酶解温度对海参多糖提取的影响
确定最佳酶用量、pH后,考察酶解温度对所得多糖质量浓度的影响,由图3可见,在35.00~47.50 ℃酶解温度范围内,随着温度的升高,多糖质量浓度逐渐上升,达到47.50 ℃后,升高酶解温度,多糖的质量浓度呈下降趋势。酶解温度升高,酶催化速度加快,同时酶的稳定性也遭到破坏,所以只有当这两种效应达到平衡时酶处于最佳催化状态,即达到酶的最适酶解温度。
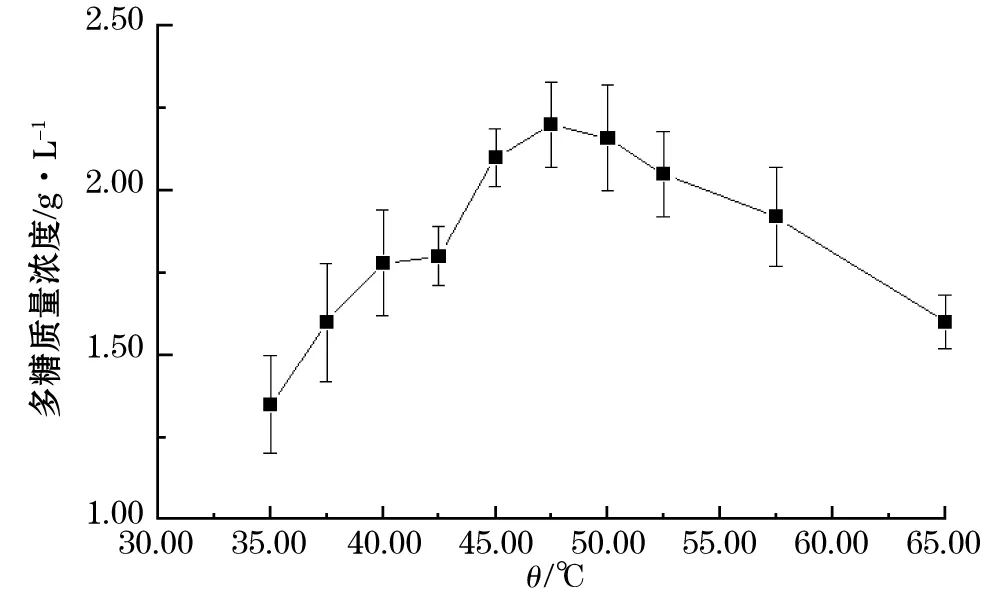
图3 酶解温度对多糖质量浓度的影响
2.2.4 酶解时间对海参多糖提取的影响
随着酶解的进行,多糖质量浓度随时间的增加不断增加。由图4可知,酶解进行到5 h之后多糖质量浓度增加缓慢,6 h后趋于平稳。在接下来的研究中采用最佳酶解时间6 h。
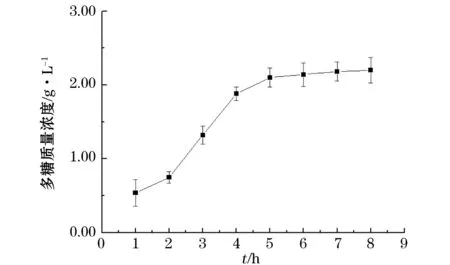
图4 酶解时间对多糖质量浓度的影响
2.3 响应面分析优化工艺结果
根据单因素实验结果,选取酶解pH值(A)、酶解温度(B)、酶用量(C)三因素,设计三因素三水平响应面实验见表2。根据Box-Benhnken的中心组合实验设计原理,共设计17个实验点,分为零点和析因点,其中析因点为自变量取值在A、B、C所构成的三维顶点上,零点实验重复5次,来估计实验误差。实验分析方案及结果见表3。

表2 响应面法分析因素及水平Table 2 Factors and levels of response surface analysis

表3 响应面分析方案及试验结果Table 3 Scheme and experimental results of response surface analysis
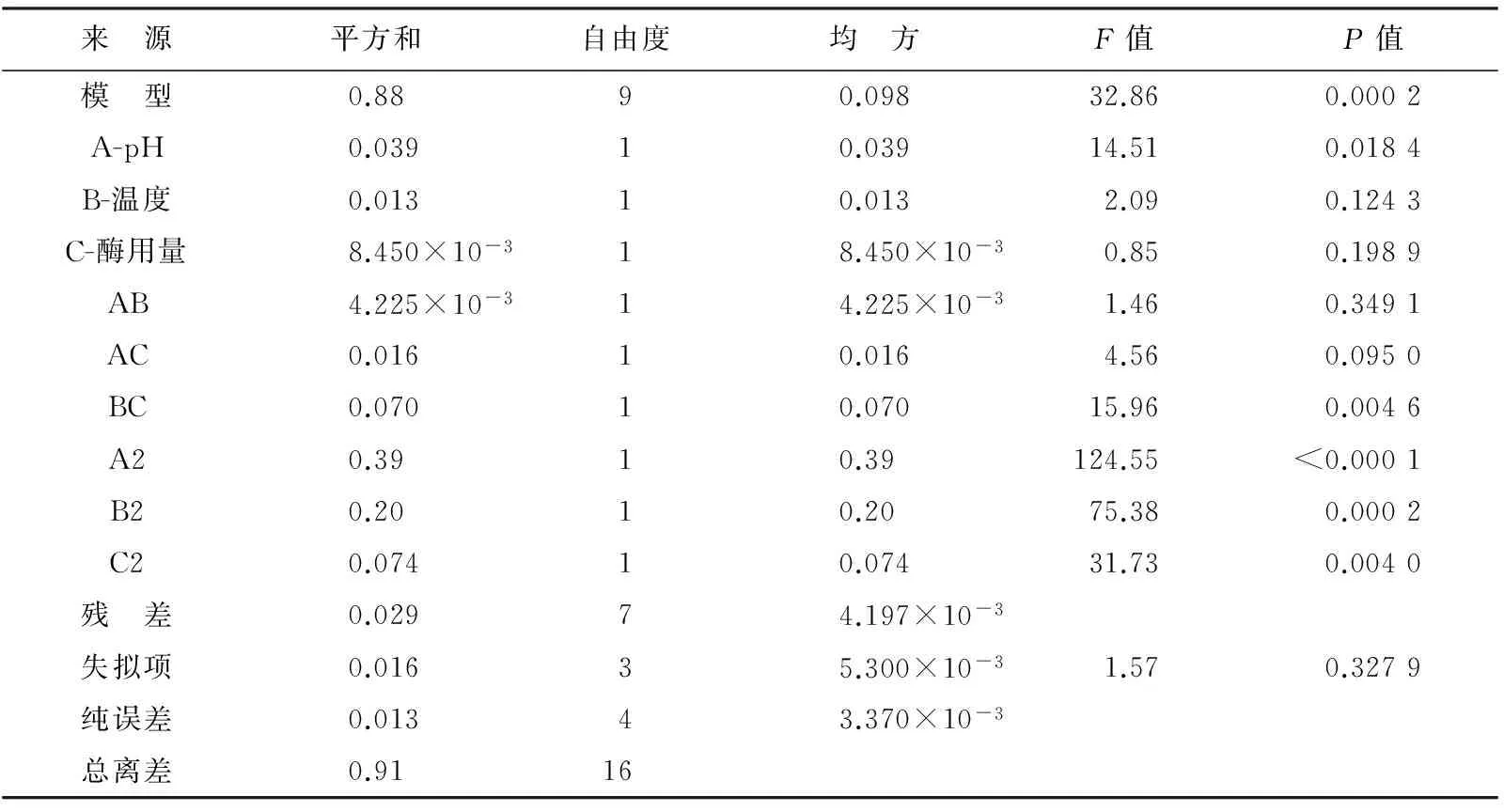
表4 模型回归系数显著性检验和结果Table 4 Results of the significance test for the established regression coefficient model
采用Design-Expert 8.0.5软件对实验数据进行多元回归拟合,得到海参多糖的提取与所选3个因素的二次多项回归模型为
Y=2.27-0.070A-0.040B+0.033C-0.032AB+0.063AC-0.13BC-0.30A2-0.22B2-0.13C2,
(2)
式中,Y为海参多糖质量浓度(g/L);A为pH值;B为酶解温度;C为酶用量。
对该模型进行方差分析结果见表4,P=0.000 2<0.01表明模型高度显著,模型的决定系数R2=0.985 1,表明该模型能解释98.51%的实验,因此该模型拟合程度良好,可用此模型对多糖提取进行分析和预测。表4中各因素对多糖质量浓度的影响不同,其中酶解pH 值的影响最大,P值接近0.018 4<0.05,说明pH值对此次实验酶解所得海参多糖质量浓度有较为显著的影响。通过比较回归方程中一次项系数的绝对值大小判断因子影响的主次为pH影响最大,其次是酶解温度,酶用量影响最小。
根据回归分析结果,作响应面曲面图,如图5~图7所示,可以直观地看出交互作用对多糖提取的影响。

图5 pH值和酶解温度对多糖提取的影响

图6 酶解pH值和酶用量对多糖提取的影响

图7 酶解温度和酶用量对多糖提取的影响
在选取的各因素范围内,根据回归模型利用Design-Expert 8.0.5软件分析得出海参多糖最优提取条件为:酶解pH=1.47,酶解温度46.82 ℃,酶用量1.94%。在此条件下,海参多糖质量浓度的预测值为2.28 g/L。 考虑到实际操作的便利, 将提取工艺参数稍作调整为:酶解pH=1.50,酶解温度47.00 ℃,酶用量2.00%。为检验响应曲面法所得结果的可靠性,重复实验3次,提取的海参多糖质量浓度为2.31 g/L,与模型理论最大值2.28 g/L非常接近,说明模型可以较好地反映出海参多糖提取的条件,从而也说明了用响应面法对海参多糖提取条件进行优化是可行的。
在选取的各因素范围内,根据回归模型通过Design-Expert 8.0.5软件分析得出海参多糖最优提取条件为:酶解pH=1.47,酶解温度46.82 ℃,酶用量1.94%。在此条件下,海参多糖质量浓度的预测值为2.28 g/L。 考虑到实际操作的便利, 将提取工艺参数稍作调整为:酶解pH=1.50,酶解温度47.00 ℃,酶用量2.00%。为检验响应曲面法所得结果的可靠性,重复实验3次,提取的海参多糖浓度为2.31 g/L,与模型理论最大值2.28 g/L非常接近,说明模型可以较好的反映出海参多糖提取的条件,从而也说明了用响应面法对海参多糖提取条件进行优化是可行的。
2.4 醇沉法回收海参多糖
选用不同体积分数的乙醇过滤醇析多糖,实验结果见图8,当乙醇体积分数在20%~50%变化时,多糖得率随着乙醇体积分数的增加上升明显,乙醇体积分数大于50%之后,多糖得率趋向稳定,最终选体积分数为50%的乙醇进行醇沉回收,海参多糖得率为39.5%。

图8 醇沉体积分数对多糖得率的影响
2.5 纯化提取后海参多糖质量分数及其组分分析
采用苯酚硫酸法测得沉淀回收后的多糖质量分数为72.33%。其中硫酸基质量分数最高为20.06%,糖醛酸为10.67%,岩藻糖为9.03%,氨基糖为4.68%。
3 讨 论
蒸煮是海参加工的重要环节之一,蒸煮废液中含有与海参相同的多糖成分,大量的海参加工蒸煮废弃液排放,会给环境带来一定的危害也会造成资源的浪费。蛋白是影响海参多糖纯度的主要杂质[12],因此在海参多糖提取时,需要采取碱法或酶法进行处理去除蛋白[13-16]。碱溶液提取多糖时能破坏糖肽键但也会一定程度地降解糖链,相比之下酶法则能在不改变多糖链结构的前提下降解蛋白,对多糖的提取十分有效。海参蒸煮废液经过胃蛋白酶水解后里面含有色素、蛋白、多肽等杂质,去除杂质分离多糖的方法有沉淀法、离子交换层析和凝胶层析[12]等,最常用的是沉淀法。本研究采用乙醇作为沉淀剂,向多糖溶液中加入乙醇达到一定浓度,多糖的水化膜遭到破坏而以盐的形式聚集沉淀,实现多糖的分离[17],且乙醇毒性低,后期回收可反复利用,有利于降低提取成本。
海参多糖中含有丰富的岩藻聚糖,还含有硫酸基、糖醛酸及氨基糖等多糖组分。硫酸基质量分数是决定硫酸多糖活性极为重要的指标,硫酸基质量分数的测定是研究硫酸多糖构效关系的一个重要方面[18]。研究中蒸煮废液经过酶解处理后,氨基糖、糖醛酸、岩藻糖和硫酸基占总糖的质量分数分别为4.68%,9.03%,10.67%,20.06%,其中硫酸基质量分数最高达20.06%,与目前已有的海参多糖硫酸基研究结果相似[17],说明海参蒸煮后废液中营养物质与海参个体中营养物质质量分数相近,建立经济有效的海参蒸煮废液多糖回收具有现实意义。
研究中采用响应面分析法优化海参蒸煮废液提取海参多糖工艺,采用胃蛋白酶进行酶解,以酶解pH值、酶解温度、酶用量为主要因素进行中心组合实验,建立了预测回归方程:Y=2.27-0.070A-0.040B+0.033C-0.032AB+0.063AC-0.13BC-0.30A2-0.22B2-0.13C2,式中,Y为海参多糖的质量浓度(g/L);A为pH值;B为酶解温度;C为酶用量。实验结果表明酶解时pH值对多糖质量浓度影响显著,当酶解pH=1.50、酶解温度47.00 ℃、酶用量2.00%、酶解时间6 h时,所得糖质量浓度为2.31 g/L,采用乙醇体积分数为50%醇沉法回收多糖,总回收率为39.5%。
本研究对海参多糖的提取工艺较为简便,历时短,具有很强的操作性,可为建立经济有效的海参蒸煮废液多糖回收工艺提供理论指导。
[1] JIANG J, YANG B L, TAI Y. Studies on resources and bioactive substances of sea cucumber[J].Letter in Biotechnology, 2004,15:537-540.姜健,杨玲宝,邰阳.海参资源及其生物活性物质的研究[J].生物技术通讯,2004,15:537-540.
[2] ZHANG M X, WANG X C,LIU Y. Advances on the research of sea cucumber biological activities[J].Natural Product Research and Development, 2012,24:1151-1159. 张梅秀,王锡昌,刘源.海参生物活性研究进展[J].天然产物研究与开发,2012,24:1151-1159.
[3] LIU, X, SUN, Z L, ZHANG M S, et al.Antioxidant and antihyperlipidemic activities of polysaccharides from sea cucumber apostichopus japonicus[J].Carbohydrate Polymers,2012,90(4):1664-1670.
[4] FEI R C. Experiment design and data processing[M]. Wuxi: Jiangnan University press,2001.费荣昌.实验设计与数据处理[M].无锡:江南大学出版社,2001.
[5] ZHANG Q, SONG Y M, LI J. Optimization of exopolysaccharides prodution conditions of Antarctic bacteriumPsychrobactersp. B-3 by response surface methodology[J].Advances in Marine Science,2013,31(2):281-289.张曲,宋益民,李江.响应面法优化南极菌Psychrobactersp.B-3的发酵产糖条件[J].海洋科学进展,2013,31(2):281-289.
[6] ZHANG S H. Food inspection and analysis[M].Beijing:China Light Industry Press,2004.张水华.食品分析[M].北京:中国轻工业出版社,2004.
[7] LIU H Y, XUE C H, LI Z J, et al. Spectrophotometric determination of fucoidan inLaminariaJaponicawith methylene blue[J]. Journal of Ocean University of Qingdao(Natural Science), 2002,32(2):236-240.刘红英,薛长湖,李兆杰,等.海带岩藻聚糖硫酸酯测定方法的研究[J].青岛海洋大学学报(自然科学版), 2002,32(2):236-240.
[8] DODGSON K, PRICE R. A note on the determination of the ester sulfate content of sulfated polysaccharides[J]. Journal of Biological Chemistry,1962,84:106-110.
[9] BITTER T, MUIR H M. A modified uronic acid carbazole reaction [J]. Analytical Biochemistry,1962,4:330-334.
[10] SU C, XIA W S, YAO H Y, et al. The determination method of glucosamine and N-acetlglucosamine[J]. Scinece and Technology of Food Industry, 2003,24(6):74-75.苏畅,夏文水,姚惠源,等.氨基葡萄糖和乙酰氨基葡萄糖的测定方法[J].食品工业科技,2003,24(6):74-75.
[11] XU L, YE L B, YU P, et al. Optimization of enzymatic polysaccharide extraction from acaudina molpadioides semper by response surface methodology[J].Food Science, 2010,31(20):61-66.徐逯,叶立斌,于平等.东海海参多糖酶解提取工艺优化[J].食品科学,2010,31(20):61-66.
[12] WANG C Y, GUAN H S. A survey of the methods of extraction, isolation and determination for glycosaminoglycans[J].Chinses Journal of Marine Drugs,1996,15(1):24-32.王长云, 管华诗. 氨基多糖的提取、分离和分析测定方法及其研究进展[J].中国海洋药物,1996,15(1):24-32.
[13] WANG L, CHEN J, JIANG J G, et al. Studies on isolation and characteristics of acidic mucopolysaccharide from holothurian arenicola sempe[J]. Modern Food Science and Technology,2008,24(7):6655-6657.王玲,陈健,姜建国,等.沙海参多糖的分离和特性研究[J].现代食品科技,2008,24(7):6655-6657.
[14] WANG Y H, LV Z H, JIANG Y F. Extraction and determination of polysaccharides in the holothutia[J].Periodical of Ocean University of China(Nataral Science), 2005,35(6):987-990.王远红,吕志华,姜延福.梅花参中多糖提取工艺及含量测定的研究[J].中国海洋大学学报(自然科学版),2005,35(6):987-990.
[15] FU X J, PIAO L J. Optimization of technology for preparation of polypeptide and polysaccharide from sea cucumber. Food Science and Technology, 2007,9:116-118.付学军,朴亮均.酶解法综合制备海参多肽、多糖的工艺研究[J].食品科技,2007,9:116-118.
[16] CAI B X, WU C Y. The methods of separation and purification and the main biological activities of polysaccharide in sea cucumber[J]. Journal of Fujian Fisheries, 2008,118:70-74.蔡彬新,吴成业.海参多糖的分离纯化方法及其主要生物活性[J].福建水产,2008,118:70-74.
[17] SHENG W J. Extraction and chemical component analysis of polysaccharides from different sea cucumbers[D]. Qingdao:Ocean University of China,2007.盛文静.不同海参多糖提取分离及化学组成分析比较[D].靑岛:中国海洋大学,2007.
[18] MARUYAMA T, TOIDA T, IMANARI T, et al. Conformational changes and anticoagulant activity ofchondroitin sulfate following its O-sulfonation[J]. Carbohydrate Research,1998,306:35-43.
Received: June 23, 2015
Optimization of Polysaccharide Extraction From Cooking Progress Waste Liquid of Sea Cucumber
YI Dan1, LI Mei2, ZHANG Zhao-hui1,GENG Yuan-sheng3,JIANG Yu-bao3
(1.TheFirstInstituteofOceanography,SOA, Qingdao 266061; 2.JiangsuUniversity, Zhenjiang 212013;3.QingdaoJiarilongOceanFoodCo.,LTD, Qingdao 266700)
In order to multiply utilize the sea cucumber cooking process waste liquid, the enzymatic hydrolysis was adopted to recover the polysaccharide from the sea cucumber cooking process waste liquid with pepsin. On the basis of single-factor test, the pH, hydrolysis temperature and dosage of pepsin were selected as independent variable and polysaccharide yield as response value to study the effect of interactions of independent variable on polysaccharide extraction ) through Box-Benhnken center composite design and response surface methodology. The results indicated that the optimal extraction conditions were pH=1.5, hydrolysis temperature 47 ℃, dosage of pepsin 2.0%. Under these conditions, the polysaccharide yield was 2.31 g/L. The recovery rate was 39.5% after precipitated by 50% alcohol.
sea cucumber; cooking process waste liquid; enzymatic hydrolysis; polysaccharide; response surface analysis
2015-06-23
青岛市科技开发项目——海参加工副产物提取纯化及应用研究(A201203);中央级公益性科研院所基本科研业务费专项资金项目——菌群复配共发酵降解绿潮藻产生物丁醇研究(2012G14)
衣 丹(1974-),女,山东栖霞人,副研究员,博士,主要从事海洋生物与开发方面研究.E-mail:yidan@fio.org.cn
(王佳实 编辑)
TQ95
A
1671-6647(2016)01-0106-08
10.3969/j.issn.1671-6647.2016.01.010
