非洲菊常见品种的染色体核型与倍性分析
2016-12-12王亚琴
李 顺, 王亚琴
(华南师范大学生命科学学院, 广东省植物发育生物工程重点实验室, 广州 510631)
非洲菊常见品种的染色体核型与倍性分析
李 顺, 王亚琴*
(华南师范大学生命科学学院, 广东省植物发育生物工程重点实验室, 广州 510631)
采用常规根尖压片技术对非洲菊3个常见品种的染色体进行核型分析,并用流式细胞仪检测其倍性. 结果表明:供试的3个非洲菊品种均为二倍体. “深圳5号”核型公式为2n=2x=50=2M+34m+14sm,染色体相对长度系数组成为2n=6L+12M2+24M1+8S,按照STEBBINS标准核型分类属于“2C”核型,不对称系数AS.K% =60.09%. “香槟”核型公式为2n=2x=50+B=36m+12sm+2st+B,染色体相对长度系数组成为2n=8L+10M2+16M1+16S,属于“2C”核型,不对称系数AS.K% =62.17%. “大头粉”核型公式为2n=2x=50+B=34m+12sm+4st+B,染色体相对长度系数组成为2n=8L+8M2+28M1+6S,属于“2B”核型,不对称系数AS.K% =62.21%. 综上所述,3个非洲菊品种的染色体长度、着丝点位置、B染色体的有无均不同,核型呈现多态性.
非洲菊; 核型分析; 核不对称系数; 倍性分析
非洲菊(Gerberajamesoniihybr)是菊科大丁草属具有花葶的多年生草本植物[1]. 其野生资源来自南非的普马兰加,目前世界各地栽种的非洲菊多为栽培品种. 随着新品种的不断培育成功,非洲菊已成为世界四大切花之一. 栽培的非洲菊品种花朵肥大,花色多样,花梗硬实挺拔,叶片基生,头状花序由外轮的舌状花、中间的过渡花和内轮的盘状花组成. 据统计,目前我国非洲菊栽培品种有59个[2-4],其中我国自主培育出的非洲菊新品种有30个,包括云南省农科院花卉所培育出的“冬日”、“靓粉”、“红地毯”和上海农业科学研究院培育出的“901-A”等. 非洲菊品种按照花茎大小可分为大花和小花两大类,按照花瓣的形态分为宽花瓣型、窄花瓣型和重花瓣型. 此外,根据观赏方式不同也可分为花梗较长的切花品种和花梗较短的盆栽品种[5].
控制生物性状的核基因位于染色体上,从而使得遗传现象与染色体行为密切关联,因此通过观察染色体可以有效地解释一些遗传现象. 染色体观察最常规的技术是压片和核型分析. 常规压片技术能够显示染色体的形态和结构,基于该技术的核型分析包括对染色体数目、大小、着丝点位置、臂比和随体的分析[6],对研究物种进化、分类以及分析染色体形态与功能之间的关系具有重要作用. 染色体倍性鉴定技术主要是流式细胞技术,利用流式细胞仪检测植物染色体倍性可以验证常规压片法所得结果. 研究表明,国内外栽培的非洲菊染色体数目为25、50和100条[7-9],主要以二倍体为主. 非洲菊的染色体较小,关于非洲菊染色体的研究主要集中在染色体计数上,还未见染色体形态的系统研究报道. 本文通过对3个常见非洲菊栽培品种染色体数目、倍性以及核型进行研究,为非洲菊染色体组构成、品种分类提供细胞遗传学依据,为非洲菊种质资源的利用和新品种选育奠定理论基础.
1 材料与方法
1.1 材料和仪器
供试非洲菊(Gerberajamesoniihybr )“深圳5号”(S5)、“大头粉”(DTF)、“香槟”(HC)花蕾采集于广州增城镇龙鲜花基地,利用非洲菊组培体系获得组培苗,将组培苗移植到生根培养基,待3周左右即可取1~2 cm幼根用于实验. 用荧光相差正置显微镜(LEICA DM2500)观察非洲菊染色体. 用流式细胞仪Partec CyFlow®Space检测非洲菊倍性.
1.2 染色体制片方法和核型分析
切取3 mm根尖置于0.002 mol/L 8-羟基喹啉中4 ℃处理3 h[8]. 蒸馏水漂洗2~3次后加入固定液(V(乙醇)∶V(冰醋酸)=3∶1),4 ℃固定24 h. 用70%乙醇冲洗2次后转入70%乙醇中,4 ℃保存待用. 将根尖置于0.075 mol/L的KCl溶液中,37 ℃低渗1 h. 洗净根尖,置于解离液(V(1 mol/L盐酸)∶V(45%醋酸)=1∶1)中解离30 min,解离后立即取出根尖洗净并置于蒸馏水中,28 ℃低渗1 h. 滴加碱性品红染液,用镊子捣碎根尖,使细胞尽可能分散,染色5 min,采用压片法观察. 用荧光相差正置显微镜在100倍的油镜下对染色体形态清晰且分散良好的细胞进行拍照. 选取5张染色体分散良好且形态清晰的中期染色体图片进行核型分析.
染色体类型参照LEVAN等[10]的命名系统,核型分析参照李懋学和陈瑞阳[6]的标准,核型分类按照STEBBIN[11]的方法. 用Photoshop软件将染色体配对[12],并用ImageJ软件测量染色体长臂和短臂值,采用Excel软件绘制核型模式图[13].
1.3 流式细胞仪检测倍性
分别取1 cm2左右鲜嫩的样品叶片和内参叶片放置于预冷的培养皿中,加入1 mL预冷的裂解液[14-15],用刀片将叶片快速地一次性切碎,将碎片匀浆用40 μm的细胞筛过滤到2 mL离心管中,加入DAPI荧光染液至2 mg/L[16],黑暗条件下冰上放置0.5~1.0 h后即可上机检测. 采用二倍体番茄(“夏威夷7996”, 2C=2.0 pg)作为内参[17-19],每个样品检测5 000~10 000个细胞核.
2 结果与分析
2.1 3个非洲菊品种间期核和前期染色体类型
供试的3个非洲菊品种具有比较一致的间期核和前期染色体形态(图1). 间期核由3~4个染色较深的染色中心构成,染色中心分布于核的一侧,属于简单染色中心型[20]. 前期染色体中(图1D~F),染色深浅不一的染色质固缩块相间排列,染色较深的异染色质固缩块在染色体中部、基部和端部都有分布,整条染色体呈“念珠”状,属于中间型.
2.2 3个非洲菊品种中期染色体的核型分析
非洲菊的中期染色体和核型图(图2A)、核型模式图(图3A)以及染色体参数(表1)的结果显示,“深圳5号”的根尖染色体数目是2n=2x=50,是二倍体. 核型公式是2n=2x=50=2M+34m+14sm,即中期染色体中有1对正中着丝粒染色体、17对中部着丝粒染色体和7对近中部着丝粒染色体. 染色体相对长度变化范围是2.24%~9.21%,最长和最短染色体比值是 4.107 0,臂比>2的染色体比率是24%,核型不对称系数是 60.09%,核型类型是2C[11]. 相对长度系数组成是 2n=6L+12M2+24M1+8S,即具有3对长染色体、6对中长染色体、12对中短染色体和4对短染色体.
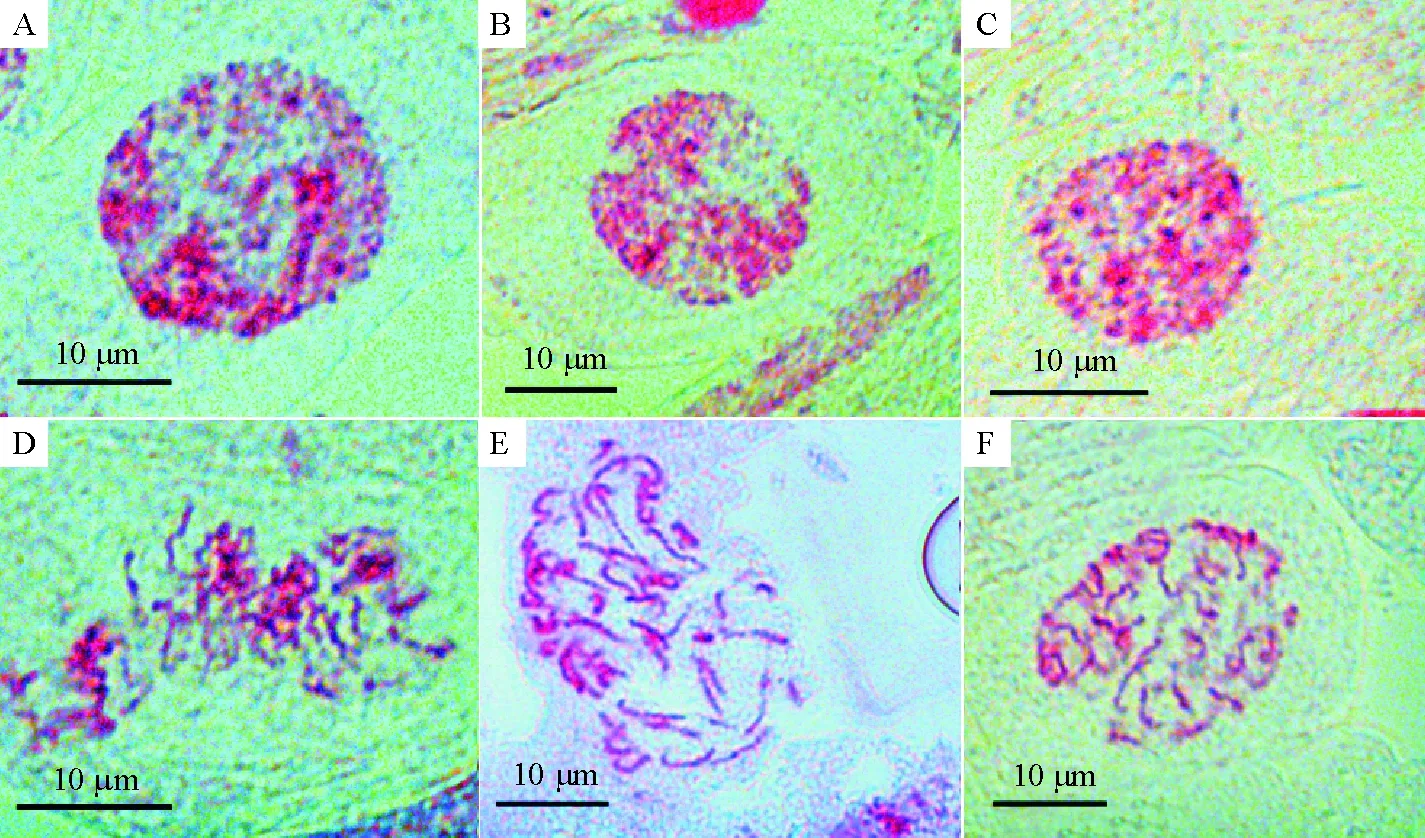
A、B、C: “深圳5号”、“大头粉”、“香槟”的间期核;D、E、F:“深圳5号”、“大头粉”、“香槟”的前期染色体.
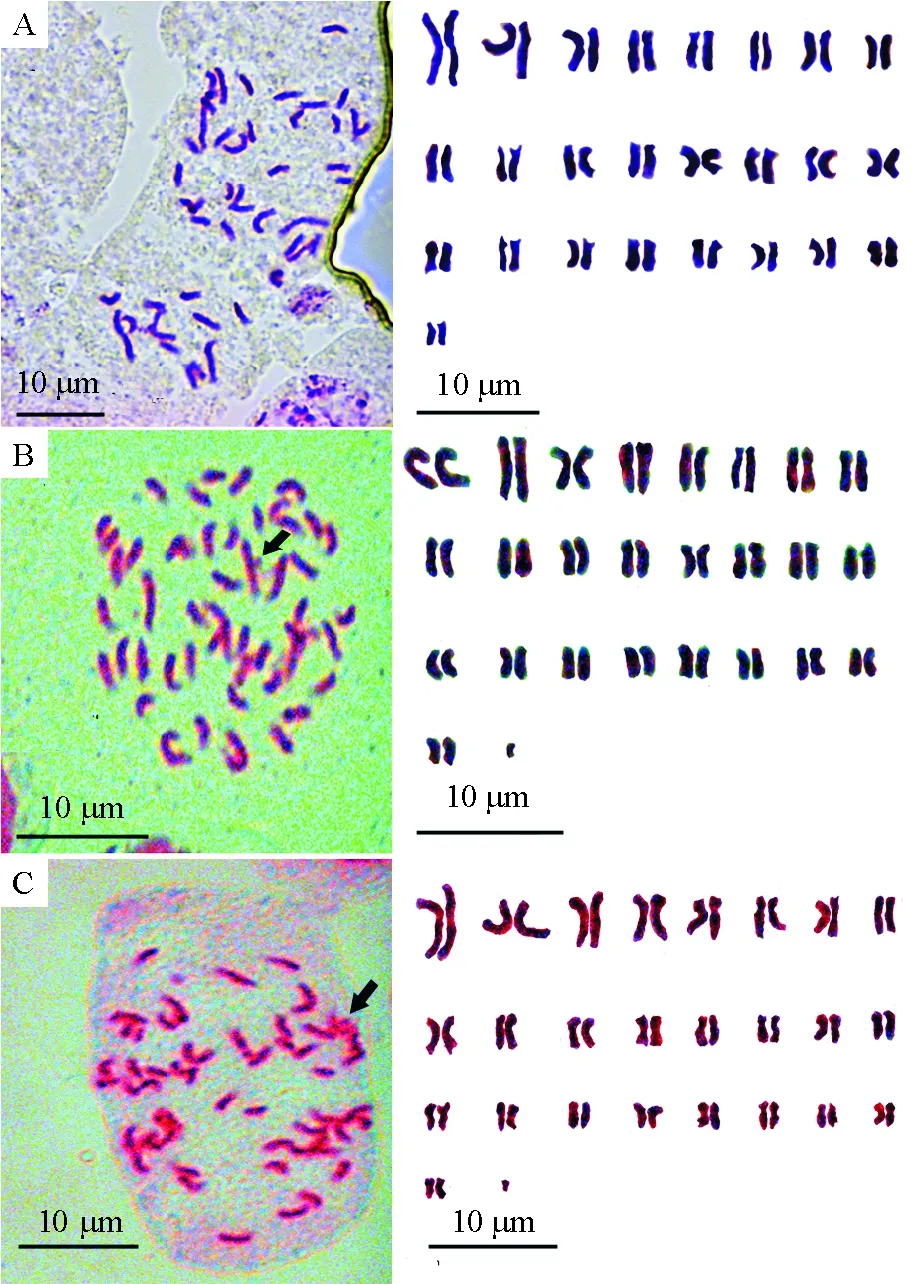
A:“深圳5号”中期染色体及核型图;B:“大头粉”中期染色体及核型图;C:“香槟”中期染色体及核型图. 箭头所指的是B染色体.
图2 非洲菊中期染色体及核型图
Figure 2 Photomicrographs of metaphase chromosomes and karyotype inGerberajamesoniihybr
“大头粉”(图2B、图3B、表1)的根尖染色体数目是2n=2x+B=50+B,是二倍体. 核型公式是2n=2x=50+B=34m+12sm+4st+B,即中期染色体中有17对中部着丝粒染色体、6对近中部着丝粒染色体、2对近端部着丝粒染色体和1个B染色体. 染色体相对长度变化范围是2.2%~8.13%,最长和最短染色体比值是3.695 5,臂比>2的染色体比率是16%,核型不对称系数是62.21%,核型类型是2B. 相对长度系数组成是2n=8L+8M2+28M1+6S,即具有4对长染色体、4对中长染色体、14对中短染色体和3对短染色体.
“香槟”(图2C、图3C、表1)的根尖染色体数目是2n=2x+B=50+B,是二倍体. 核型公式是2n=2x=50+B=36m+12sm+2st+B,即中期染色体中有18对中部着丝粒染色体、6对近中部着丝粒染色体、1对近端部着丝粒染色体和1个B染色体. 染色体相对长度变化范围是2.23%~9.36%,最长和最短染色体比值是4.197 2,臂比>2的染色体比率是28%,核型不对称系数是62.17%,核型类型是2C. 相对长度系数组成是2n=8L+10M2+16M1+16S,即具有4对长染色体、5对中长染色体、8对中短染色体和8对短染色体.

图3 非洲菊核型模式图
Figure 3 Chromosomal karyotpe schema ofGerberajamesoniihybr
2.3 3个非洲菊品种的倍性分析
非洲菊的染色体偏小且数目多,因此需要采用准确性较高的流式细胞仪验证根尖压片的结果. 流式细胞仪的检测结果(图4)中CV值均小于10%,表明结果是准确可靠的[21]. 内参番茄的DNA含量为2C=2.0 pg,由此可计算出“深圳5号”的DNA含量为5.18 pg,“大头粉”的DNA含量为5.21 pg,“香槟”的DNA含量为5.38 pg,结果与REYNOIRD等[22]的检测结果(非洲菊DNA含量2C=5.2 pg)基本一致. 其中“大头粉”和“香槟”的DNA含量比“深圳5号”的略高一些,推测可能是“大头粉”和“香槟”含有B染色体所致. 根据“深圳5号”、“大头粉”和“香槟”的DNA含量可知这3个品种均为二倍体,与本试验中的染色体压片结果一致.
3 讨论
本研究中所用的3个非洲菊品种,“深圳5号”是橙瓣黑心品种,“香槟”是奶黄瓣黑心品种,“大头粉”是粉红瓣绿心品种. 在3个非洲菊品种的核型比较(表1)中,“深圳5号”和“香槟”的最长/最短染色体、臂比>2的比率比较接近,核型类型相同,说明相对于“大头粉”而言,这2个品种的亲缘关系比较近,这与“深圳5号”和“香槟”都是黑心的表型相符. 然而“深圳5号”和“香槟”的核型公式不同,“深圳5号”具有正中着丝粒染色体,不具有近端着丝粒染色体. 非洲菊是异花授粉植物,引种方式、栽培条件和人工杂交育种中所选的父母本不同都会导致变异发生,染色体结构相应也会发生改变[23-24],这可能是试验中3个非洲菊品种核型差异的原因,也可能是非洲菊品种多样性的原因.

图4 番茄与非洲菊DNA含量图

种类核型公式平均臂比最长/最短染色体臂比>2的比率/%核不对称系数/%核型类型“深圳5号”2n=2x=50=2M+34m+14sm1.644.10702460.092C“香槟”2n=2x=50+B=36m+12sm+2st+B1.714.19722862.172C“大头粉”2n=2x=50+B=34m+12sm+4st+B1.693.69551662.212B
有关大丁草属的染色体研究绝大多数停留在染色体计数上,关于核型的报道极少,只有BEGUM等[25]研究了Gerberaviridifolia的核型,其染色体数目为2n=2x=48. 在BEGUM研究数据的基础上笔者推断Gerberaviridifolia染色体的核不对称系数是66.67%,核型类型是3B. STEBBINS[11]将染色体核型按对称程度分为12种类型,并认为染色体核型在生物进化过程中是由对称向不对称演化的,对称程度越高的生物进化程度越低,而对称程度越低的生物进化程度越高. 笔者研究的3个非洲菊品种的核不对称系数(60.09%~62.21%)都比Gerberaviridifolia的核不对称系数低. 3个非洲菊品种中“大头粉”的核型类型是2B,比较对称,接近于原始的非洲菊. 因此推测非洲菊比其同属的Gerberaviridifolia进化程度低,是大丁草属中较为原始的物种. 这还有待于利用原位杂交技术[26]、分子遗传标记等[27-28]技术进一步验证.
在3个非洲菊品种中“大头粉”和“香槟”的染色体中观察到一个小型的染色体,综合比较了其他中期分裂相细胞,发现这个小型染色体距离大染色体较远,且与其他任一大染色体之间没有对应的关系,故笔者推测是B染色体. 陈丽梅等[29]的研究发现种植在干旱地的兰州百合中,B染色体出现的频率明显高于种植在较湿润土壤中的兰州百合. 姜立春和彭正松[30]的研究提到当黑麦草属植株从播种到生长都在密度很大的环境中时,只有含有B染色体的植株能存活下来,说明B染色体在生物界的出现和分布能显著增强个体的适应性. PLOWMAN[31]的研究发现在干旱情况下细香葱(AlliumSchoenoprasum)个体所含B染色体的频率与种子发芽率呈正相关,能提高种子萌发时抗干旱的能力. 另外,VOSA[32]发现B染色体的出现能够帮助叶兰在潮湿环境中定植生存. 我国栽培的非洲菊品种都是从国外引种的,在引种过程中非洲菊经历了严重的环境适应性考验,加之供试的3个非洲菊品种来源于雨水充足、土壤环境潮湿的广东,这些原因都可能导致非洲菊中B染色体的出现.
[1] ANDERBERG A A,BALDWIN B G,BAYER R G,et al. Flowering plants eudicots[M]. Heidelberg:Springer-Verlag Berlin Heidelberg,2007:116.
[2] 孙强. 非洲菊杂交育种技术及优良品系选育初步研究[D]. 南京:南京林业大学,2007.
SUN Q. Preliminary study on techniques of cross breeding and selection of new cultivars inGerberajamesonii[D]. Nanjin: Nanjing Forestry University,2007.
[3] 夏朝水. 福建主栽非洲菊品种资源的综合评价与应用[D]. 福州:福建农林大学,2014.
XIA C S. Comprehensive evaluation and application of Fujian main cultivated varieties ofGerberajamesoniiresources[D]. Fuzhou:Fujian Agriculture and Forestry University,2014.
[4] 柏斌. 昆明煜辉11个非洲菊获植物新品种权证书[J]. 中国花卉园艺,2014(11):49.
[5] 何小弟,赵统利,鲁金武. 非洲菊[M]. 南京:江苏科学技术出版社,2000:1-5.
[6] 李懋学,陈瑞阳. 关于植物核型分析的标准化问题[J]. 武汉植物学研究,1985,3(4):297-302.
LI M X,CHEN R Y. A suggestion on the standardization of karyotype analysis in plant[J]. Journal of Wuhan Botanical Research,1985,3(4):297-302.
[7] AHMIM M,VIETH J. Production de plantes haploides deGerberajamesoniipar culture in vitro d′ovules[J]. Canadian Journal of Botany,1986,64(10):2355-2357.
[8] MIYOSHI K,ASAKURA N. Callus induction,regeneration of haploid plants and chromosome doubling in ovule cultures of pot Gerbera (Gerberajamesonii)[J]. Plant Cell Reports,1996,16(1/2):1-5.
[9] 李涵,鄢波,张婷,等. 切花非洲菊多倍体诱变初报[J]. 园艺学报,2009,36(4):605-610.
LI H,YAN B,ZHANG T,et al. Preliminary studies on polyploidy mutation of cut flowerGerberajamesoniiBolus[J]. Acta Horticulturae Sinica,2009,36(4):605-610.
[10]LEVAN A,FREDGA K,SANDBERG A A. Nomenclacture for ceritromeric position on chromosomes[J]. Hereditas,1964,52(2):197-201.
[11]STEBBINS G L. Chromosome evolution in hingher plants[M]. London:Edward Arnoldy Ltd,1971:88-93.
[12]杨大翔. 用Adobe Photoshop进行核型分析[J]. 农业网络信息,2005(3):44-46.
[13]乔永刚,宋芸. 利用EXCLE制作核型模式图[J]. 农业网络信息,2006(10):97-98.
[14]SGORBATI S,LEVI M,SPARVOLI E,et al. Cytometry and flow cytometry of 4′,6-diamidino-2-phenylindole (DAPI)-stained suspensions of nuclei released from fresh and fixed tissues of plants[J]. Physiologia Plantarum,1986,68(3):471-476.
[15]TOSCA A,PANDOLFI R,CITTERIO S,et al. Determination by flow cytometry of the chromosome doubling capacity of colchicine and oryzalin in gynogenefic haploids of Gerbera[J]. Plant Cell Reports,1995,14(7):455-458.
[16]GELBRAITH D W,LAMBERT G M,MACAS J,et al. Analysis of nuclear DNA content and ploidy in higher plants[J]. Current Protocols in Cytometry,2002,761-862.
[17] 田新民,周香艳,弓娜. 流式细胞术在植物学研究中的应用——检测植物核DNA含量和倍性水平[J]. 中国农学通报,2011,27(9):21-27.
TIAN X M,ZHOU X Y,GONG N. Applications of flow cytometry in plant research:analysis of nuclear DNA content and ploidy level in plant cells[J]. Chinese Agricultural Science Bulletin,2011,27(9):21-27.
[18]HANSON P M,LICARDO O,HANUDIN,et al. Diallel analysis of bacterial wilt resistance in tomato derived from different sources[J]. Plant Disease,1998,82(1):74-78.
[19]NETTANCOURT D. The relationship of growth-rate and apical size to differences in the radiation responses of closely related genotypes of tomatoes[J]. Radiation Botany,1969,9(4):297-311.
[20]李懋学,张杶方. 植物染色体研究技术[M]. 哈尔滨:东北林业大学出版社,1991:142-148.
[21]ARUMUGANATHAN K,EARLE E D. Estimation of nuclear DNA content of plants by flow cytometry[J]. Plant Molecular Biology Reporter,1991,9(3):229-233.
[22]REYNOIRD J P,CHRIQUI D,NOIN M,et al. Plant-regeneration from invitro leaf culture several Gerbera species[J]. Plant Cell,Tissue and Organ Culture,1993,33(2):203-210.
[23] 李畅,陈发棣,赵宏波,等. 栽培小菊17个品种的核型多样性[J]. 园艺学报,2008,35(1):71-80.
LI C,CHEN F D,ZHAO H B,et al. Kayrotype divesrity of 17 chyrsanthemum cultivars with small inflorescences[J]. Acta Horticulturae Sinica,2008,35(1):71-80.
[24] 詹园凤,党选民,曹振木,等. 两个茄子品种的核型分析[J]. 植物遗传资源学报,2009,10(2):283-285.
ZHAN Y F,DANG X M,CAO Z M,et al. Karyotype analysis of two varieties ofSolanummelongenaL[J]. Journal of Plant Genetic Resources,2009,10(2):283-285.
[25]BEGUM R,BEGUM N,ZAMAN M A. Karyomorpholoogy and meiotic behaviour ofGerberaviridifoliaBailey[J]. Bangladesh Journal of Botany,2004,33(1):71-74.
[26] 吴琼. 黄褐棉、达尔文棉的原位杂交研究及棉属D基因组着丝粒FISH探针筛选[D]. 北京:中国农业科学院,2008.
WU Q. FISH study ofGossypiummuste,Gossypiumdarwiniiand isolation of centromere FISH probe of D genome species of Gossypium[D].Beijing: Chinese Academy of Agricultural Sciences(CAAS),2008.
[27] 李义良,赵奋成,张应中,等. 分子标记在松树遗传与进化研究中的应用[J]. 分子植物育种,2009,7(5):1004-1009.
LI Y L,ZHAO F C,ZHANG Y Z,et al. Applications of molecular marker on the research of pine genetics and evolution[J]. Molecular Plant Breeding,2009,7(5):1004-1009.
[28] 杜晓云,宿福园,张青林,等. 利用IRAP技术揭示部分柿属种间遗传关系[J]. 果树学报,2012,29(6):1004-1009.
DU X Y,SU F Y,ZHANG Q L,et al. Genetic relationships of some Diospyros spp. based on IRAP analysis[J]. Journal of Fruit Science,2012,29(6):1004-1009.
[29] 陈丽梅,李雪,杜捷,等. 兰州百合B染色体的初步研究[J]. 西北植物学报,2003,23(11):2001-2010.
CHEN L M,LI X,DU J,et al. Preliminary study on B-chromosomes ofLiliumdavidiivar.unicolor[J]. Acta Botanica Boreali-Occidentalia Sinica,2003,23(11):2001-2010.
[30] 姜立春,彭正松. B染色体的研究进展[J]. 吉林师范大学学报(自然科学版),2005(3):51-54.
JIANG L C,PENG Z S. The study progress on the B chromosome[J]. Journal of Jilin Normal University (Natural Sciences Edition),2005(3):51-54.
[31]PLOWMAN A B. Selectively advantageous effects of B chromosomes on germination behaviour inAlliumschoenoprasumL[J]. Heredity,1994,72(6):587-593.
[32]VOSA C G. The ecology of B-chromosomes inListeraOvata(L.) R. Br. (Orchidaceae)[J]. Caryologia,1983,36(2):113-120.
【中文责编:成文 英文责编:李海航】
Chromosomal Karyotype and Ploidy Analysis of Common Varieties of Gerbera jamesonii hybr
LI Shun, WANG Yaqin*
(Guangdong Provincial Key Lab of Biotechnology for Plant Development, School of Life Science, South China Normal University, Guangzhou 510631,China)
The chromosomal karyotypes of three common varieties ofGerberajamesoniihybr were analyzed using the conventional root-tip squashing technology and their ploidy detection was carried out by flow cytometry. The results show that the three varieties ofGerberajamesoniihybr tested are all diploid. The “Shenzhen No.5” had a karyotype formula of “2n=2x=50=2M+34m+14sm”, the chromosome relative length index of “2n=6L+12M2+24M1+8S”, and the asymmetry coefficient of “AS.K% = 60.09%”, which belongs to the“2C”type according to Stebbins standard karyotype classification. The “Xiangbin” had a karyotype formula of “2n=2x=50+B=36m+12sm+2st+B”, the chromosome relative length index of “2n=8L+10M2+16M1+16S”, and the asymmetry coefficient of “AS.K% =62.17%”, which belongs to the“2C”type. The “Datoufen” had a karyotype formula of “2n=2x=50+B=34m+12sm+4st+B”, the chromosome relative length index of “2n=8L+8M2+28M1+6S”, and the asymmetry coefficient of “AS.K% =62.21%”, which belongs to the“2B”type. In conclusion, the three varieties ofG.jamesoniihybr were different in chromosome length, position of centromere, B chromosome and karyotype.
Gerberajamesoniihybr; karyotype analysis; asymmetrical karyotype coefficient; ploidy analysis
2016-05-23 《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
国家自然科学基金(31672188);广东省科技计划项目(2015A020209156, 2015B020202007, 2015B020231009, 2013B020201003)
Q343.2+2
A
1000-5463(2016)06-0013-06
*通讯作者:王亚琴,教授,Email: yqwang@scut.edu.cn.
