小鼠成体肝脏前体细胞最佳培养条件探索
2016-12-12王飞董凌月安威
王飞,董凌月,安威
(首都医科大学细胞生物学系;肝脏保护与再生调节北京市重点实验室,北京 100069)
技术方法
小鼠成体肝脏前体细胞最佳培养条件探索
王飞,董凌月,安威*
(首都医科大学细胞生物学系;肝脏保护与再生调节北京市重点实验室,北京 100069)
目的 建立一种专门用于小鼠肝脏前体细胞的培养条件,并鉴定该条件在连续传代培养的过程中是否能够维持前体细胞良好的生长状态,并减少分化的发生。方法 配制4种不同配方的培养基,在连续传代过程中通过观察细胞形态学变化而选择适用的配方,并经Western blot检测细胞内肝细胞标志物白蛋白(albumin,ALB)、肝脏前体细胞标志物甲胎蛋白(α-fetoprotein,AFP)和胆管细胞标志物细胞角蛋白-19(cytokeratin-19,CK-19)表达量的变化,流式细胞术分析细胞周期,以及免疫荧光染色鉴定前体细胞标志物的表达以进一步验证选择配方的有效性。结果 使用第4种培养基进行培养时,细胞形状规则,边界清晰,生长活力较好,连续传代培养后细胞的形态未发生明显改变。Western blot检测显示,ALB、AFP和CK-19在P0代、P3代和P8代中的表达量没有显著改变。流式细胞术结果显示,经连续多次传代的细胞约76%的细胞处于G0/G1期,近24%的细胞处于S+G2/M期,而且约89%的细胞表达肝脏前体细胞标志物上皮细胞粘附分子(epithelial cell adhesion molecule,EpCAM)。免疫荧光染色进一步证实了大多数细胞表达EpCAM。结论 建立了合适的培养基配方可用于小鼠成体肝脏前体细胞的连续传代培养,为更加深入地研究肝脏前体细胞的机制与再生医学方面创造了前提条件。
小鼠成体肝脏前体细胞;连续传代;可塑性;培养条件
成体干细胞是存在于已经分化的组织器官中的未分化细胞,具有自我更新的能力,并在一定条件下可以分化为各种特异的细胞类型[1]。成体干细胞的研究起始于20世纪60年代对造血干细胞(hematopoietic stem cells,HSC)的研究[2]。近些年来肝脏成体干细胞的研究取得了很大的进步,早在1958年,Wilson和Leduc就在小鼠肝脏内发现了具有多向或双向分化潜能的肝脏前体细胞[3],后来又有人发现肝外来源,如从骨髓来源的肝脏干细胞;并根据来源不同,将其分为肝源性肝脏前体细胞和非肝源性肝脏前体细胞,前者主要指卵圆细胞[4],后者主要指来自于骨髓造血干细胞等的前体细胞。成体肝脏的卵圆细胞所占的比例不到肝脏细胞总数的1%,并且大都处于休眠状态,但当肝脏受到毒物损伤,如CCl4、乙硫氨酸,或部分切除后,卵圆细胞可增殖并且分化[5-8]。胡以平等采用倒千里光碱(retrosine,Rs)阻断本体的肝细胞增殖后,经肝脏部分切除作为促有丝分裂的信号,术后14d从小鼠肝脏分离得到的一类具有卵圆细胞性质的肝脏前体细胞[9],并将之命名为肝上皮前体细胞(liver epithelial progenitor cells,LEPCs)。LEPCs属于双潜能干细胞[10],而干细胞的培养相对于其它细胞而言需要的条件较为严格,一是需要保证其生长状态良好,二是要防止在传代的过程中出现分化,以维持其可塑性。
本研究对小鼠成体肝脏前体细胞LEPCs的培养条件进行了探索,先后使用了4种不同配方的培养基,首先从形态学的观察确定培养基的组成,并通过Western blot检测、流式细胞术及免疫荧光染色,验证了所选择的培养条件在连续传代培养的过程中,细胞生长状态良好,能较好地保持前体细胞的可塑性,为后续的深入研究提供了保障。
材料与方法
1 细胞
LEPCs由第二军医大学细胞生物学教研室胡以平教授赠予。
2 主要试剂
高糖DMEM培养基(美国Gibco/BRL公司);胎牛血清(美国Hyclone公司,德国ScienCell公司);mHGF(美国R&D systems公司);mEGF(美国 Cell Signaling Technology公司);胰岛素(美国Gibco/BRL公司);尼克酰胺(美国SUPELCO公司);BD CycletestTMPlus DNA Kit(美国BD公司);流式细胞术用PE标记EpCAM单克隆抗体(美国eBioscience公司);免疫荧光用EpCAM单克隆抗体(英国abcom公司);流式细胞术用FITC标记DLK1单克隆抗体(英国abcom公司);ALB多克隆抗体(美国Santa Cruz公司);AFP多克隆抗体(美国Santa Cruz公司);CK-19多克隆抗体(美国Santa Cruz公司);辣根过氧化物酶标记的抗GAPDH抗体(上海康成生物科技有限公司)。
3 培养基
条件1培养基:高糖DMEM、10%FBS、1%青霉素和链霉素(双抗)。
条件2培养基:高糖DMEM、10%FBS、1%双抗、10μg/ml胰岛素、1mmol/L GlutaMAX。
条件3培养基:高糖DMEM、10%FBS、1%双抗、0.1mmol/L β-巯基乙醇、10ng/ml肝细胞生长因子(hepatocyte growth factor,HGF)、10ng/ml上皮生长因子(epidermal growth factor,EGF)、10μg/ml胰岛素、0.1μmol/L地塞米松、10ng/ml尼克酰胺、50mg/ml庆大霉素。
条件4培养基:高糖DMEM、10%FBS、1%双抗、0.1mmol/L β-巯基乙醇、10ng/ml HGF、10ng/ml EGF、10μg/ml胰岛素、0.6mg/ml尼克酰胺、50mg/ml庆大霉素。
4 LEPCs的传代培养
将LEPCs分别置于上述不同配方的培养基中,于37℃无菌条件下,在含95%的相对湿度、5%CO2恒温二氧化碳培养箱中培养,每72~96h传代1次,并于传代过程中对细胞的状态进行观察。
5 Western blot检测
裂解培养的LEPCs提取细胞总蛋白,测定所提取样品蛋白质的含量。取50μg蛋白质95℃气浴变性5min后立即置于冰上。将样品置于10%SDS-聚丙烯酰胺凝胶中电泳2h,随后利用湿转的方法将蛋白质转印至PVDF膜上。在含5%脱脂奶粉的加入Tween-20 Tris盐缓冲液(Tris buffered saline with Tween-20,TBST)中将膜封闭1h,用抗体稀释液将肝细胞标志物白蛋白(albumin,ALB)、肝脏前体细胞标志物甲胎蛋白(α-fetoprotein,AFP)和细胞角蛋白-19(cytokeratin-19,CK-19)[11]的第一抗体按照合适的稀释比例进行稀释(ALB和AFP按1∶800稀释,CK-19的稀释比例为1∶500),将膜放入其中后放置于摇床上4°C过夜。TBST漂洗3次,按1∶5000的比例将第二抗体稀释后与膜室温摇床孵育1h,TBST再次漂洗3次,化学发光显色后于X线片上曝光,常规进行显影定影。目的抗体杂交后用洗膜液洗膜后,再次将膜与GAPDH单克隆抗体(按1∶8000稀释)孵育,作为实验内参。将显影后X线片结果扫描,利用Image J软件计算每个条带的灰度值。将每个样本的目的蛋白灰度值除以内参照(GAPDH)的灰度值,得到每个样本的目的蛋白相对含量,并以此比较不同样本间的表达差异。
6 细胞周期的流式细胞术分析
按照Cycle TESTTMPLUS DNA Reagent Kit说明书进行操作,具体步骤如下:将培养的LEPCs消化后用磷酸盐缓冲液(PBS,pH 7.4)收集制备单细胞悬液,加入75%乙醇固定,室温以400g转速离心5 min,弃掉上清,加入A溶液250μl,轻轻混合均匀后室温放置10min;加入200μl溶液B混合均匀,室温孵育10min,最后加入200μl碘化丙啶(PI)放置于冰上避光孵育10min后,用流式细胞仪检测细胞周期。
7 肝前体细胞标志物表达的流式细胞术分析
将培养的LEPCs消化后用PBS收集制备单细胞悬液,加入肝脏前体细胞标志物上皮细胞粘附分子(epithelial cell adhesion molecule,EpCAM)[12]和胚胎肝脏前体细胞标记物(δ-like 1 homologue,DLK1)[13]的流式抗体染色液,室温避光孵育1h,同时设立同型阴性对照组,用PBS洗3次后,加入500μl PBS重悬细胞,用流式细胞仪检测EpCAM和DLK1的表达。
8 免疫荧光检测染色
选择生长良好的细胞,用PBS洗去培养基后,4%多聚甲醛固定30min,0.5%Triton X-100轻摇通透细胞30min。加入正常山羊血清封闭液,轻摇封闭50 min。滴加兔抗小鼠EpCAM单克隆抗体(1∶150),4°C过夜。按1∶200稀释比例加入Alexa FluorⓇ488标记的山羊抗兔IgG,37°C孵育1h。吸弃第二抗体后,用PBS轻摇清洗3次,每次10min。加入 DAPI染液室温避光孵育30min,吸去染液,加入PBS,置于荧光显微镜下观察。阴性对照组将第一抗体替换为PBS。
9 统计学分析
应用SPSS 19.0(Statistic Package for Social Science,SPSS)统计学软件进行数据分析。计量资料以均数±标准差表示,组间采用t检验。P<0.05被认为差异具有统计学意义,实验至少重复3次。
结 果
1 条件4为LEPCs最佳传代培养条件

图1 应用4种不同培养基传代培养细胞的形态学观察。箭示细胞表面突起及模糊的边界;比例尺,50μmFig.1 Morphology of LEPCs in 4 different media during P0,P3 and P8.Arrows indicate cell surface protuberances and unclear boundaries;scale bar,50μm
为保证LEPCs在连续传代的过程中可以保持良好的生长状态及分化潜能,我们使用4种含不同物质的培养基进行培养,将第1代称为P0,传代后依次称为P1、P2及P3等。在连续传代培养的过程中,观察各培养条件对细胞形态的影响。结果显示,条件1的培养效果最差,随着传代的进行,细胞边界变得模糊,细胞形态更为扁平,细胞表面突起增加,传代时间延长,意味着传代后细胞与P0相比出现明显变化,条件1无法作为LEPCs连续传代培养的条件(图1)。条件2培养基的配方来自于文献中肝脏前体细胞的培养条件[9]。使用条件2后,细胞在P8代时形状相对条件1更为规则,但与P0代细胞相比边界出现模糊,传代时间明显增加,因此条件2仍不是最佳的选择(图1)。条件3培养基是根据已有的报道[14,15]加以改良而成。使用条件3培养基培养后,细胞的生长状态明显好于条件2,但P8代时,细胞的形状边界与P0相比仍有一些变化,而且传代时间也由72h延长至96h(图1)。条件4培养基是在条件3的基础上,将10-7mol/L地塞米松去除,并将尼克酰胺的含量由10ng/ml改为0.6mg/ml。使用条件4连续传代培养后,P8代的细胞形状仍如P0一样规则,边界清晰,且细胞的生长活力较好,传代时间也没有明显改变(图1)。因此后续的培养过程中均使用条件4的培养基配方。
2 条件4培养LEPCs细胞不改变细胞分子标志物的表达
为进一步明确条件4对LEPCs细胞状态的影响,我们首先使用Western blot方法分别检测P0、P3和P8LEPCs中肝细胞标志物ALB、肝前体细胞标志物AFP和CK-19蛋白质表达量的变化情况。结果显示,与P0代相比,P3代细胞中 ALB、AFP和 CK-19的蛋白质表达量没有发生明显的改变,P8代显示了相似的结果(图2)。这些结果说明在条件4的培养条件下,LEPCs细胞没有向肝脏细胞或胆管细胞进行分化,维持了细胞的分化潜能。
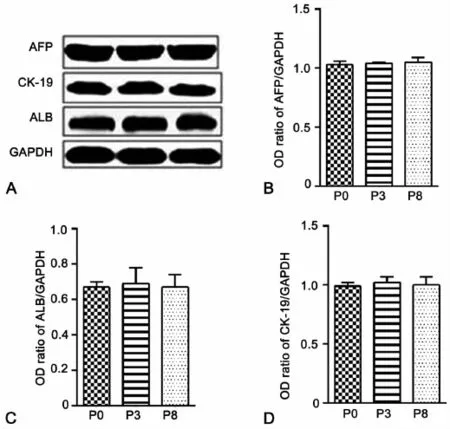
图2 LEPCs连续传代培养过程中肝细胞标志物和肝前体细胞标志物表达的Western blot检测。A,P0、P3和P8 LEPCs中AFP、ALB和CK-19表达的代表性Western blot;B至D,P0、P3和P8 LEPCs中AFP(B)、ALB(C)和CK-19(D)表达水平的统计学分析Fig.2 Western blot detection of the expression of ALB,AFP and CK-19 in LEPCs during serial passage.A,a representative Western blot result of ALB,AFP and CK-19 expression in P0,P3 and P8 LEPCs;B to D,statistical analysis of the expression levels of AFP(B),ALB(C)and CK-19(D) in P0,P3 and P8 LEPCs
为观察条件4对连续传代培养的LEPCs细胞的细胞周期的影响,我们进而应用流式细胞术分别分析了P0、P3和P8代细胞在细胞周期各时期的比例。结果显示(图3),P0代LEPCs细胞处于G0/G1期约77.7%,S+G2/M期的细胞大约占22.3%,P3代及P8代各期细胞所占比例没有明显变化,说明连续传代后LEPCs细胞仍具有较强的分裂增殖能力。
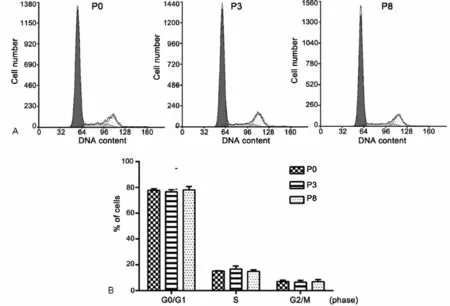
图3 LEPCs连续传代培养过程中细胞周期的流式细胞术分析。A,P0、P3和P8 LEPCs代表性细胞周期;B,P0、P3和P8 LEPCs细胞周期的统计学分析Fig.3 Flow cytometry analysis of the cell cycle of LEPCs during serial passage.A,representative cell cycles of P0,P3 and P8 LEPCs;B,statistical analysis of the cell cycles of P0,P3 and P8 LEPCs
EpCAM(epithelial cell adhesion molecule)是一种上皮细胞黏附分子,参与调节细胞间的黏附,介导细胞间的信号转导、并参与细胞的迁移、增殖与分化等过程,可作为肝脏前体细胞的标志分子[12]。将LEPCs连续传代培养6个月后,利用流式细胞仪对LEPCs细胞的肝脏前体细胞标志物的表达进行了检测。连续多次传代后,EpCAM阳性细胞可占到总细胞数的89%(图4)。在检测EpCAM的同时,我们又对胚胎肝脏前体细胞的标志物DLK1的表达进行了分析,发现DLK1的表达很低,阳性细胞仅占总细胞数的12%(图4)。为验证流式细胞术的结果,我们又应用免疫荧光的方法检测了EpCAM在多次传代的LEPCs细胞中的表达情况。结果显示,荧光显微镜下可观察到绝大多数细胞表面显示绿色荧光,而阴性对照则没有绿色荧光(图5)。这些结果均说明,连续多次传代培养的LEPCs仍保持良好的增殖能力和未分化状态,也进一步表明条件4是一种比较理想的培养LEPCs的培养基。
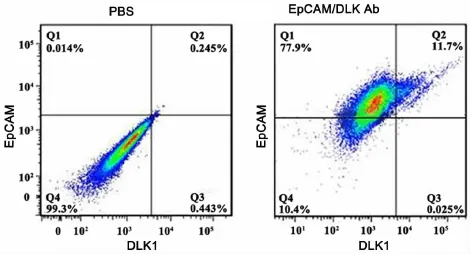
图4 肝前体细胞标志物在连续传代6个月的 P8 LEPCs中表达的流式细胞术检测Fig.4 Flow cytometry detection of hepatic progenitor cell markers in P8 LEPCs after serial passage for 6 months
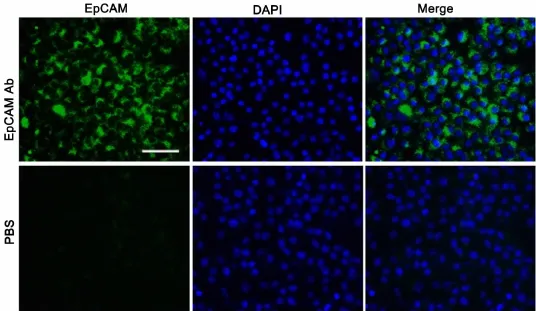
图5 EpCAM在连续传代6个月的 P8 LEPCs中表达的免疫荧光检测。比例尺,50μmFig.5 Immunofluorescent detection of EpCAM in P8 LEPCs after serial passage for 6 months.Scale bar,50μm
讨 论
在长期的慢性肝脏疾病或急性的肝损伤情况下,位于门静脉周围的成体肝脏前体细胞即卵圆细胞可被激活[16]。激活后的卵圆细胞可进入肝小叶,并分化为肝细胞和胆管细胞,因此卵圆细胞是一种具有双向分化潜能的干细胞[17,18]。研究成体肝脏前体细胞的重要意义除可以进行分化机制的研究,临床治疗的应用外,还寄希望于通过构建组织支架,接种前体细胞生成新的器官并应用于移植中,但目前该领域的研究仍然在探索中[18]。应用成体肝脏前体细胞的基础是分离得到前体细胞,并且在传代培养过程中可以保持良好的状态及分化潜能。虽然目前对成体肝脏前体细胞的培养条件已经积累了一定的资料[19],但由于长期传代培养所需要的培养条件相对比较苛刻,仍面临着没有相对统一标准的问题,在培养条件上仍然处于摸索的阶段。
本实验中所使用LEPCs是经单细胞克隆培养所得到的一种类似于肝脏卵圆细胞的成体肝脏前体细胞[9],具有双向分化的潜能。我们在对LEPCs的连续传代培养过程中发现培养基配方的不同会直接影响到LEPCs的生长状态及分化潜能,因此探索其合适的培养条件对后续依赖于LEPCs的肝脏前体细胞分化机制及治疗的研究具有十分重要的意义。本实验配制了4种具有不同配方的培养基对LEPCs细胞进行连续的传代培养。条件4在去除了条件3中的地塞米松,并增加了尼克酰胺的浓度后,使LEPCs细胞的状态在连续传代的过程中没有发生明显改变,而且肝脏前体细胞的标志物AFP始终维持着和P0代细胞相似的水平,同时成熟肝细胞的标志物ALB和胆管细胞的标记物CK-19的表达均未发生明显的增加。尼克先酰胺与葡萄糖代谢相关,细胞培养时加入可显著增加NAD+的含量,促进ATP合成和能量代谢,更好的维护细胞的生长与繁殖。为进一步确认上述结果,我们延长了连续传代的时间,在6个月后又分析了EpCAM的表达水平,发现表达Ep-CAM的细胞仍占了绝大多数。这些结果意味着LEPCs在条件4培养下,可以一直维持增殖状态,而且保持了良好的分化潜能。
DLK1又称为脂肪前体细胞因子1(preadipocyte factor 1,Pref-1),具有抑制脂肪前体细胞分化的作用。内胚层起源的肝脏前体细胞中有DLK1的表达,因此可以将其看作为胚胎肝脏前体细胞的标记物[13]。我们也通过流式细胞分析检测了连续传代后LEPCs中DLK1的表达情况,发现DLK1的表达水平很低,仅有约11%的细胞表达DLK1,这也说明了成体来源的前体细胞与胚胎来源的前体细胞在蛋白表达水平上的差别,也意味着其分化机制及可塑性具有一定的区别。
本实验确定了LEPCs细胞合适的培养条件,为LEPCs细胞相关的研究奠定了基础。
[1]Gian,VG,Moreb JS,Abdel-Mageed A,et al.Successful salvage using mismatched umbilical cord blood transplant in an adult with recurrent acute myelogenous leukemia failing autologous peripheral blood progenitor cell transplant:a case history and review.Bone Marrow Transplant,1998,21(12):1197-1200.
[2]Birbrair,A,Frenette PS.Niche heterogeneity in the bone marrow.Ann N Y Acad Sci,2016,1370(1):82-96.
[3]WILSON,JW,LEDUC,EH.Role of cholangioles in restoration of the liver of the mouse after dietary injury.J Pathol Bacteriol,1958,76(2):441-449.
[4]FARBER,E.Similarities in the sequence of early histological changes induced in the liver of the rat by ethionine,2-acetylamino-fluorene,and3′-methyl-4-dimethylaminoazobenzene.Cancer Res,1956,16(2):142-148.
[5]Fan BL,Zhang WL,Du MH,et al.Differential expression of the polo-like kinase 1(plk1)gene during liver regeneration and hepatic oval cell proliferation.Zhonghua Gan Zang Bing Za Zhi,2013,21(9):705-706.
[6]Chen ZK,Shan YF,He B,et al.Role of miR-21 in rat hepatic oval cell proliferation and activation.Zhonghua Gan Zang Bing Za Zhi,2014,22(11):854-859.
[7]Tarlow BD,Finegold MJ,Grompe M.Clonal tracing of Sox9+liver progenitors in mouse oval cell injury.Hepatology, 2014,60(1):278-289.
[8]Wang HY,Yang SL,Liang HF,et al.HBx protein promotes oval cell proliferation by up-regulation of cyclin D1 via activation of the MEK/ERK and PI3K/Akt pathways. Int J Mol Sci,2014,15(3):3507-3518.
[9]Li WL,Su J,Yao YC,et al.Isolation and characterization of bipotent liver progenitor cells from adult mouse.Stem Cells,2006,24(2):322-332.
[10]向导,胡以平.肝干细胞的几个生物学问题.生命科学,2009(05):710-714.
[11]Sun GY,Dong LY,An W.Involvement of hepatic stimulator substance in the regulation of hepatoblast maturation into hepatocytes in vitro.Stem Cells Dev,2014,23(14):1675-1687.
[12]Turner W,Kulik M,Sherwood S,et al.Human hepatic stem cells from fetal and postnatal donors.J Exp Med, 2007,204(8):1973-1987.
[13]Vestentoft PS,Jelnes P,Andersen JB,et al.Molecular constituents of the extracellular matrix in rat liver mounting a hepatic progenitor cell response for tissue repair.Fibrogenesis Tissue Repair,2013,6(1):21.
[14]Yu B,He ZY,You P,et al.Reprogramming fibroblasts into bipotential hepatic stem cells by defined factors.Cell Stem Cell,2013,13(3):328-340.
[15]Huch M,Dorrell C,Boj SF,et al.In vitro expansion of single Lgr5+liver stem cells induced by Wnt-driven regeneration.Nature,2013,494(7436):247-250.
[16]Libbrecht L,Desmet V,Van Damme B,et al.Deep intralobular extension of human hepatic'progenitor cells'correlates with parenchymal inflammation in chronic viral hepatitis:can‘progenitor cells’migrate?J Pathol,2000,192 (3):373-378.
[17]Spagnoli FM,Amicone L,Tripodi M,et al.Identification of a bipotential precursor cell in hepatic cell lines derived from transgenic mice expressing cyto-Met in the liver.J Cell Biol,1998,143(4):1101-1112.
[18]Strick-Marchand H,Morosan S,Charneau P,et al.Bipotential mouse embryonic liver stem cell lines contribute to liver regeneration and differentiate as bile ducts and hepatocytes.ProcNatlAcadSciUSA,2004,101(22): 8360-8365.
[19]Knoll A,Brockmeyer T,Chevalier R,et al.Adult Rat Bone Marrow-Derived Stem Cells Promote Late Fetal Type II Cell Differentiation in a Co-Culture Model.Open Respir Med J,2013.7:46-53.
Exploration of the optimal culture conditions for adult mouse hepatic progenitor cells
Wang Fei,Dong Lingyue,An Wei*
(Department of Cell Biology;Municipal Key laboratory for Liver Protection and Regulation of Regeneration,Capital Medical University,Beijing 100069,China)
Objective To establish a specific formula of culture condition for mouse hepatic progenitor cells and identify whether the cells can be maintained in good condition and kept from differentiation during serial passage under this condition.Methods Four different types of media were prepared.The optimal medium was determined based on the morphological changes during serial passage. Expression levels of hepatic marker albumin(ALB),hepatic progenitor cell marker alpha-fetoprotein(AFP),and bile duct epithelium marker cytokeratin-19(CK-19)were detected by Western blot.The cell cycle was analyzed by flow cytometry,and the expression of progenitor cell markers was verified by immunofluorescent staining to further assess the effectiveness of the selected culture medium. Results Cells in the 4th culture medium grew energetically with regular shapes and clear boundaries,and no obvious change in morphology was observed after serial passage.Western blot revealed that ALB,AFP,and CK-19 were expressed stably in P0,P3 and P8 cells.Flow cytometry results showed that after serial passage,about 76%of the cells were in G0/G1 stage and approximately 24%of the cells were in S+G2/M stage,while 89%of the cells expressed epithelial cell adhesion molecule(EpCAM),a typical hepatic progenitor cell marker.The expression of EpCAM was further confirmed by immunofluorescent staining.Conclusion A specific formula of medium for serial passage of adult mouse hepatic progenitor cells has been established,which provides preconditions for further study of the mechanism of hepatic progenitor cells growth and regenerative medicine.
Adult mouse hepatic progenitor cells;serial passage;plasticity;culture condition
Q253
A
10.16705/j.cnki.1004-1850.2016.05.013
2016-06-10
2016-09-20
国家自然科学基金(31371169)
王飞,男(1984年),汉,硕士研究生
(To whom correspondence should be addressed):anwei@ccmu.edu.cn
