高分离快速液相色谱-四极杆飞行时间质谱法检测人参皂苷Re在大鼠体内的分布
2016-12-10王恩鹏斋藤哲男陈长宝刘淑莹
王恩鹏,斋藤哲男,孙 岩,陈长宝,刘淑莹
(1.长春中医药大学,吉林省人参科学研究院,吉林 长春 130117;2.新泻药科大学应用生命科学研究院,日本 新泻市 956-8603)
高分离快速液相色谱-四极杆飞行时间质谱法检测人参皂苷Re在大鼠体内的分布
王恩鹏1,斋藤哲男2,孙 岩1,陈长宝1,刘淑莹1
(1.长春中医药大学,吉林省人参科学研究院,吉林 长春 130117;2.新泻药科大学应用生命科学研究院,日本 新泻市 956-8603)
建立了高分离快速液相色谱-四极杆飞行时间质谱(RRLC-Q-TOF MS)法检测大鼠尾静脉注射人参皂苷Re(G-Re)后,不同组织(心、肝、脾、肺、肾、脑)中G-Re的分布情况。样本经蛋白沉淀处理,Supelco Ascentis®Express C18色谱柱(50 mm×3.0 mm×2.7 μm)分离,采用含0.1%甲酸的水溶液(A)-乙腈(B)为流动相,梯度洗脱,以人参皂苷Rc(G-Rc)作为内标,在电喷雾负离子模式下检测。结果表明:组织匀浆标准曲线的线性范围为10~20 000 μg/L,线性关系良好(r>0.99),最低检出限(S/N=3)为3 μg/L,最小定量限为10 μg/L;准确度、日内和日间精密度、提取回收率均符合生物样品的分析要求。大鼠尾静脉注射20 mg/kg G-Re溶液后,在大鼠体内不同组织中均能检测到G-Re,主要分布在肺、脾、肾、心、脑、肝等器官,其中在肺中分布最多,在肝中分布最少。该方法简单、灵敏、快速、检出限低,适用于检测人参皂苷Re在生物体内的分布。
高分离快速液相色谱-四极杆飞行时间质谱(RRLC-Q-TOF MS);人参皂苷Re;静脉注射;组织分布
人参系五加科植物,被称为“百草之王”,在传统中医药中占据重要地位。目前,人参在中国、韩国、日本、俄罗斯、美国和加拿大[1]等国家被广泛种植,它作为一种补充食品深受人们欢迎[2-3]。人参皂苷Re是人参皂苷中的主要成分,具有良好的抗氧化、抗衰老、降血糖、降血脂等功效,对于缺血性心律失常、体液免疫和细胞免疫均有较好的作用[4-6],其结构示于图1。近年来,有许多关于人参皂苷Re的体内代谢及药代动力学研究的报道。如,Bae等[7]利用高效液相色谱法对人参皂苷Re的肠内菌群代谢产物进行检测,结果表明,G-Re在体内代谢的主要初级产物为人参皂苷Rg1,其继续水解可生成人参皂苷Rh1和Rf1。陈广通等[8]利用HPLC-ESI-MS/MS法从口服G-Re大鼠的粪便中检测出6个代谢产物,分别是20(S)-人参皂苷Rg2、20(S)-人参皂苷Rh1、20(R)-人参皂苷Rh1、人参皂苷F1、3-羰基人参皂苷Rh1和原人参三醇。彭缨等[9]采用HPLC法测定大鼠静脉注射3种不同剂量(20、30、40 mg/kg)G-Re后的血药浓度,结果表明,3组大鼠的药代动力学参数成双隔室型,在该剂量范围内 G-Re的消除为线性动力学。近年来,人们在研究人参皂苷血浆药物浓度的同时,其组织分布也受到重视,两者结合能更好地阐明人参皂苷Re的体内代谢过程,有效地评价生物利用度[10]。
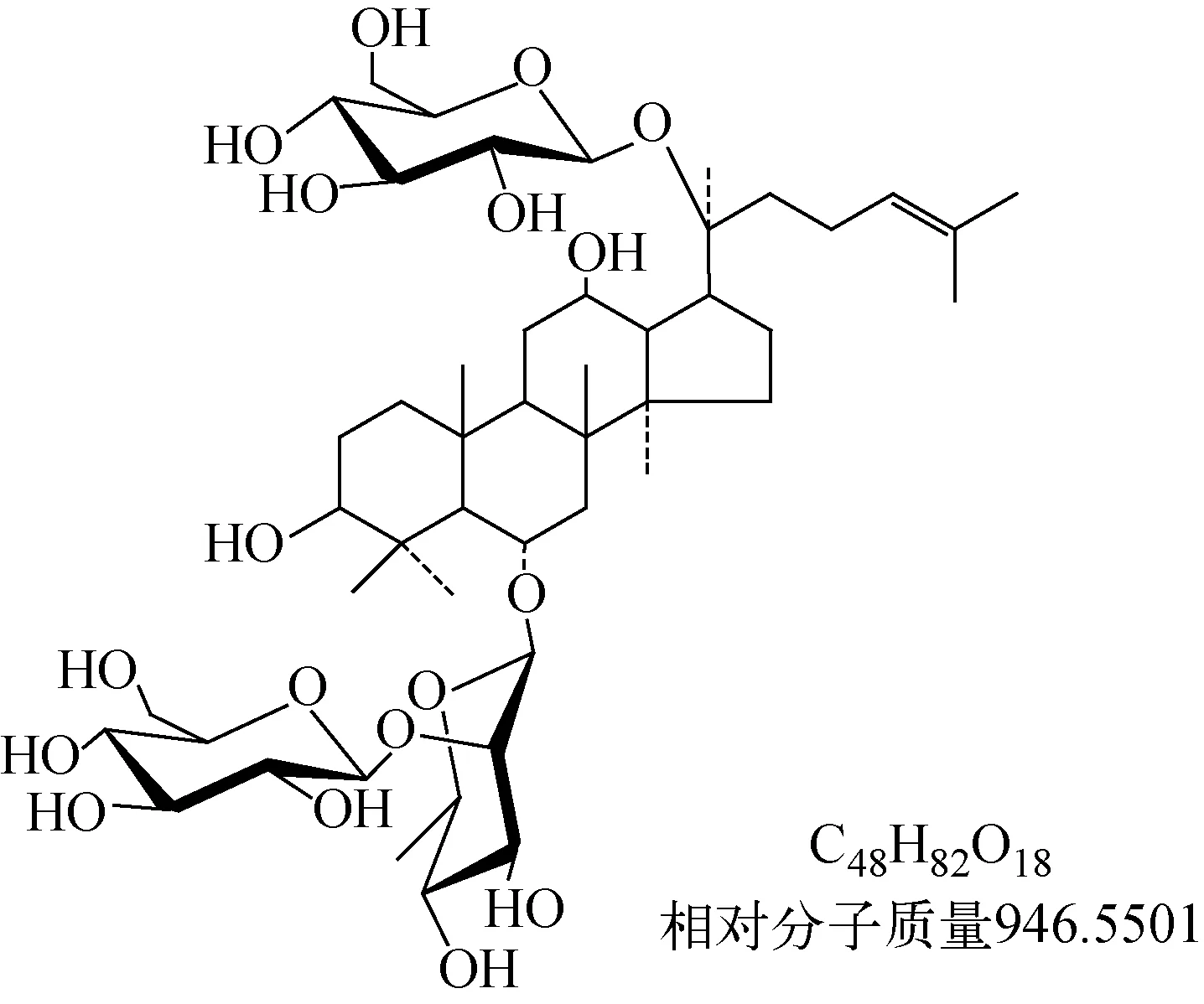
图1 人参皂苷Re的化学结构式
目前,人参皂苷的分析多采用高效液相色谱-紫外检测(HPLC-UV)法,但该方法的分析时间长[11-12],特别是分析生物样本时需要30 min以上[13]。且由于生物样品中内源性干扰较多,影响了测定的准确度和灵敏度,液相色谱在没有标准品的情况下,不利于目标成分的准确测定和确认。高分离快速液相色谱-四极杆飞行时间质谱(RRLC-Q-TOF MS)法作为中药生物样品多成分复杂体系的分析工具,将快速液相色谱仪与高分辨质谱仪连接,液相色谱部分采用高压双元泵,提高了流动相的压力与流速,同时使用2.7 μm粒径填料的色谱柱,可明显加快分析速度。与常规的HPCL-UV相比,该方法具有准确度好、专属性强、灵敏度高、分析速度快等优点[14-18],能够提高生物样品的分析效率,现已被广泛用于药物鉴定、代谢组学、药代动力学等领域的研究[11-12,19-21]。
本研究拟采用RRLC-Q-TOF MS法考察大鼠静脉注射人参皂苷Re后的组织分布特征,并对其进行专属性、线性范围及检测限、精密度与准确度、提取回收率、检测限和稳定性的考察,旨为进一步开发利用人参皂苷Re奠定基础。
1 实验部分
1.1 仪器与试剂
Agilent 1200系列RRLC系统、Agilent 6520 Q-TOF质谱仪:美国Agilent公司产品,配有ESI离子源和Mass Hunter数据处理系统;WS2-261-79型电热恒温水浴箱:北京长安科学仪器厂产品;高速冷冻离心机:德国Eppendorf公司产品;DY89-Ⅱ型电动玻璃匀浆机:宁波新芝生物科技股份有限公司产品;超低温冰箱:美国Thermo公司产品;MTN-2800D型氮吹仪:天津奥特塞恩斯仪器有限公司产品。
人参皂苷Re、Rc标准品(色谱级,纯度>98%):购自吉林大学药学院;乙腈(色谱级):美国Tedia公司产品;甲酸(色谱级):美国Sigma公司产品;超纯水:由美国Millipore公司的Milli-Q系统制得。
1.2 实验条件
1.2.1 色谱条件 Supelco Ascentis®Express C18 HPLC色谱柱(50 mm×3.0 mm×2.7 μm);流动相:A为含0.1%甲酸的超纯水,B为乙腈;梯度洗脱:0~15 min、20%~40%B,15~20 min、40%~50%B,20~22 min、50%~100%B,22~25 min、100%B;柱温35 ℃;流速0.3 mL/min;进样量5 μL。
1.2.2 质谱条件 电喷雾负离子电离模式,气体温度350 ℃,干燥气流速9 L/min,喷雾气压276 kPa,毛细管电压3.5 kV,裂解电压175 V,锥孔电压65 V,质量扫描范围m/z50~1 000。样品测试前,使用调谐液校正质量轴。
1.3 溶液配制和样品处理
1.3.1 标准溶液和内标溶液的配制 精密称取1.00 mg人参皂苷Re标准品,用甲醇稀释至1 mL,配制成浓度为1 g/L的母液;然后用甲醇稀释成浓度为1、10、100 mg/L的工作液。精密称取1.00 mg人参皂苷Rc标准品,用甲醇定容至2 mL,配制成浓度为0.5 g/L的内标溶液。
1.3.2 标准曲线的绘制 分别取100 μL空白大鼠的组织(心、肺、脾、肾、脑、肺)匀浆清液于1.5 mL Eppendorf管中。向每个样品中加入不同质量的人参皂苷Re,配制成浓度分别为10、20、50、100、200、500、1 000、2 000、5 000、10 000、20 000 μg/L的系列标准溶液;加入10 μL 1 g/L人参皂苷Rc作为内标,用移液枪混匀,再加入300 μL甲醇,涡旋5 min,以13 000 r/min离心10 min,取上清液;经0.45 μm滤膜过滤,进样检测。以人参皂苷Re浓度为横坐标x,G-Re与G-Rc的峰面积比值(A/Ai)为纵坐标y,进行线性回归,绘制标准曲线。
1.3.3 动物实验 25只雄性Wistar大鼠,体重(200±30) g,动物合格证号:SCXK-(吉)2011-0007,由长春生物制品有限公司动物中心提供。在标准环境下(湿度(50±10)%,温度(25±2) ℃,12 h 昼夜循环)进食进水,实验前禁食12 h。
1.3.4 样品的采集与制备 将25只大鼠随机分为5组,其中1组为空白对照组,其余4组分别在尾静脉注射20 mg/kg人参皂苷Re,在0.5、1、2、4、8 h后处死,取心、肝、脾、肺、肾、脑等脏器,以蒸馏水洗净,称其质量;按质量-体积比1∶5向各组织中加入生理盐水,冰上匀浆后,置于预置好的4 ℃高速冷冻离心机内,以3 000 r/min离心10 min,取上清液于冻干机内冻干;加入1 mL甲醇,涡旋5 min,超声溶解15 min,转移至1.5 mL Eppendorf管内,置于预置好的4 ℃高速冷冻离心机内,以13 000 r/min离心10 min,取上清液;45 ℃下氮气吹干,向每个样品中加入10 μL 1 g/L人参皂苷Rc内标溶液,用流动相定容至1 mL,制成浓度为10 mg/L的溶液;经0.45 μm滤膜过滤,置于4 ℃冰箱中,待测。
2 结果与讨论
2.1 专属性考察
以大鼠的肺脏组织为例,在电喷雾负离子模式下,其总离子流图示于图2。通过比较供试空白组织色谱图、向空白组织中加入待测物和内标物后得到的总离子流图(TIC)、提取离子流图(EIC)和给药后不同时间测得的色谱图,发现组织中所含内源性物质不干扰被测物和内标物的测定,被测物峰形良好;在1.2.1和1.2.2节条件下,G-Re和内标G-Rc的保留时间分别为 6.956 min和13.410 min。
2.2 线性范围及检测限
大鼠组织样本的线性范围和标准曲线列于表1。可以看出:该方法的线性关系良好(r>0.99),以S/N≥3计算方法的最低检出限(LLOD)为3 μg/L。
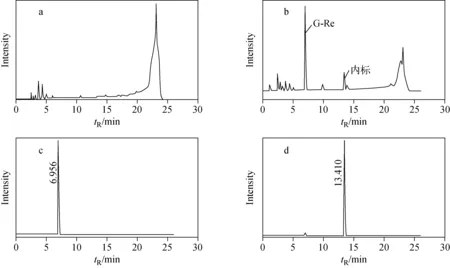
注:a.空白大鼠肺脏总离子流图;b.向空白组织中加入G-Re与内标物的总离子流图;
表1 大鼠组织样本的标准曲线,相关系数和线性范围
Table 1 Standard calibration curves,correlation coefficients and liner ranges of G-Re in rats tissue samples

组织样本线性回归方程相关系数(r)线性范围/(μg/L)心y=0.0283x—0.02730.999310~20000肝y=0.0322x—0.01650.997110~20000脾y=0.0449x—0.05040.996910~20000肺y=0.0249x+0.03870.997610~20000肾y=0.0219x+0.01580.998610~20000脑y=0.0284x—0.02860.999410~20000
2.3 精密度与准确度
按1.3.2节方法分别配制G-Re各组织匀浆液高、中、低3个浓度(3、30、300 μg/L)的质量控制(QC)样品,每个浓度进行5样本分析,连续测定3 d,为保持实验条件一致,标准曲线的测定与上述样品测定同时进行。根据当日标准曲线计算QC样品浓度(C1~C3),与配制浓度(C1′~C3′)对照,将QC样品的结果进行计算,通过每一浓度的2种处理方法的浓度比值(C/C′)计算回收率,得出方法准确度,通过计算二者的浓度相对标准偏差得出方法的精密度。方法的准确度和精密度列于表2。结果表明:G-Re在各组织匀浆液中的日内和日间精密度RSD均小于20%,准确度在90.0%~110.0%范围内。
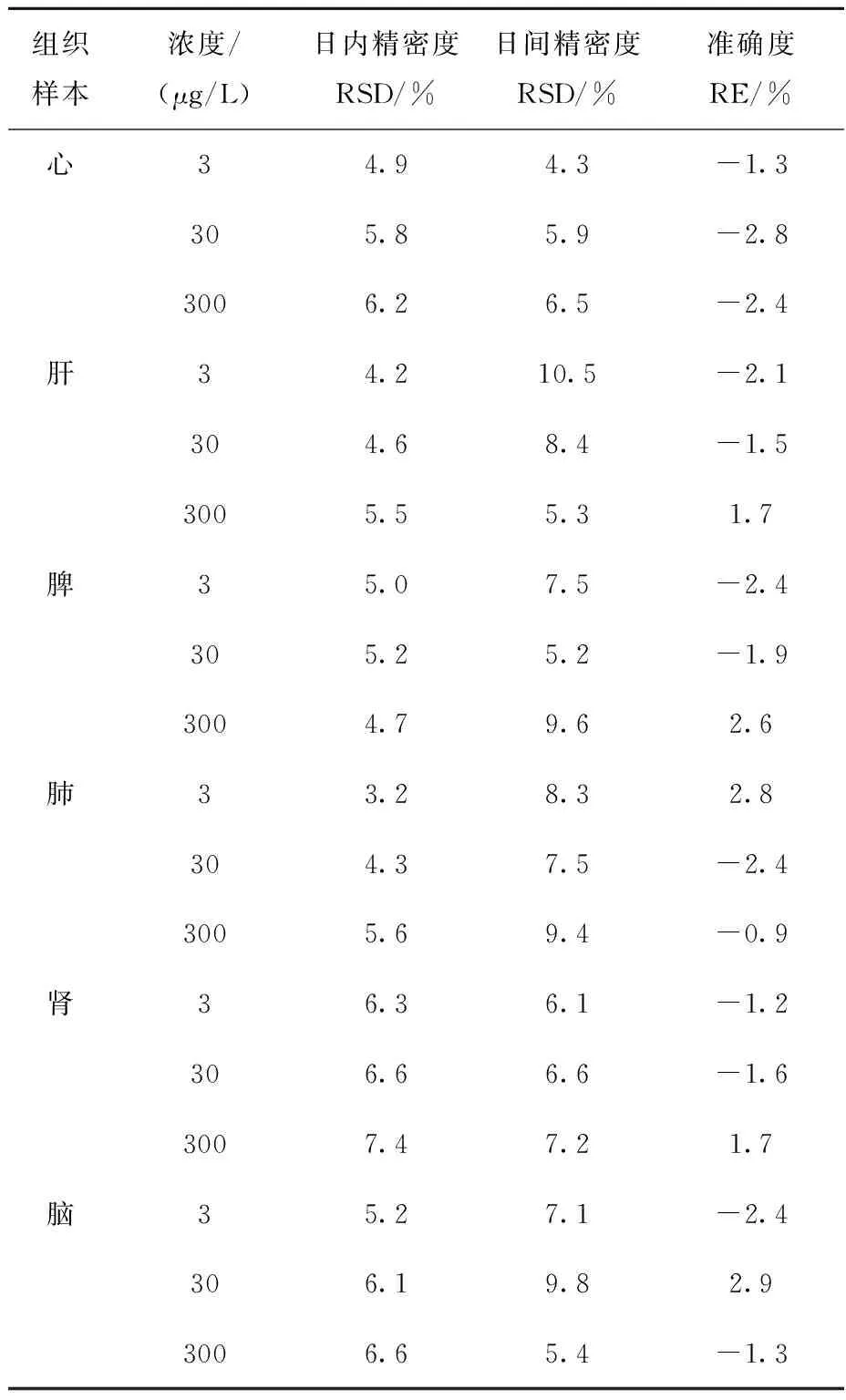
表2 质量控制样品的日内、日间精密度和准确度(n=5)
2.4 提取回收率
按1.3.2节方法分别配制G-Re各组织匀浆液高、中、低3个浓度的QC样品,每个浓度进行5样本分析,连续测定3 d,为保持实验条件一致,标准曲线的测定与上述样品测定同时进行。根据当日标准曲线计算QC样品浓度,与配制浓度对照,将QC样品的相应峰面积记为A1;另取各空白组织匀浆液,离心后得上清液,分别加入上述低、中、高浓度的标准溶液(每个浓度进行3样本分析)进样分析,获得相应的峰面积值A2;以每一浓度的2种处理方法的峰面积比值(A1/A2)计算提取回收率。以肺匀浆液为例,提取回收率分别为(91.6±1.0)%、(90.9±3.9)%、(93.2±2.3)%,内标(IS)回收率为(98.2±1.1)%。
2.5 稳定性考察
按1.3.2节方法分别配制G-Re各组织匀浆液高、中、低3个浓度的QC样品,每个浓度进行3样本分析。分别将样品在室温(约20 ℃) 下放置 6 h、4 ℃下冷藏8 h、-20 ℃冻融循环3次,经处理后进样测定,考察大鼠的各个组织匀浆液中G-Re在室温、冷藏、反复冻融条件下的稳定性。以每一浓度3样本分析,3种情况下得到的G-Re峰面积与时间点的偏差均在15%以内,说明各组织匀浆液中的待测物稳定性良好。
2.6 组织分布考察
大鼠尾静脉注射20 mg/kg G-Re溶液后,在大鼠体内不同时间点(0.5、1、2、4、8 h)各组织中G-Re的分布情况示于图3。结果表明:在心、肝、脾、肺、肾、脑等6种组织器官中均能检测到G-Re,G-Re在各组织中的分布迅速且具有不均衡性,其含量排序为:肺>脾>肾>心>脑>肝。
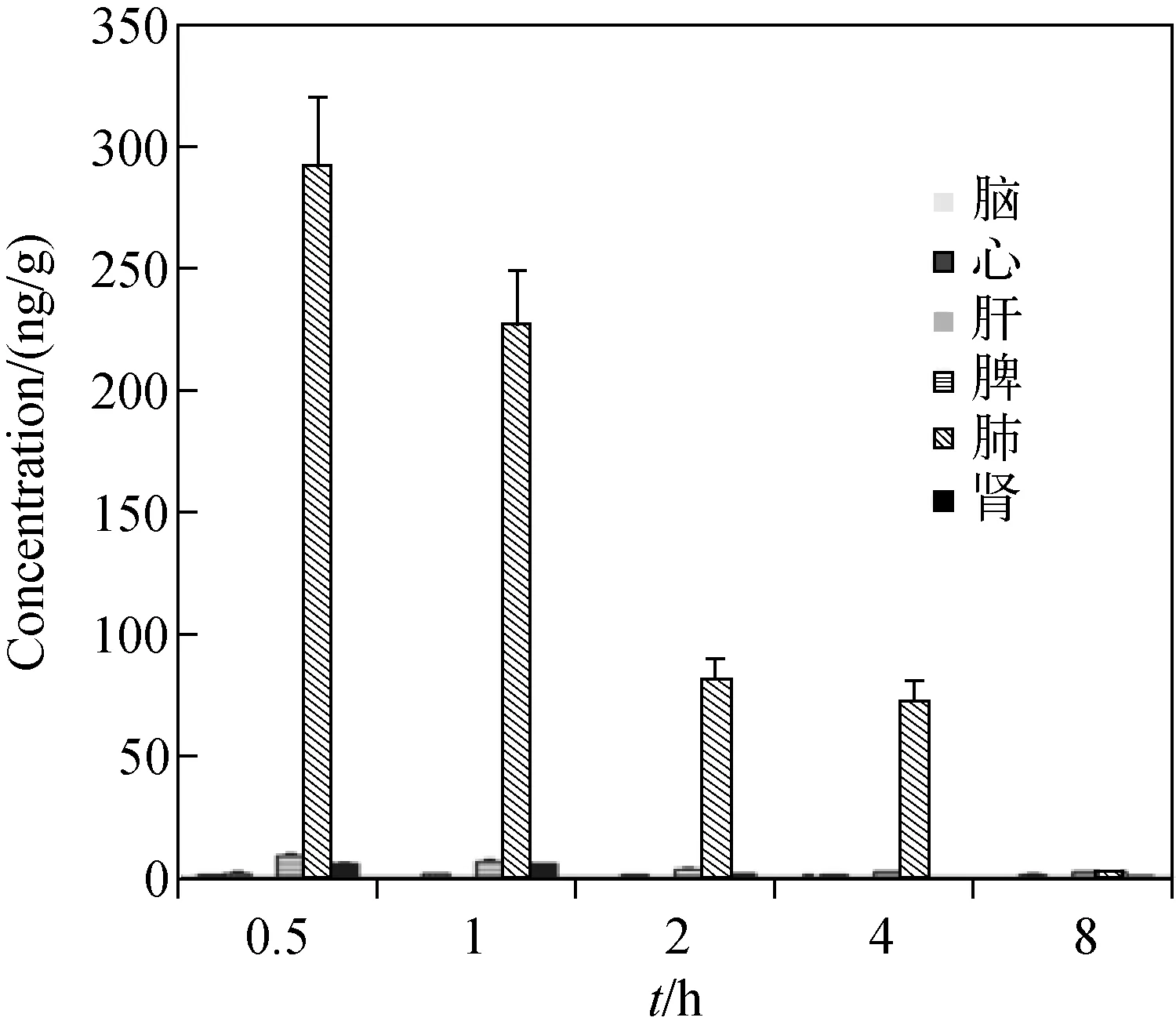
图3 大鼠尾静脉注射20 mg/kg G-Re后,G-Re在各组织中的浓度变化
3 结论
本研究建立了RRLC-Q-TOF MS法测定人参皂苷Re在大鼠体内的分布,该方法简便快速、专属性强、灵敏度高、分析效率好,可弥补人参皂苷类物质在紫外吸收差、检测限值高的缺陷。RRLC液相色谱仪结合2.7 μm粒径填料色谱柱的使用,提高了色谱的分离效率,加快了分析速度。质谱检测采用电喷雾负离子电离模式,在尾静脉注射G-Re大鼠的6种主要组织器官中均能检出G-Re,不同组织样本中的G-Re定量范围在10~20 000 μg/L之间。该方法适用于生物样品中人参皂苷类成分的高通量分析。
[1] LU J M, YAO Q, CHEN C, et al. Ginseng compounds: An update on their molecular mechanisms and medical applications[J]. Current Vascular Pharmacology, 2009, 7(3): 293-302.
[2] ZUCCHI O L, MJ O J E. Characterization of hypoglycemiant plants by total reflection X-ray fluorescence spectrometry[J]. Biological Trace Element Research, 2005, 103(103): 277-290.
[3] MURTHY H N, GEORGIEV M I, KIM Y S, et al. Ginsenosides: Prospective for sustainable biotechnological production[J]. Applied Microbiology & Biotechnology, 2014, 98(14): 6 243-6 254.
[4] 何道同,王兵,陈珺明. 人参皂苷药理作用研究进展[J]. 辽宁中医药大学学报,2012,(7):118-121.
HE Daotong, WANG Bing, CHEN Junming, et al. Research progress on pharmacological effects of ginsenoside[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2012, (7): 118-121(in Chinese).
[5] ATTELE A S, ZHOU Y P, XIE J T, et al. Antidiabetic effects ofPanaxginsengberry extract and the identification of an effective component[J]. Diabetes, 2002, 51(6): 1 851-1 858.
[6] ZHANG Z G, LI X Y, LV W S, et al. Ginsenoside Re reduces insulin resistance through inhibition of c-Jun NH2-terminal kinase and nuclear factor-κB[J]. Molecular Endocrinology, 2008, 22(1): 186-195.
[7] BAE E A, SHIN J E, KIM D H. Metabolism of ginsenoside Re by human intestinal microflora and its estrogenic effect[J]. Biological and Pharmaceutical Bulletin, 2005, 28(10): 1 903-1 908.
[8] 陈广通,杨敏,果德安. 人参皂苷Re在大鼠体内的代谢研究[J]. 中国中药杂志,2009, 34(12):1 540-1 543.
CHEN Guangtong, YANG Min, GUO Dean, et al. Metabolic study of ginsenoside Re in rats[J]. China Journal of Chinese Materia Medica, 2009, 34(12): 1 540-1 543(in Chinese).
[9] 彭缨,王淑君,潘卫三,等. 人参皂苷Re大鼠体内药物动力学研究[J]. 沈阳药科大学学报,2006,23(4):4-7.
PENG Ying, WANG Shujun, PAN Weisan. Pharmacokinetics of ginsenoside Re in rat[J]. Journal of Shenyang Pharmaceutical University, 2006, 23(4): 4-7(in Chinese).
[10]LEE J, LEE E, KIM D, et al. Studies on absorption, distribution and metabolism of ginseng in humans after oral administration[J]. Journal of Ethnopharmacology, 2009, 122(1): 143-148.
[11]陈英红,姜瑞芝,罗浩铭,等. 人参总皂苷提取物指纹图谱研究[J]. 中国实验方剂学杂志,2009,15(11):12-14.
CHEN Yinghong, JIANG Ruizhi, LUO Haoming, et al. Studies on the HPLC fingerprints of general ginsenosidein the extract of Ginseng Radix[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2009, 15(11): 12-14 (in Chinese).
[12]张金秋,夏娟,孙光芝,等. RP-HPLC法测定人参花中11个人参皂苷含量[J]. 药物分析杂志,2015,(9):1 596-1 600.
ZHANG Jinqiu, XIA Juan, SUN Guangzhi, et al. Determination of 11 kinds of ginsenosides fromGinsengBudby RP-HPLC[J]. Chinese Journal of Pharmaceutical Analysis, 2015, (9): 1 596-1 600(in Chinese).
[13]马静,李学林,唐进法,等. 不同途径给药参麦注射液中人参皂苷Rg1及Re在大鼠体内药代动力学研究[J]. 中药药理与临床,2012,(2):9-11.
MA Jing, LI Xuelin, TANG Jinfa, et al. Pharmacokinetic study on ginsenoside Rgl and Re in rats following intravenous and oral administration of Shenmai injection[J]. Pharmacology and Clinics of Chinese Materia Medica, 2012, (2): 9-11(in Chinese).
[14]WU W,QIN Q J, GUO Y Y, et al. Studies on the chemical transformation of 20(S)-protopanaxatriol (PPT)-type ginsenosides Re, Rg2, and Rf using rapid resolution liquid chromatography coupled with quadruple-time-of-flight mass spectrometry (RRLC-Q-TOF-MS)[J]. Journal of Agricultural and Food Chemistry, 2012, 60(40): 10 007-10 014.
[15]WEN X D, LIU E H, YANG J. Identification of metabolites of Buyang Huanwu decoction in rat urine using liquid chromatography-quadrupole time-of-flight mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 2012, 67/68(3): 114-122.
[16]NIU J, PI Z F, YUE H, et al. Effect of ginseng polysaccharide on the urinary excretion of type 2 diabetic rats studied by liquid chromatography-mass spectrometry[J]. Journal of Chromatography B, 2012, 907(20): 7-12.
[17]WANG P X, LI Y H, Y J, et al. Determination of protopine in rat brain tissues by RRLC-ESI/Q-TOF-MS method[J]. Chinese Herbal Medicines, 2014, 6(2): 125-130.
[18]SUN J H, WU W, GUO Y Y, et al. Pharmacokinetic study of ginsenoside Rc and simultaneous determination of its metabolites in rats using RRLC-Q-TOF-MS[J]. Journal of Pharmaceutical and Biomedical Analysis, 2014, 88(Complete): 16-21.
[19]LIU J, CHEN X Y, HU Y H, et al. Quantification of the major metabolites of bromhexine in human plasma using RRLC-MS/MS and its application to pharmacokinetics[J]. Journal of Pharmaceutical & Biomedical Analysis, 2010, 51(5): 1 134-1 141.
[20]WANG Y, MA L, SUN Y, et al. Metabonomics study on the hot syndrome of traditional Chinese medicine by rapid resolution liquid chromatography combined with quadrupole time-of-flight tandem mass spectrometry[J]. Archives of Pharmacal Research, 2014, 37(7): 1-8.
[21]WU W, SUN L, ZHANG Z, et al. Profiling and multivariate statistical analysis ofPanaxginsengbased on ultra-high-performance liquid chromatography coupled with quadrupole-time-of-flight mass spectrometry[J]. Journal of Pharmaceutical & Biomedical Analysis, 2015, 107: 141-150.
Tissue Distribution of Ginsenoside Re in Rats by Rapid Resolution Liquid Chromatography Coupled With Quadrupole-Time-of Flight Mass Spectrometry
WANG En-peng1, SAITO Tetsuo2, SUN Yan1, CHEN Chang-bao1, LIU Shu-ying1
(1.JilinGinsengAcademy,ChangchunUniversityofChineseMedicine,Changchun130117,China;2.DepartmentofAppliedLifeSciences,NiigataUniversityofPharmacy&AppliedLifeSciences,Higashijima265-1,Niigata956-8603,Japan)
A method of rapid resolution liquid chromatography coupled with quadrupole-time-of flight mass spectrometry (RRLC-Q-TOF MS) was established to investigate the distribution of ginsenoside Re (G-Re) in rat various tissues (heart, liver, spleen, lung, kidney and brarin) after a single administration by intravenous injection. The biological samples were prepared by protein precipitation. Chromatographic separations was achieved on a Supelco Ascentis®Express C18 column (50 mm×3.0 mm×2.7 μm) with a mobile phase consisting of solvent A (0.1% formic acid in water) and solvent B (acetonitrile) at a flow rate of 0.3 mL/min. Gradient elution was as follows: 0-15 min, 20%-40%B; 15-20 min, 40%-50%B; 20-22 min, 50%-100%B. Ginsenoside Rc (G-Rc) was used as internal standard (IS). All mass spectrometric experiments were performed on RRLC-Q-TOF MS equipped with an electrospray ionization (ESI) source operated in negative mode. The result shows that the calibration curve is linear in the range of 10-20 000 μg/L for tissue homogenates (r>0.99), the lower limit of detection (LLOD) is 3 μg/L, and the lower limit of quantification (LLOQ) is 10 μg/L. The accuracy, intra-day, inter-day precision and recovery ratio can meet the requirements of the biological samples analysis. As a result, G-Re could be widely distributed in organizations with 20 mg/kg solution by caudal vein injection, which could be detected in different organs and distributed mainly in the lung, spleen, kidney and heart. Lung had a highest affinity to G-Re, which was not easy to pass through the blood-brain barrier and hard to accumulate. This method is simple, sensitive and rapid, which is suitable for analyzing ginsenosides Re in vivo.
rapid resolution liquid chromatography coupled with quadrupole-time-of flight mass spectrometry (RRLC-Q-TOF-MS); ginsenoside Re; intravenous injection; tissue distribution
2015-12-30;
2016-04-08
吉林省教育厅“十二五”科学技术研究项目(20150344);长春市科技局重大科技攻关项目(14KG057)资助
王恩鹏(1983—),男(汉族),吉林人,助理研究员,从事中药化学研究。E-mail: robbinwang913@163.com
刘淑莹(1943—),女(汉族),黑龙江人,教授,从事中药化学和有机质谱学研究。E-mail: syliu19@yahoo.com.cn
时间:2016-09-01;
http:∥www.cnki.net/kcms/detail/11.2979.TH.20160901.1500.002.html
O657.63
A
1004-2997(2016)06-0526-07
10.7538/zpxb.youxian.2016.0038
