小叶朴组织培养无菌体系的建立
2016-12-09王斯彤
王斯彤
(辽宁省固沙造林研究所,辽宁阜新 123000)
小叶朴组织培养无菌体系的建立
王斯彤
(辽宁省固沙造林研究所,辽宁阜新 123000)
[目的]建立小叶朴组织培养初代无菌体系。[方法]通过对不同消毒剂及消毒时间的对比,筛选出能够有效控制小叶朴初代培养的污染率,且不抑制小叶朴茎段萌发的消毒处理。[结果]小叶朴茎段经70%乙醇消毒30 s 2次,再用氯化汞消毒6 min所得茎段污染率低,萌发率高。对于后期出现的真菌污染采用多菌灵作为消毒剂和添加剂,用200 mg/L多菌灵浸泡外植体60 min能有效地控制污染,且具有较高的萌发率。在培养基中添加200 mg/L多菌灵也能抑制真菌污染,且效果优于多菌灵浸泡处理。[结论]建立了小叶朴组织培养无菌体系,为小叶朴组培苗的增殖和生根提供参考。
小叶朴;消毒处理;组织培养
小叶朴(Celtisbungenana)为榆科朴属落叶乔木,其树形端正,遮阴好,是常用的庭院绿化及行道树种,也可以利用其乡土树种的优势,进行荒山造林。由于小叶朴生长缓慢,主要繁殖方式是播种繁殖,繁殖时间长,极大地制约了小叶朴在林业上的推广应用。将组织培养技术应用于小叶朴的繁殖上,不仅可以缩短繁育年限,同时对小叶朴的良种选育起到促进作用。污染是小叶朴组织培养过程中的技术难题。外植体材料、培养基、接种工具、接种室消毒不严格或无菌操作不规范及植物内生菌的存在等因素均可导致污染的发生。乙醇、氯化汞等消毒试剂的使用能够很好地消灭茎段表面的细菌,但对于植物茎段内的内生菌及真菌难以消除。笔者采用多菌灵作为消除内生菌和真菌的药剂,采用消毒剂和添加剂2种形式进行对比,建立初代无菌体系,为小叶朴组培苗的增殖和生根提供参考[1-5]。
1 材料与方法
1.1 试验材料 供试材料采自沈阳农业大学后山的小叶朴,枝条应在连续3个晴天后采集,采集当天天气晴朗,时间在11:00~15:00,选取小叶朴当年萌发的幼嫩茎段作为外植体进行消毒对比试验。消毒试剂:乙醇、氯化汞、次氯酸钠、青霉素、多菌灵。
1.2 试验方法
1.2.1 外植体的预处理。选取生长良好、无病虫害的小叶朴新萌发枝条,将枝条剪成长约5 cm带腋芽或顶芽的小段,去除叶片,加少量洗衣粉清洗表面的杂质,用流水冲洗30~60 min后,再用蒸馏水冲洗4~5次(不断振荡烧杯),置于超净工作台上备用。
1.2.2 外值体的消毒。①乙醇(70%、75%)、氯化汞(0.1%)配合使用进行消毒,消毒后无菌水冲洗3~4次,接种至培养基中。②使用次氯酸钠(2%)消毒6、9、12、15 min,消毒后无菌水冲洗3~4次,接种至培养基中。③使用多菌灵(3%)溶液浸泡消毒20、40、60 min,消毒后无菌水冲洗3~4次,再用乙醇和氯化汞配合消毒,接种至培养基后进行观察。与多菌灵作为添加剂进行对真菌抑制对比。
1.2.3 培养基中消毒剂的添加。在配制培养基过程中,加入琼脂、植物生长调节剂和蔗糖后,在各组培养基中分别单独加入不同浓度的青霉素和多菌灵,青霉素浓度为25、50、100、200 mg/L ,多菌灵(50%)为25、50、100、200 mg/L。
1.3 数据分析 采用随机区组设计,通过腋芽萌发率、污染率等指标,研究消毒剂和消毒时间对污染率和萌发率的影响。计算公式:
萌发率=萌发的茎段数/外植体数×100%
污染率=污染的茎段数/外植体数×100%
2 结果与分析
2.1 不同乙醇与氯化汞配合处理对外植体的影响 由表1可知,乙醇与氯化汞配合使用能有效地控制污染率,促进茎段萌发。随着乙醇和氯化汞消毒时间的增加,污染率逐渐降低,但消毒时间过长会抑制茎段的萌发,降低茎段的萌发率。综合考虑,处理⑤污染率偏低,萌发率较高,为小叶朴较好的消毒处理。
方差分析结果表明,乙醇对小叶朴茎段的预处理具有显著影响,乙醇具有较强的穿透性,利用此特性,可以清除小叶朴茎段表面细菌,同时加强了氯化汞的消毒效果。2.2 不同次氯酸钠消毒时间对外植体的影响 用2%次氯酸钠对小叶朴茎段进行不同时间的消毒处理,其污染率及萌发率见表2。由表2可知,随着消毒时间的增加,污染率逐渐降低,当消毒时间达15 min时污染率降低不明显,且会抑制茎段萌发。因此,最适消毒时间为12 min,此时污染率和萌发率都控制在较适宜的范围。
表1 乙醇和氯化汞对小叶朴茎段的消毒效果
Table 1 Disinfection effect of Alcohol and mercuric chloride to Celtis bungenana
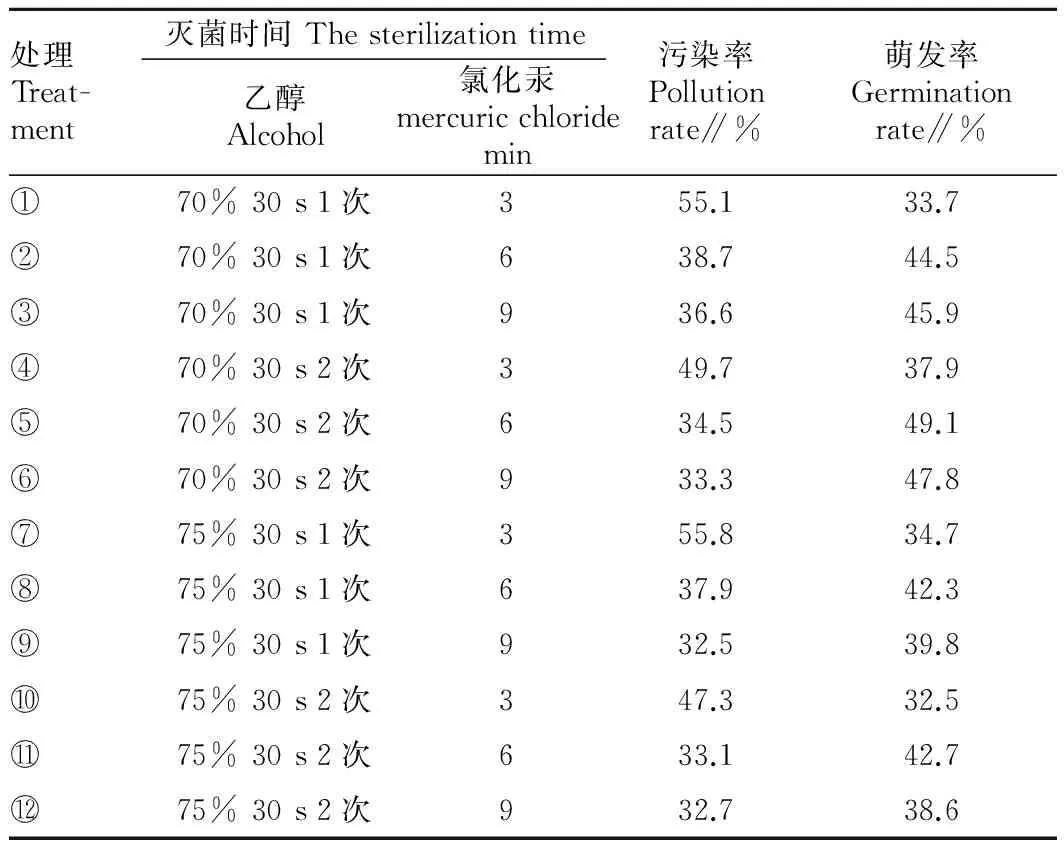
处理Treat-ment灭菌时间Thesterilizationtime乙醇Alcohol氯化汞mercuricchloridemin污染率Pollutionrate∥%萌发率Germinationrate∥%①70%30s1次355.133.7②70%30s1次638.744.5③70%30s1次936.645.9④70%30s2次349.737.9⑤70%30s2次634.549.1⑥70%30s2次933.347.8⑦75%30s1次355.834.7⑧75%30s1次637.942.3⑨75%30s1次932.539.8⑩75%30s2次347.332.575%30s2次633.142.775%30s2次932.738.6
注:样本数为60。
Note:Samle number was 60.
表2 2%次氯酸钠对小叶朴茎段的消毒效果
Table 2 Disinfection effect of 2% sodium hypochlorite toCeltisbungenana

处理Treatment灭菌时间Thesterilizationtime∥min污染率Pollutionrate∥%萌发率Germinationrate∥%①655.839.4②943.942.2③1239.745.3④1538.141.9
2.3 多菌灵对外植体真菌污染的抑制作用 由图1可知,多菌灵作为消毒剂和添加剂均能降低污染率。随着多菌灵浓度的升高,污染率降低,多菌灵浓度从50 mg/L升至100 mg/L时污染率降低最明显,当多菌灵浓度为100~200 mg/L时,污染率降低趋于平缓。而多菌灵作为添加剂的消毒效果优于消毒剂,其原因为多菌灵作为添加剂加入培养基中,能够参与其新陈代谢,进入植物体内起到杀菌消毒的作用。而作为消毒剂时,消毒剂的浓度和消毒时间都会影响消毒效果。由图2可知,随着消毒时间的增加,污染率降低,消毒时间在60~80 min时趋于平缓,污染率变化较小,且萌发率有所下降,说明当消毒时间达80 min时,污染率降低不明显,但会抑制茎段的萌发。

图1 多菌灵作为消毒液和添加剂对真菌污染的影响Fig.1 Effect of Carbendazim as disinfectant and additive on fungi pollution
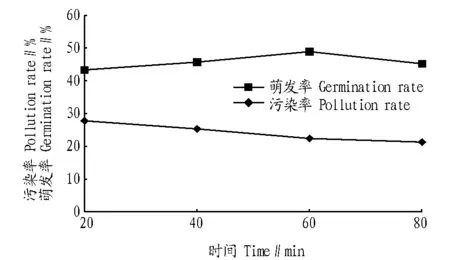
图2 不同消毒时间对污染率和萌发率的影响Fig.2 Effect of Different disinfection time on pollution rate and germination rate
2.4 添加剂的消毒效果 通过在培养基中添加青霉素和多菌灵,对比2种消毒剂的消毒效果,结果见图3。由图3可知,青霉素对细菌污染的发生有一定的抑制作用,特别是前10 d,效果明显,但对真菌污染作用不明显。多菌灵对细菌污染的抑制效果一般,但对后期真菌污染有较好的效果,这与李颖等[6]研究结果一致。
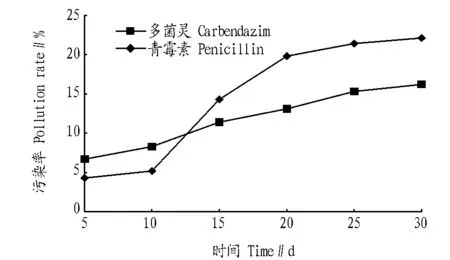
图3 添加剂的消毒效果Fig.3 Additive effect of disinfection
3 结论与讨论
小叶朴茎段具有污染率高、消毒困难的问题,需要进行多种消毒试剂以及消毒时间的筛选。消毒时间过长影响萌发率,过短则消毒不彻底,易污染。该试验对小叶朴茎段进行消毒筛选,结果表明,经70%乙醇消毒30 s 2次,再用氯化汞消毒6 min所得茎段污染率低,萌发率高。在用2%次氯酸钠进行消毒试验中,次氯酸钠对小叶朴茎段的消毒效果较好,用2%次氯酸钠浸泡12 min时,消毒效果好,萌发率高,但与乙醇和氯化汞配合使用相比略有不足。因此,生产实践中,追求较低的污染率和较高的萌芽率时可采用乙醇与氯化汞。
针对出现的真菌污染,该研究采用的多菌灵效果突出,分别作为消毒剂和添加剂加入到培养基中,发现其抗污染能力强,对外植体的副作用小,且萌发率高。而作为消毒剂时,长时间的浸泡会刺激植物表皮,影响茎段萌发。
在青霉素和多菌灵作为添加剂的对比试验中,青霉素能够较好地控制细菌污染,多菌灵能够控制真菌污染,且萌发率高,因此,可尝试青霉素和多菌灵混合使用,以减少污染。多菌灵和青霉素对小叶朴茎段的生长发育是否有影响鲜见报道,因此需要后续试验进行规范和调整,以建立小叶朴组织培养的完整体系。
[1] 王继飞,胡天华,朱莉华.宁夏贺兰山珍稀濒危植物小叶朴资源现状及保护对策[J].宁夏农林科技,2012,53(6):103-104.
[2] 彭广霖,李青,衣淑玉,等.次氯酸钠防治组培苗污染的研究[J].安徽农业科学,2012,40( 16):8806-8808.
[3] 刘绍雄,王娟,王明月,等.巨龙竹组培苗污染优势内生菌的分离与鉴定[J].南方农业学报,2013,44(3):416-421.
[4] 彭广霖,于咏梅,薛元霞,等.氯化汞防治组培苗污染的研究[J].北方园艺,2012(15):131-133.
[5] 方丽,汪一婷,吕永平,等.植物组培产业化生产中污染防控技术研究[J].浙江农业学报,2012,24(6):1074-1078.
[6] 李颖,李春燕.多菌灵和青霉素在组培污染中的应用[J].林业科技,2012,27(1):6-8.
The Establishment of Tissue Culture Sterile System ofCeltisbungenana
WANG Si-tong
(Sand-fixation Afforestation Institute in Liaoning Province,Fuxin,Liaoning 123000)
[Objective] The aim was to establish tissue culture sterile system ofCeltisbungenana. [Method]Through the comparison of different disinfectants and disinfection time, tissue culture sterile system ofCeltisbungenanawith lowerpollution rate and higher germination rate were screened. [Result]By comparison with 70% alcohol disinfection 30 s 2 times, with mercuric chloride for 6 minutes from the stem segments were of low pollution, high germination rate.Late for the fungus pollution using carbendazim as disinfectant and additives, soaking with 200 mg/L carbendazim explant 60 min, can effectively control the pollution, and can have better germination rate. 200 mg/L is added in the culture medium carbendazim can restrain fungus contamination, and better than carbendazol soaking process. [Conclusion] The study stablihed tissue culture sterile system ofCeltisbungenana, and provide reference for proliferation and rooting ofCeltisbungenana.
Celtisbungenana; Disinfection treatment; Tissue culture
王斯彤(1990- ),女,辽宁阜新人,助理工程师,从事林木遗传育种研究。
2016-08-24
S 723
A
0517-6611(2016)31-0153-03
