丹酚酸B磷脂复合物的制备和质量评价
2016-12-09朱美娟王倩倩潘梓衡
李 瑾,朱美娟,周 凯,王倩倩,杨 曼,潘梓衡
(徐州医科大学药学院,江苏省新药研究与临床药学重点实验室,江苏 徐州 221004)
丹酚酸B磷脂复合物的制备和质量评价
李 瑾,朱美娟,周 凯,王倩倩,杨 曼,潘梓衡
(徐州医科大学药学院,江苏省新药研究与临床药学重点实验室,江苏 徐州 221004)
探讨了丹酚酸B磷脂复合物的制备最佳工艺条件。以丹酚酸B与磷脂的复合率为评价指标,考察反应溶剂、反应温度、反应时间、初始浓度和投料比对复合率的影响,采用正交实验筛选出最佳制备工艺,并通过差示扫描量热法、红外光谱、透射电镜以及泡沫细胞渗透性实验验证磷脂复合物形态及性质。确定丹酚酸B磷脂复合物制备的最佳工艺为:反应溶剂为四氢呋喃,反应温度40 ℃,反应时间3 h,丹酚酸B反应浓度为25 mg·mL-1,丹酚酸B与磷脂投料比为1:1,差示扫描量热法、红外光谱、透射电镜以及泡沫细胞渗透性等实验均证实了磷脂复合物的形成和优良特性。成功制备了丹酚酸B磷脂复合物,复合率可达99.5%。
丹酚酸B;磷脂复合物;正交设计;处方因素
丹酚酸B(Salvianolic acid B,SalB)是唇形科植物丹参中的主要水溶性活性成分之一[1],分子式为C36H30O16,化学结构式如图1所示。SalB具有很强的抗氧化作用,可以有效地抑制低密度脂蛋白(low density lipoprotein,LDL)的氧化修饰[2]并且消除泡沫细胞的VEGF的过度表达[3-5],因而对动脉粥样硬化引发心绞痛和心肌梗死具有良好的治疗作用。
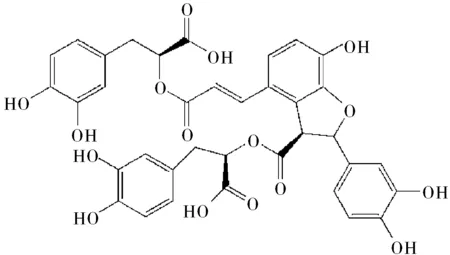
图1 丹酚酸B的化学结构式
然而,很多研究都表明SalB属于生物药剂学分类系统中的III类药物,即水溶性好,脂溶性低,生物膜透过性差,口服生物利用度只有2.5%[6]。磷脂复合物是药物和磷脂分子通过电荷迁移作用而形成的较为稳定的化合物或络合物,它可改变母体药物的理化性质,具有改善原药物溶解性能进而提高其体内吸收的特性[7]。近来,已经有很多建立在药物-磷脂复合物技术基础上的非胃肠道给药系统的研究致力于改善亲水性或者难溶性药物的生物药剂学性质,如苦参碱自乳化纳米乳剂、胰岛素可降解纳米粒[8]、克拉霉素注射乳剂[9]等。因此可以利用磷脂复合物的优势来改善SalB的理化性质和生物药剂学性质。本文系统的对SalB磷脂复合物的制备工艺、处方因素进行了考察和筛选,并采用红外、热分析等技术手段以及溶出和细胞渗透实验对产物进行了详尽的性质考察,为SalB相关制剂的进一步开发打下实验基础。
1 仪器与材料
1.1 仪器
Agilent 8453扫描可见紫外分光光度计,美国Aglient公司;LC-10AT VP 高效液相色谱仪,SHIMADZU公司;SPD-10A VP 紫外检测器,SHIMADZU公司;色谱工作站,浙大智达;Synergi Hydro-RP C18(5 μm, 250 mm×4.6 mm, Phenomenex, USA);SecurityguardTM保护柱(Phenomenex, USA);85-2型恒温磁力搅拌器,上海司乐仪器厂;ZFQ85A旋转蒸发仪,上海电子管十一厂;J-250型水循环真空泵,河南巩义市英峪仪器厂;Sartorius电子天平,北京赛多利斯天平有限公司;H-7650透射电子显微镜,日本日立;差示扫描量热分析仪,德国,NETZSCH;IFS-55福利叶变换红外光谱仪,瑞士BRUKER;TGL-16B高速台式离心机,上海安亭科学仪器厂;超净工作台,AIR,TECH;二氧化碳培养箱(3110,Thermo Forma),USA;恒温振荡器(SHELLABl227.E,SHELLAB),USA;XW-80A漩涡混合器,上海医科大学仪器厂。
1.2 材料
SalB(SalB含量>98%),西安鸿生生物技术公司;SalB对照品,中国药品生物制品检定所;大豆磷脂(97%),德国,Lipoid GmbH;大鼠巨噬细胞RAW264.7细胞系,美国模式培养物包藏所;ox-LDL,渊源生物科技;JET一次性细胞培养板24孔,上海川翔生物科技有限公司;RPMI1640、DMEM、胎牛血清、胰蛋白酶,杭州昊天生物技术有限公司;去脂小牛血清,APPLYGEN生物科技;甲醇(色谱醇),江苏汉邦科技有限公司;乙腈(色谱醇),江苏汉邦科技有限公司;甲酸(98%,色谱醇),江苏汉邦科技有限公司;其余试剂均为分析纯。
2 实验方法
2.1 SalB高效液相含量测定方法的建立
2.1.1 检测波长的确定
称取SalB对照品适量,用甲醇配成约5 μg·mL-1的药物溶液,经0.45 μm滤膜过滤,以甲醇为空白,在200~400 nm波长范围内进行紫外扫描,确定SalB的最大吸收波长。扫描结果显示,SalB在286 nm处吸收最大,且不受溶剂峰干扰,故选择286 nm为检测波长。
2.1.2 色谱条件
Synergi Hydro-RP C18色谱柱(5 μm, 250 mm×4.6 mm, Phenomenex, USA);流动相为甲醇:乙腈:甲酸:水(28:12:2:58),流速1.0 mL/min,柱温35℃;检测波长为286 nm,进样量20 μL。精密称取SalB对照品5 mg,置100 mL容量瓶中,用甲醇溶解并定容,得浓度为50 μg·mL-1的储备液。然后精密吸取不同体积的储备液,分别配制浓度为1.00、5.00、10.00、25.00、50.00 μg·mL-1的标准溶液,按上述色谱条件测定,以峰面积为纵坐标,质量浓度为横坐标,得回归方程 A=24961C+41113(r=0.9993),说明在1.00~50.00 μg/mL的范围内SalB的峰面积与浓度线性关系良好。
2.1.3 精密度实验
分别精密吸取1 mL的1.00、10.00、50.00 μg/mL高、中、低三种浓度SalB对照品溶液,按照2.1.2项下色谱条件日内差每隔2 h进样一次,共测5次,计算高、中、低三种浓度的标准品溶液峰面积RSD分别为0.20%,0.22%和0.89%。日间差每日测定一次,连续测5天,计算峰高、中、低三种浓度的标准品溶液面积RSD分别为0.36%,0.72%和1.29%。高、中、低三个浓度的日内差、日间差RSD均小于2%,表明该方法的精密度良好。
2.1.4 回收率实验
分别精密吸取1 mL的1.00、10.00、50.00 μg/mL高、中、低三种浓度SalB对照品溶液,并加入0.5 mL空白辅料溶液,甲醇稀释定容至10 mL,过滤,分别进样20 μL,HPLC检测。计算高、中、低三个浓度的回收率均在98%~102%之间,RSD均小于2%,表明该方法的准确性良好。
2.2 SalB磷脂复合物制备及处方单因素考察
将一定量的SalB和磷脂在一定条件下反应后,减压除去反应溶剂,再加入适量的复溶试剂,充分溶解其中的磷脂及复合物,3000 r/min离心10 min,收集沉淀,干燥称重,上清液旋蒸除去有机试剂,即得SalB磷脂复合物。SalB的初始投药量与沉淀量的差值即为与磷脂复合的SalB的量,从而计算出SalB与磷脂的复合率,计算公式(1)如下:
对于工程建设的相关规范、标准的编制和修订,建设行政主管部门和行业协会要积极组织建设、设计、施工、监理单位进行宣贯学习和技术培训。特别是设计单位,要更新观念,积极进行相关软件的研发升级,将高强钢筋应用的相关标准、规范纳入到工程实践中。
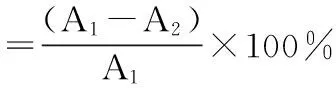
(1)
式中:A1——SalB的初始投药量A2——沉淀量(未复合的SalB)
根据预实验结果采用上述制备方法,初选处方,固定某些因素然后进行单因素考察,分别研究反应溶剂、反应时间、反应温度、SalB与磷脂投料比和SalB反应浓度对磷脂复合物复合率的影响。
2.3 正交试验
根据单因素考察的实验结果,选择最佳反应溶剂为四氢呋喃,反应温度(A)、反应时间(B)、药物与磷脂配比(C)和反应物浓度(D)对SalB磷脂复合物的复合率有一定影响。因此以复合率为考察指标,采用L9(34)表以A、B、C、D做四因素三水平的正交实验设计(表1),并对测定结果进行方差分析。
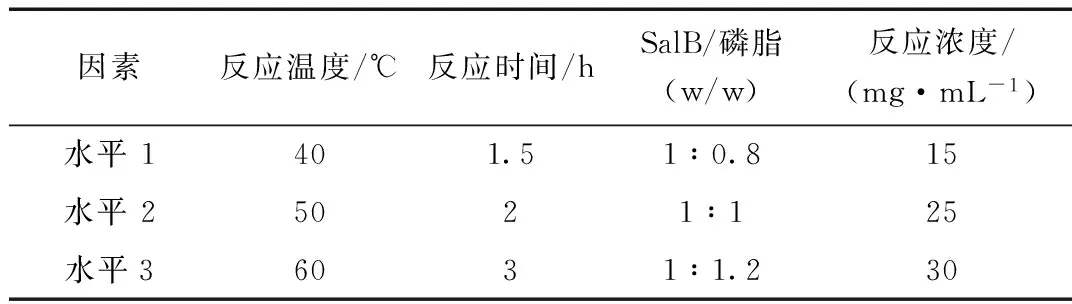
表1 L9(34)四因素三水平正交实验设计表
2.4 处方验证
根据正交试验优化得到的最佳处方工艺,制备三批SalB磷脂复合物进行验证,对其复合率进行考察。
2.5 SalB磷脂复合物的性质表征
2.5.1 差式扫描量热法分析
分别对SalB、磷脂、SalB磷脂复合物和物理混合物进行DSC测试。测试条件:空铝坩埚为参比,气氛为N2,流速100 mL·min-1,升温范围25~300 ℃,升温速率10 ℃·min-1。2.5.2 红外光谱(IR)分析
分别对SalB、磷脂、SalB磷脂复合物和物理混合物进行IR分析(KBr压片),光谱波长记录范围:500~4000 cm-1。
2.5.3 透射电镜(TEM)形态分析
透射电镜观察SalB磷脂复合物水合后的形态,于SalB磷脂复合物粉末(1.2 mg)中加入100 mL蒸馏水,充分水合分散之后,滴加在覆盖碳膜的铜网上,用2.0% 磷钨酸钠负染液染色,室温干燥后,拍摄透射电镜照片,观察形态。
2.6 泡沫细胞渗透性实验
以RAW264.7巨噬细胞及巨噬细胞源性的泡沫细胞为模型,研究SalB磷脂复合物、物理混合物和SalB在不同时间点的跨泡沫细胞转运行为,评价三种制剂的细胞膜渗透特性。
2.6.1 巨噬细胞培养
取对数生长期的RAW264.7细胞,调整细胞浓度为1×105个/mL, 转种于一次性24孔细胞培养板中,每孔培养液总体积为1 mL, 置37 ℃、潮湿的5%的CO2培养箱中进行培养,细胞单层融合达80%后,换无血清的RPMI1640培养液,孵育24 h后用于实验。
2.6.2 泡沫细胞模型的建立[10-11]
将上述孵育24 h后的巨噬细胞弃原液,加入用细胞培养液配制的100 μg/mL的ox-LDL,与细胞共同孵育24 h,即得泡沫细胞模型,用油红-O染色鉴定泡沫细胞的形成。
2.6.3 泡沫细胞渗透特性的比较研究
在细胞培养液中加入500 μL含有5 mg/mL不含脂质的胎牛血清以及4 mM β-巯基乙醇的DMEM液,分别和SalB磷脂复合物水分散液(30 μg·mL-1,以SalB计算, 600 μL)、SalB水溶液(等浓度、等体积)与物理混合物水分散液(等浓度、等体积)孵育。分别在孵育5、15、30、45和60 min后取出,弃去细胞培养液,并用D-PBS溶液冲洗三次,去除未被吞噬渗透入细胞的药物,-40 ℃和37 ℃反复冻融5次裂解细胞,然后加入100 μL甲醇溶解药物,12000 rpm离心5 min后取上清,HPLC检测,每组数据由三个平行试验测得。
3 结果与讨论
3.1 单因素考察结果
3.1.1 反应溶剂
固定其它条件,选择不同反应溶剂分别制备SalB磷脂复合物,考察反应溶剂对复合率的影响。结果见表1。
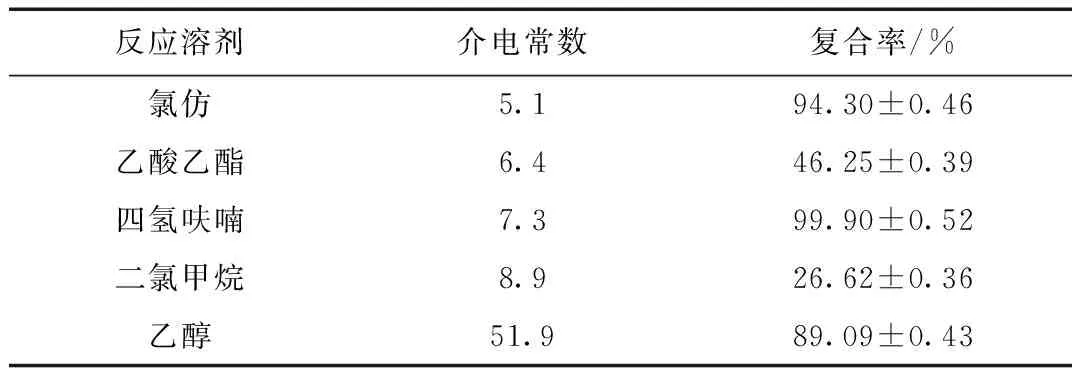
表1 反应溶剂对SalB磷脂复合物复合率的影响(n=3)
由表1结果可知,介电常数较小的反应溶剂对磷脂复合物的形成优于介电常数较大的反应溶剂,这是由于以介电常数大的试剂为反应溶剂时,由于介电常数大所产生的反向电势也大,从而降低了反应物间的相互作用力,不利于异号离子间化合反应。所以乙醇作为反应溶剂时,结合率不高。然而二氯甲烷、氯仿与乙酸乙酯介电常数较小,复合率仍然很低,这主要是因为二氯甲烷、氯仿与乙酸乙酯等是SalB的不良溶媒,同时乙酸乙酯也是磷脂的不良溶媒,以它们作反应溶剂时,药物与磷脂难以以分子状态大量共存于溶液状态中,使反应物之间发生相互作用的几率相对较小,而对于SalB和磷脂均有相对较大溶解度的四氢呋喃则可为反应物提供更多能够发生反应的机会,使结合率较高。因此,选择四氢呋喃作为制备SalB磷脂复合物的反应溶剂。
3.1.2 反应时间
固定其它条件,以不同反应时间分别制备SalB磷脂复合物,考察反应时间对复合率的影响。结果见图2。
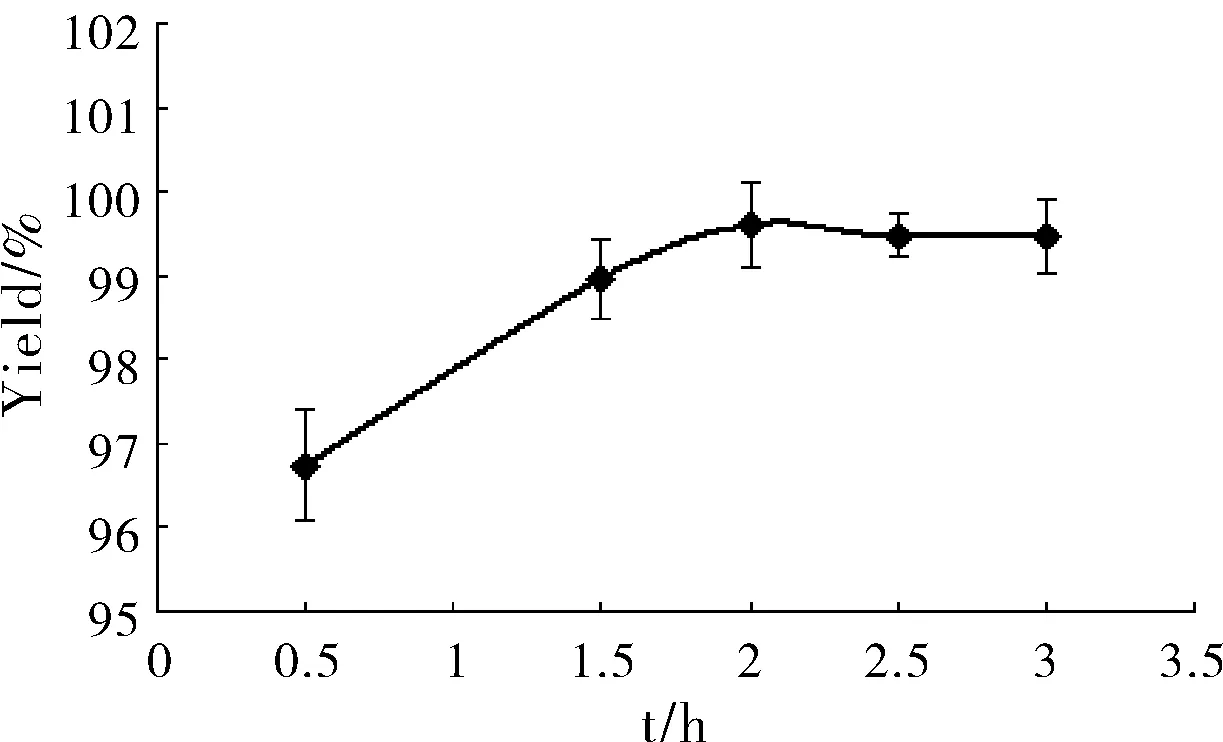
图2 反应时间对SalB磷脂复合物复合率的影响(n=3)
由图2可知,随着反应时间的延长,复合率在2 h达到最高,但随着时间的延长复合率开始稍有下降,原因可能是SalB和卵磷脂的复合时间在2 h左右,但随着反应时间的延长,四氢呋喃溶剂在加热反应条件下易于挥发,使得SalB的质量浓度变高,从而影响复合率。
3.1.3 反应温度
固定其它条件,在不同反应温度下分别制备SalB磷脂复合物,考察反应时间对复合率的影响。结果见图3。
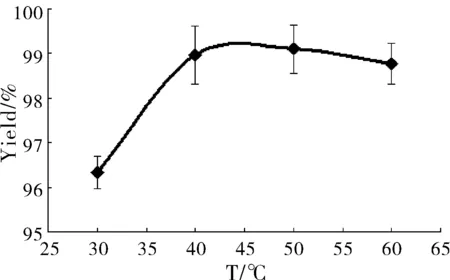
图3 反应温度对SalB磷脂复合物复合率的影响(n=3)
由图3可知,随反应温度的升高,药物与磷脂的复合率略呈上升趋势,但随着温度的进一步升高(大于60 ℃)复合率开始稍有下降,这是因为60 ℃较为接近四氢呋喃的沸点(66 ℃),在加热反应条件下容易挥发,使得SalB的质量浓度变高,从而影响复合率。
3.1.4 SalB与磷脂质量比(w/w)
固定其它条件,按照不同SalB与磷脂投料比(w/w)分别制备SalB磷脂复合物,考察SalB与磷脂质量比对复合率的影响。结果见图4。

图4 SalB与磷脂质量比对SalB磷脂复合物复合率的影响(n=3)
由图3可知,SalB与磷脂的投料比对结合率有较大影响,结合率随SalB在体系中所占比例的降低而增加。
3.1.5 SalB反应浓度
固定其它条件,以不同SalB反应浓度分别制备SalB磷脂复合物,考察反应时间对复合率的影响。结果见图5。

图5 SalB反应浓度对SalB磷脂复合物复合率的影响(n=3)
由图5可知,SalB质量浓度对卵磷脂的结合率率影响比较大。在其他条件相同的情况下,随溶剂用量的增加(SalB质量浓度越低),药物的结合率逐渐增加,在质量浓度为25 mg/mL时复合物的结合率最高,浓度再增大时,复合率呈下降趋势。这可以归结为:SalB浓度过高时,已接近SalB在四氢呋喃中的溶解度,随着反应时间的增加或反应温度的提高,溶液达到超饱和,导致部分药物重新析出,从而结合率下降。反应物浓度的影响实验也表明,浓度较小时,药物的结合率较高。药物在溶液中的反应,须经碰撞才能发生,只有适当的药物浓度可提供良好的反应环境才能有利于反应的发生。
3.2 正交试验结果
由正交试验结果可知,SalB磷脂复合物最佳制备工艺组合是A1B3C2D1,即反应温度40 ℃,反应时间3 h,SalB与磷脂投料比为1:X,SalB反应浓度为15 mg/mL。还需予以验证和比较。由极差值可以看出,以上四个因素对于磷脂复合物结合率的影响次序依次为SalB反应浓度>反应温度>投料比>反应时间。

表2 反应溶剂对SalB磷脂复合物复合率的影响(n=3)
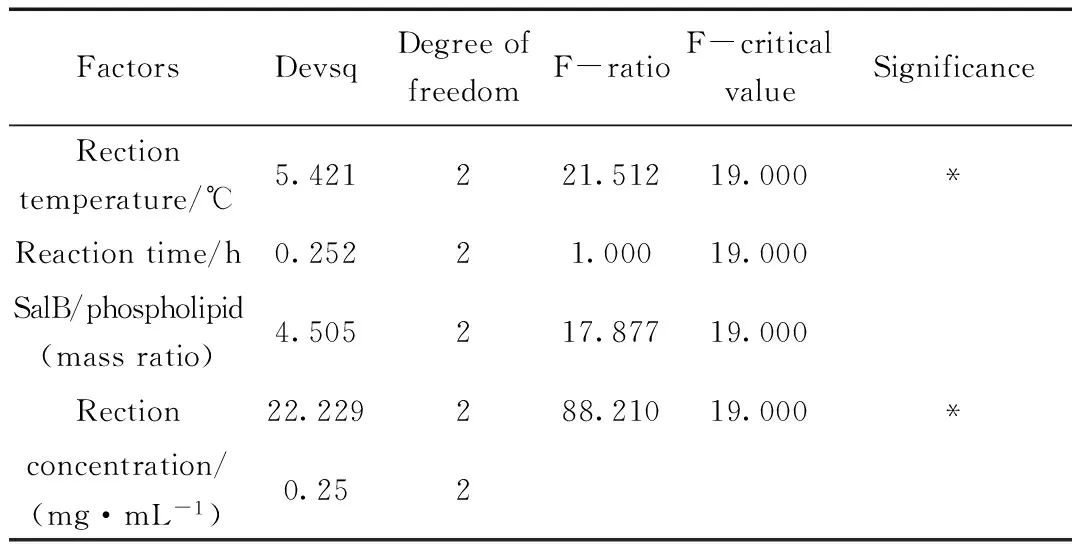
表3 方差分析结果
3.3 DSC分析
实验分别对磷脂、SalB、SalB磷脂复合物和物理混合进行DSC热分析实验。结果如图6所示。
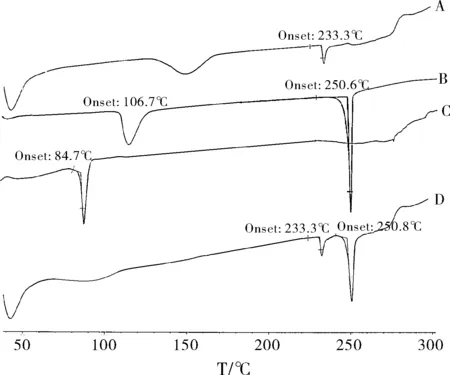
图6 磷脂(A)、SalB(B)、SalB磷脂复合物(C)和物理混合物(D)的DSC热分析图谱
磷脂有两个吸热峰(图6A),其中,149.3 ℃出现第一个弱的吸热峰,说明磷脂分子的极性部分发生了热转移;233.3 ℃出现第二个吸热峰,此时磷脂从胶态转变为液晶态,同时磷脂分子中的碳氢间融解,并生成了同分异构体或结晶。SalB有两个部分的吸热峰(图6B),其中,106.7 ℃出现第一个宽吸热峰,可能是水分子的损失产生的脱水峰,250.6 ℃出现第二个尖吸热峰。SalB与磷脂的物理混合物有三个吸热峰(图6D):其中第一个是80~105 ℃出现的较弱和宽泛的吸热峰,代表磷脂的吸热峰;233.3 ℃的吸热峰可能是来自于磷脂,第三个吸热峰出现在250.8 ℃,代表SalB的吸热峰。从以上结果可以推断,随着温度的增加,SalB会熔融并溶解于磷脂中而部分形成磷脂复合物。分析SalB磷脂复合物的DSC曲线,药物和磷脂各自的吸热峰均消失了;由于形成了磷脂复合物,复合物的相转移温度(84.7 ℃)低于磷脂的相转移温度(图6C)。此时,药物和磷脂可能发生了相互反应,例如产生氢键结合或范德华力。因为磷脂复合物中药物和磷脂的极性部分相连接,磷脂中的碳氢键可以自由转动并包裹磷脂分子的极性部分,使得磷脂的链烃结构不断减少,磷脂的吸热峰因此消失并降低了相转移温度。
3.4 红外光谱分析

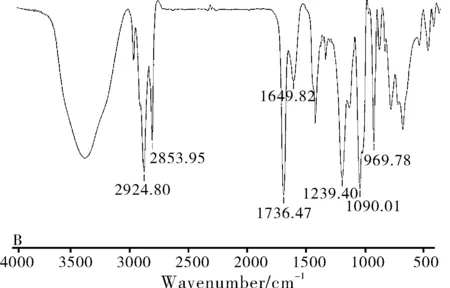
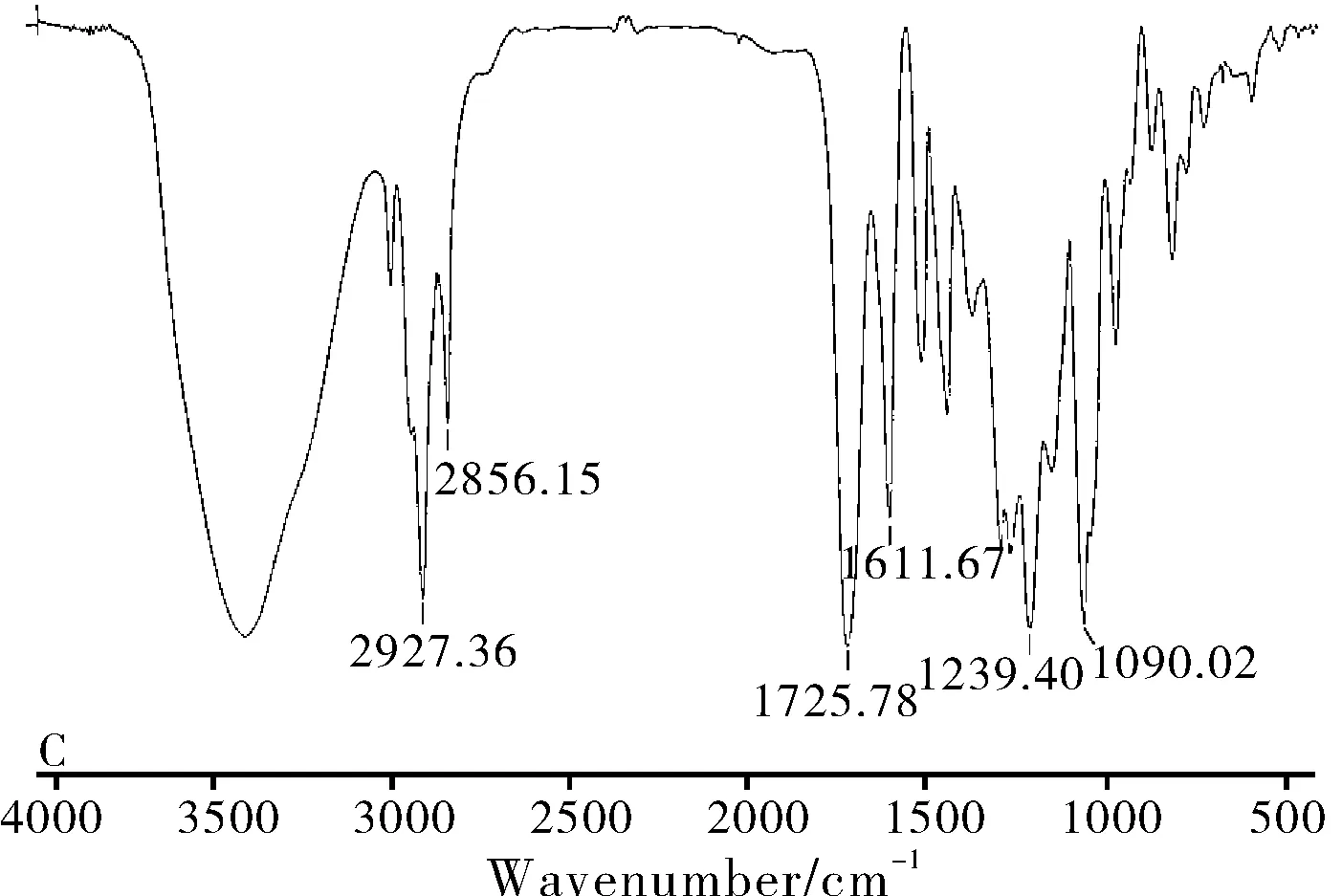

图7 SalB(A)、磷脂(B)、物理混合物(C)
实验分别对磷脂、SalB、SalB磷脂复合物和物理混合物进行红外光谱分析。结果如图7所示,磷脂中,长脂肪酸链的C-H伸缩振动峰出现在2924和2853 cm-1,脂肪酸酯的羰基(C=O)伸缩振动峰出现在1736 cm-1,C=C伸缩振动峰出现在1629 cm-1,P=O 伸缩振动峰出现在1239 cm-1,P-O-C伸缩振动峰出现在1090 cm-1,N+(CH3)3伸缩振动峰出现在969 cm-1(图7B)。在SalB中,酚羟基-OH伸缩振动峰出现在3418 cm-1,羧基(COO-)伸缩振动峰出现在1725 cm-1,酯羧基(C=O)伸缩振动峰出现在1611 cm-1(图7A)。
从红外图谱看出,物理混合物和磷脂复合物显示出明显的区别。物理混合物中,图谱显示的是药物和磷脂的叠加效果,即药物的吸收峰仍出现在1725 cm-1和1611 cm-1(图7C)。但是,磷脂复合物中(图7D),酚羟基-OH伸缩振动峰明显变宽,说明在磷脂复合物的制备过程中,磷脂和药物的酚羟基发生了相互反应。磷脂复合物中的SalB酯羧基(C=O)伸缩振动峰向高波段转移的转移(1095 cm-1)。因此,红外光谱中酚羟基-OH的变宽以及酯羧基(C=O)和羧基(COO-)的转移,都证明药物和磷脂发生相互反应。
3.5 透射电镜观察(TEM)

图8 SalB磷脂复合物分散于水中的透射电镜图
口服给药后,SalB磷脂复合物将分散在胃肠道的水性体液中。因此,实验对磷脂复合物分散在水中后的结构特点进行了考察。图8显示了水合后磷脂复合物的形态呈现类似于脂质体的多层囊泡结构,局部放大后,观察到磷脂复合物具有一些指纹结构。对于磷脂复合物,药物与磷脂是通过极性部分相连,异于药物包含在磷脂内部水腔的脂质体结构(具有完整的类脂膜)。当磷脂复合物接触到分散介质时,复合物分子按照一定顺序排列,从而形成纳米粒径的多层囊泡结构。
3.6 泡沫细胞渗透性实验
药物穿过生理膜的能力(渗透性)是决定药物吸收和分布特点的一个非常重要的生物药剂学参数。从图8所示,SalB磷脂复合物可以显著增加药物的在泡沫细胞膜的渗透性,其透过量分别是物理混合物和SalB的4倍(p<0.01)和10倍(p<0.01)。这可能是因为磷脂复合物增加了药物的脂溶性,从而显著提高药物通过磷脂双分子膜层的能力。此外,磷脂复合物在于亲水性介质接触后,能形成纳米粒径的类脂质体结构,从而通过膜扩散或胞吞方式,显著增加泡沫细胞对药物的摄取率。因此,磷脂复合物有利于促进水溶性药物穿过泡沫细胞,促使药物在泡沫细胞中有一个更高的累积量。
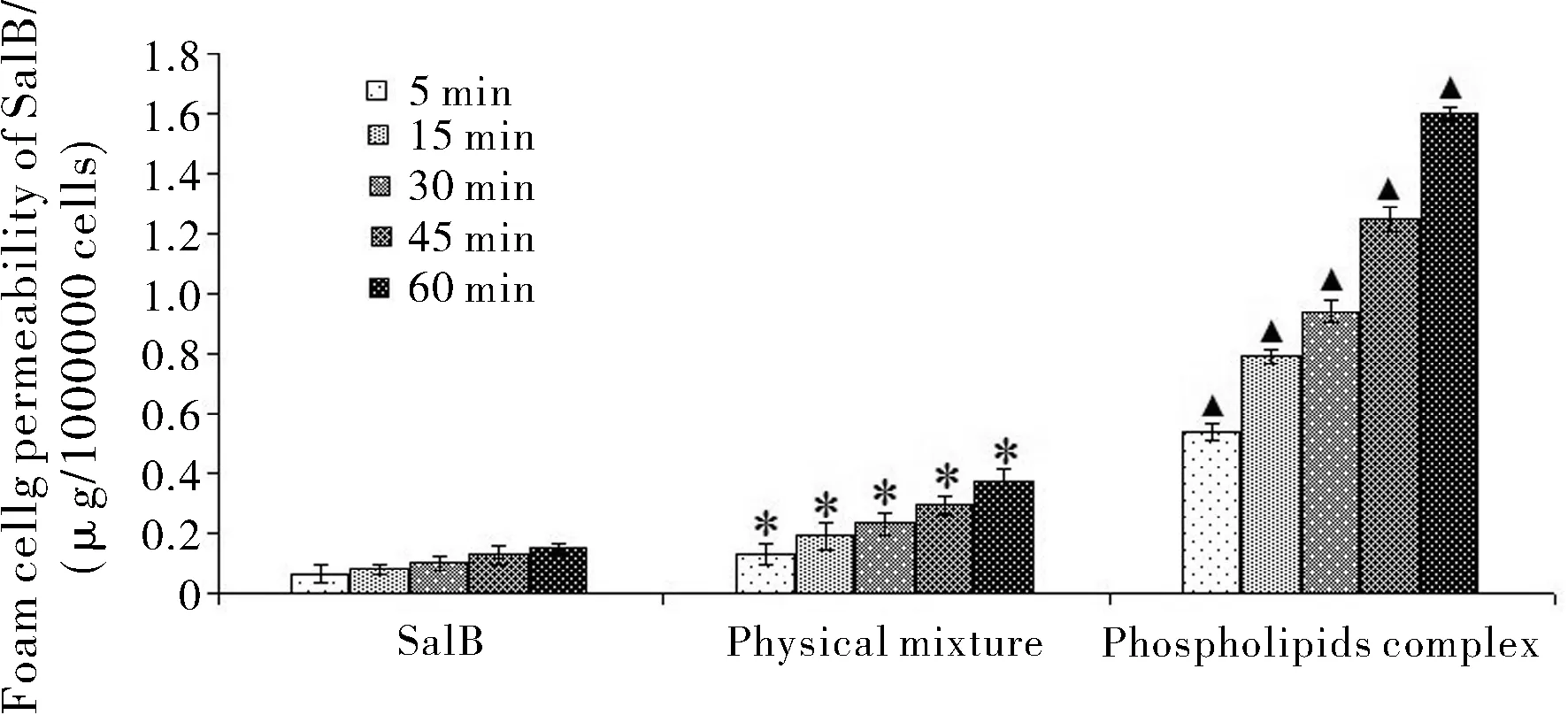
Statistical significances (p<0.01) between*: phospholipids complex and physical mixture; ▲: phospholipids complex and SalB; Results (mean±SD,n=3) are expressed as the amount of SalB transported across foam cell with respect to 1000000 cells
4 结 论
本文成功制备了丹酚酸B磷脂复合物,以复合率为指标,对处方和制备工艺进行了优化,采用DSC、IR、TEM进行结构鉴定,通过测定和泡沫细胞渗透性对比磷脂复合物形成前后的理化性质。小结如下:
(1)丹酚酸B磷脂复合物的制备:考察了反应时间、反应温度、反应浓度、反应溶剂、投料比等因素对于复合率的影响,通过正交设计筛选出最佳工艺处方,即反应温度40 ℃,反应时间3 h,SalB与磷脂投料比为1:1,SalB反应浓度为15 mg/mL,其中SalB反应浓度、反应温度、投料比和反应时间对磷脂复合物的复活无虑起着重要作用,其余因素影响不大。
(2)TEM镜下观察磷脂复合物结构的形态呈现类似于脂质体的多层囊泡结构;DSC与IR证实了磷脂复合物不同于简单物理混合物的结构特征,即中丹酚酸B的极性基团(酚羟基等)与磷脂的极性部分发生了相互作用(生氢键结合或范德华力),使得丹酚酸B磷脂复合物的理化性质发生了改变;此外,丹酚酸B磷脂复合物可以显著增加药物泡沫细胞膜的渗透性,其透过量是丹酚酸B的 10倍(p<0.01)。
[1] Li CD, Liu JP, Zeng ZZ, Zheng YX. Study on the solubility and permeability of tanshinone IIA and on the excipients increasing the solubility and permeability [J]. Lishizhen Med and Materia medica Res, 2008,19:1724-1726.
[2] Hao HP, Wang GJ, Cui N, et al. Pharmacokinetics, Absorption and Tissue Distribution of Tanshinone IIA Solid Dispersion[J]. Planta Med, 2006,72(14): 1311-1317.
[3] 刘建平,刘盼,李瑾. 一种丹参酮ⅡA固体分散体微丸的制备方法及其应用[P]. 中国专利: 201110058664.X, 20110311.
[4] Ho HO, Su HL, Tsai T, et al. The preparation and characterization of solid dispersions on pellets using a fluidized-bed system [J]. Int J Pharm, 1996,139:223-229.
[5] Zhang XW, Sun NY, Wu BJ, et al. Physical characterization of lansoprazole/PVP solid dispersion prepared by fluid-bed coating technique [J]. Powder Technology, 2008,182:480-485.
[6] Doherty C, York P. Mechanisms of dissolution of frusemide/PVP solid dispersion [J]. Int. J. Pharm, 1987,34:197-205.
[7] Teófilo V, Brune S, Paulo C.Solid dispersions as strategy to improve oral bioavailabi- lity of poor water soluble drugs [J]. Drug Discovery Today, 2007,12:1068-1075.
[8] 袁菊勇, 毛声俊, 沈千万,等. 载体联用固体分散技术对丹参酮ⅡA体外溶出的影响[J]. 中国中药杂志, 2009,34(6):685-689.
[9] Wang X, Michoel A, G. Mooter V. Solid state characteristics of ternary solid dispersi ons composed of PVP VA64, Myrj 52 and itraconazole [J]. Int J Pharm, 2005,303:54- 61.
[10]Xie SZ, Lee YF, Kim E, et al. TR4 nuclear receptor functions as a fatty acid sensor to modulate CD36 expression and foam cell formation [J]. Proc. Natl. Acad. Sci. U. S. A., 2009,106(32): 13353-13358.
[11]Ylitalo R, Jaakkola O, Lehtolainen P, et al. Metabolism of modified LDL and foam cell formation in murine macrophage-like RAW 264 cells [J].Life Sci., 1999,64 (21): 1955-1965.
Preparation and Evaluation of Salvianolic Acid B Phospholipid Complex*
LIJin,ZHUMei-juan,ZHOUKai,WANGQian-qian,YANGMan,PANZi-heng
(College of Pharmacy, Xuzhou Medical University, Jiangsu Key Laboratory of New Drug Research and Clinical Pharmacy, Xuzhou Medical University, Jiangsu Xuzhou 221004, China)
To research the optimal conditions for preparing the SalB phospholipid complex, the formulation factors such as solvent, reactive temperature, reactive time, concentration of reactants and the ratio of reactants on this reaction were investigated and the prescription composition was screened out by orthogonal design. The morphology and property of the phospholipid complex were verified by DSC, IR, TEM and form cell permeability experiment. The best conditions for preparing the SalB phospholipid complex were obtained as follows: the solvent was THF, the reactive temperature was 40 ℃, the reactive time was 3 h, the concentration of SalB was 25 mg·mL-1and the ratio of SalB to phospholipid was 1:1. The recombination rate of SalB phospholipid complex were more than 99.5%, and the quality of the SalB phospholipid complex was well.
SalB; phospholipid complex; orthogonal design; formulation factors
江苏省高校自然科学基金(13KJB360013)。
李瑾(1984-),女,药剂学博士,讲师,从事药剂学方向研究。
TQ914.1
A
1001-9677(2016)021-0026-06
