复方续断三七提取物对家兔骨折愈合的促进作用及其机制
2016-12-08宁涛,胡勇
宁 涛,胡 勇
(1. 安徽医科大学第一附属医院骨科,安徽合肥 230032;2. 阜阳市人民医院骨科,安徽阜阳 236000)
◇中医药研究◇
复方续断三七提取物对家兔骨折愈合的促进作用及其机制
宁 涛1,2,胡 勇1
(1. 安徽医科大学第一附属医院骨科,安徽合肥 230032;2. 阜阳市人民医院骨科,安徽阜阳 236000)
目的 观察复方续断三七提取物(compound of radix dipsaci and pseudo-ginseng extract, CRPE)对家兔骨折愈合的促进作用,并探讨其机制。方法 采用家兔胫骨骨折模型,分成假手术组、模型组及CRPE 0.6 g/kg、CRPE 1.2 g/kg和CRPE 2.4 g/kg组。观察CRPE对家兔骨骼愈合过程中骨痂形成时间、骨折愈合时间、血清中转化生长因子1(TGF-β1)、Ⅰ型胶原、Ⅱ型胶原、碱性磷酸酶、钙、磷、锌、铜含量的影响。采用Western blot和RT-PCR观察CRPE对家兔胫骨骨折组织中P-Smad2、P-Smad3、Smad7、PAI-1蛋白及mRNA的表达影响。结果 CRPE(1.2 g/kg)组和CRPE(2.4 g/kg)组能缩短骨痂形成时间和骨折愈合时间,显著升高骨折愈合过程中所需的TGF-β1、Ⅰ型胶原、Ⅱ型胶原、碱性磷酸酶、钙、锌、铜的含量;升高P-Smad2、P-Smad3和PAI-1的蛋白及mRNA的表达,降低Smad7蛋白及mRNA的表达(P<0.05)。结论 CRPE对家兔骨折预后有显著的促进作用,其机制可能与TGF-β1/Smad信号通路有关。
复方续断三七提取物;骨折;转化生长因子1(TGF-β1);Smad;PAI-1
Fuyang City People’s Hospital, Fuyang 236000, China)
随着交通工具的日益增多,骨折已成为临床最多见的外伤性疾患。现代医学认为,骨折的愈合过程实质是许多生物活性因子(biological activity factor, BAF)与成骨细胞(osteoblast)及细胞外基质(extracellular matrix, ECM)共同参与骨和周围组织损伤修复的过程[1]。然而,由于开放性骨折、骨缺损、骨坏死等患者的大量增多,如何避免骨折愈合过程中出现的骨折不愈合及骨质缺损仍然是临床上治疗的难点[2]。祖国医学治疗骨折已有数千年历史,积累了丰富的经验,中药因其天然药源和疗效肯定,具有独特的优势。本课题组根据当地治疗骨折“偏方”结合传统中医理论,使用现代水提法制备出复方续断三七提取物(compound of radix dipsaci and pseudo-ginseng extract, CRPE),并观察其在控制骨质缺损,促进骨折愈合等方面的疗效。
1 材料与方法
1.1 药物制备 复方续断三七提取物是根据当地治疗骨折的“偏方”和中医理论修正,以续断、三七、黄芪以及其他辅料按照(4∶3∶2∶1)配伍,使用现代水提法工艺制备而成[3]。其主要成分为环烯醚萜糖甙、黄芪多糖、人参皂苷等。
1.2 实验试剂 转化生长因子1(transforming growth factor-β, TGF-β1)ELISA试剂盒、Ⅰ型胶原(collagen type Ⅰ)ELISA试剂盒、Ⅱ型胶原(collagen type Ⅱ)ELISA试剂盒、BCA法蛋白测定试剂盒,均购自南京建成生物工程;Trizol购自Invitrogen公司;RT-PCR试剂盒购自Promega公司;TGF-β1、P-Smad2、Smad2、P-Smad3、Smad3、Smad7、GAPDH一抗及相关二抗购自Sigma公司;TGF-β1、P-Smad2、P-Smad3、Smad7、GAPDH引物由上海生工生物工程公司合成。
1.3 实验动物及分组 选用健康成年雄性新西兰家兔50只,体质量(2.2±0.2)kg,由安徽医科大学动物实验中心提供,许可证号2008003。将动物随机分成5组,每组10只,分别为假手术组、模型组及CRPE 0.6 g/kg、CRPE 1.2 g/kg、CRPE 2.4 g/kg组。
1.4 实验动物造模 用30 g/L戊巴比妥钠(30 mg/kg)耳缘静脉麻醉家兔,于胫腓骨前外侧逐层切开皮肤、皮下组织及关节囊,暴露出家兔胫骨,使用线锯将胫骨截断,并形成约0.3 cm大小的骨缺损区,滴入100 g/L复合抗生素(青霉素:庆大霉素=2∶1)后缝合包扎,无外固定。术后模型组肌注青霉素钠行抗感染治疗3 d,每天1次,每次50万IU。CRPE组予以相应剂量(0.6 g/kg、1.2 g/kg、2.4 g/kg)灌胃处理,每天1次。假手术组只切开不截断胫骨。家兔在造模后第7、14、21、28、35天行X线(CR)摄片检查骨折,并观察骨折和骨痂的形成及骨折愈合情况。于造模前及造模后第7、14、21、28、35天抽取各组家兔血5 mL,以1 000 r/min离心10 min分离血清后置于-20 ℃冷冻备用。按照相应时间点处死家兔,切去并清理骨折的胫骨后-80 ℃冷冻备用。
1.5 家兔血清TGF-β1、Ⅰ、Ⅱ型胶原及碱性磷酸酶、钙、磷、锌、铜含量的测定 取出冻存的家兔血清,按照ELISA试剂盒说明书步骤检测家兔血清中TGF-β1,Ⅰ、Ⅱ型胶原的含量;使用碱性磷酸酶试剂盒(AKP/ALP)检测家兔血清中碱性磷酸酶的含量;使用IRIS/AP法直接检测血清中钙、磷、锌、铜的含量。
1.6 RT-PCR方法检测TGF-β1、Smad2、Smad3、Smad7、PAI-1、GAPDH的mRNA含量 使用Trizol试剂盒提取家兔胫骨骨折处组织中的总RNA。用Image Plus软件测量RT-PCR扩增产物吸光度值,以GAPDH作标准校正各产物的相对水平。使用的PCR引物见表1。
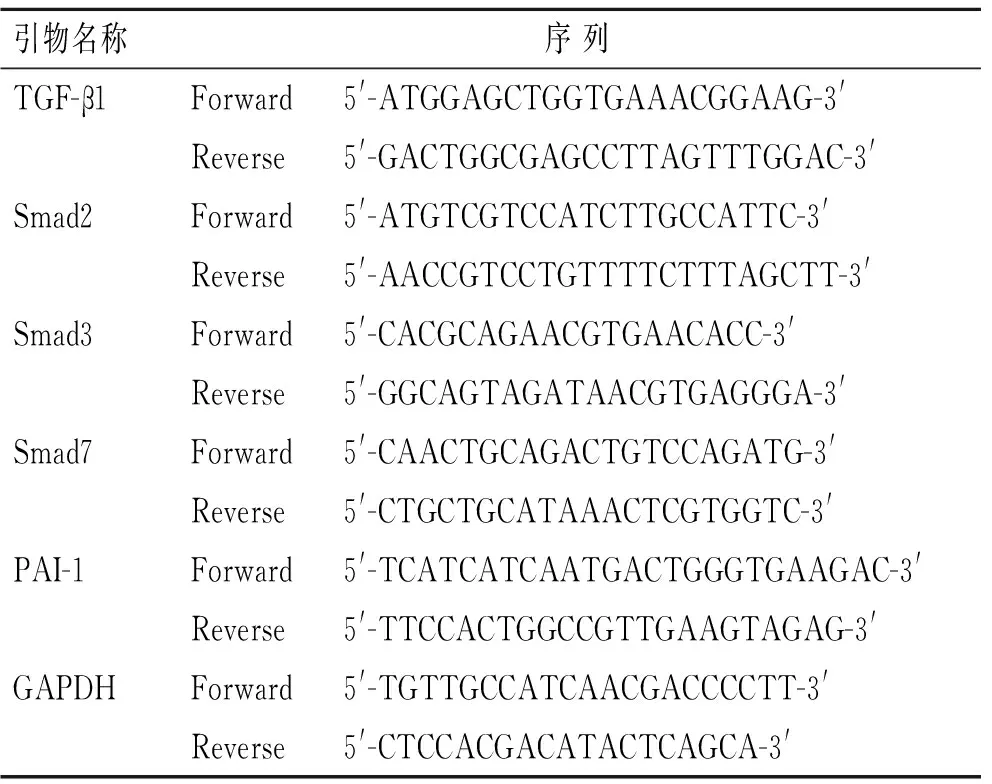
表1 PCR所用引物及其序列Tab.1 The primers and sequence of RT-PCR
1.7 免疫印迹分析法检测TGF-β1、P-Smad2、Smad2、P-Smad3、Smad3、Smad7、PAI-1、GAPDH的蛋白含量 使用TLB(包含20 mmol/LTris,pH 7.4, 137 mmol/L 氯化钠,25 mmol/L β-甘油磷酸,25 mmol/L钠-焦磷酸盐,2 mmol/L乙二胺四乙酸,1 mmol/L正钡酸钠,10 mL/L TritonX-100,100 mL/L甘油,1 mmol/L苯甲基磺酰氟,7 g/L蛋白酶抑制剂)缓冲液与家兔胫骨骨组织匀浆。使用BCA法测定各个样本蛋白质水平。按照Westen blot法将蛋白分离、电泳、转膜后置于4 ℃一抗杂交袋过夜,后加入二抗孵育。使用ECL发光法进行曝光并分析统计。

2 结 果
2.1 CRPE对家兔骨痂形成时间和骨折愈合时间的影响 假手术组未观察到骨痂形成;与模型组相比,CRPE(1.2 g/kg)和CRPE(2.4 g/kg)组能明显降低骨痂形成时间,缩小骨折愈合时间,差异具有统计学意义(P<0.05,表2)。
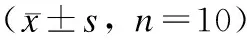
表2 CRPE对家兔骨痂形成时间和骨折愈合时间的影响Tab.2 The effects of CRPE on callus formation time and healing time in rabbits
2.2 CRPE在术后不同时间点对家兔血清中TGF-β1含量的影响 与假手术组相比,模型组血清中TGF-β1含量均明显增高(P<0.05);与模型组相比,CRPE(1.2 g/kg)组在造模后14 d和21 d能增高家兔血清中TGF-β1的含量,而CRPE(2.4 g/kg)组则能在造模后7、14、21、28 d提高家兔血清中TGF-β1的含量,差异具有统计学意义(P<0.05,表3)。
2.3 CRPE在术后3周时对家兔血清中Ⅰ、Ⅱ型胶原含量的影响 与假手术相比,模型组血清中Ⅰ、Ⅱ型胶原含量显著升高(P<0.05);与模型组相比,CRPE(1.2 g/kg)和CRPE(2.4 g/kg)组能明显升高家兔血清中Ⅰ、Ⅱ型胶原含量,差异具有统计学意义(P<0.05,表4)。
2.4 CRPE在术后3周时对家兔血清中碱性磷酸酶、钙、磷水平的影响 与假手术组相比,模型组家兔血清中碱性磷酸酶、血钙含量明显升高,差异具有统计学意义(P<0.05),血磷含量无明显变化;与模型组相比,CRPE(1.2 g/kg)和CRPE(2.4 g/kg)均能升高家兔血清中碱性磷酸酶及血钙的含量,差异具有统计学意义(P<0.05),血磷含量无明显变化(表5)。

表3 CRPE在术后不同时间点对家兔血清中TGF-β1含量的影响Tab.3 The effects of CRPE on TGF-β1 level at different time points after operation in rabbit serum
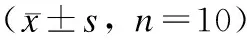
表4 CRPE在术后3周时对家兔血清中Ⅰ、Ⅱ型胶原含量的影响Tab.4 The effects of CRPE on collagen type Ⅰ and collagen type Ⅱ levels 3 weeks after operation in rabbit serum
2.5 CRPE在术后3周时对家兔血清中锌、铜含量的影响 与假手术组相比,模型组血清中锌、铜的含量显著升高,差异具有统计学意义(P<0.05);与模型组相比,CRPE(1.2 g/kg)和CRPE(2.4 g/kg)组均能升高血清中锌的含量,CRPE(2.4 g/kg)组还能升高血清中铜的含量,差异具有统计学意义(P<0.05,表6)。
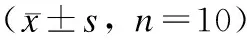
表5 CRPE在术后3周时对家兔血清中碱性磷酸酶、钙、磷的影响Tab.5 The effects of CRPE on alkaline phosphatase, Ca and P levels 3 weeks after operation in rabbit serum
2.6 CRPE对家兔骨折模型中骨组织P-Smad2和P-Smad3蛋白及mRNA的影响 与假手术组相比,模型组可以显著升高家兔骨组织中P-Smad2和P-Smad3蛋白及mRNA的水平;与模型组相比CRPE(1.2 g/kg)和CRPE(2.4 g/kg)组能更显著升高家兔骨组织中P-Smad2和P-Smad3蛋白及mRNA的水平,差异具有统计学意义(P<0.05,图1)。
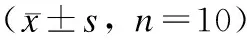
表6 CRPE在术后3周时对家兔血清中锌、铜含量的影响Tab.6 The effects of CRPE on Zn and Cu levels 3 weeks after operation in rabbit serum
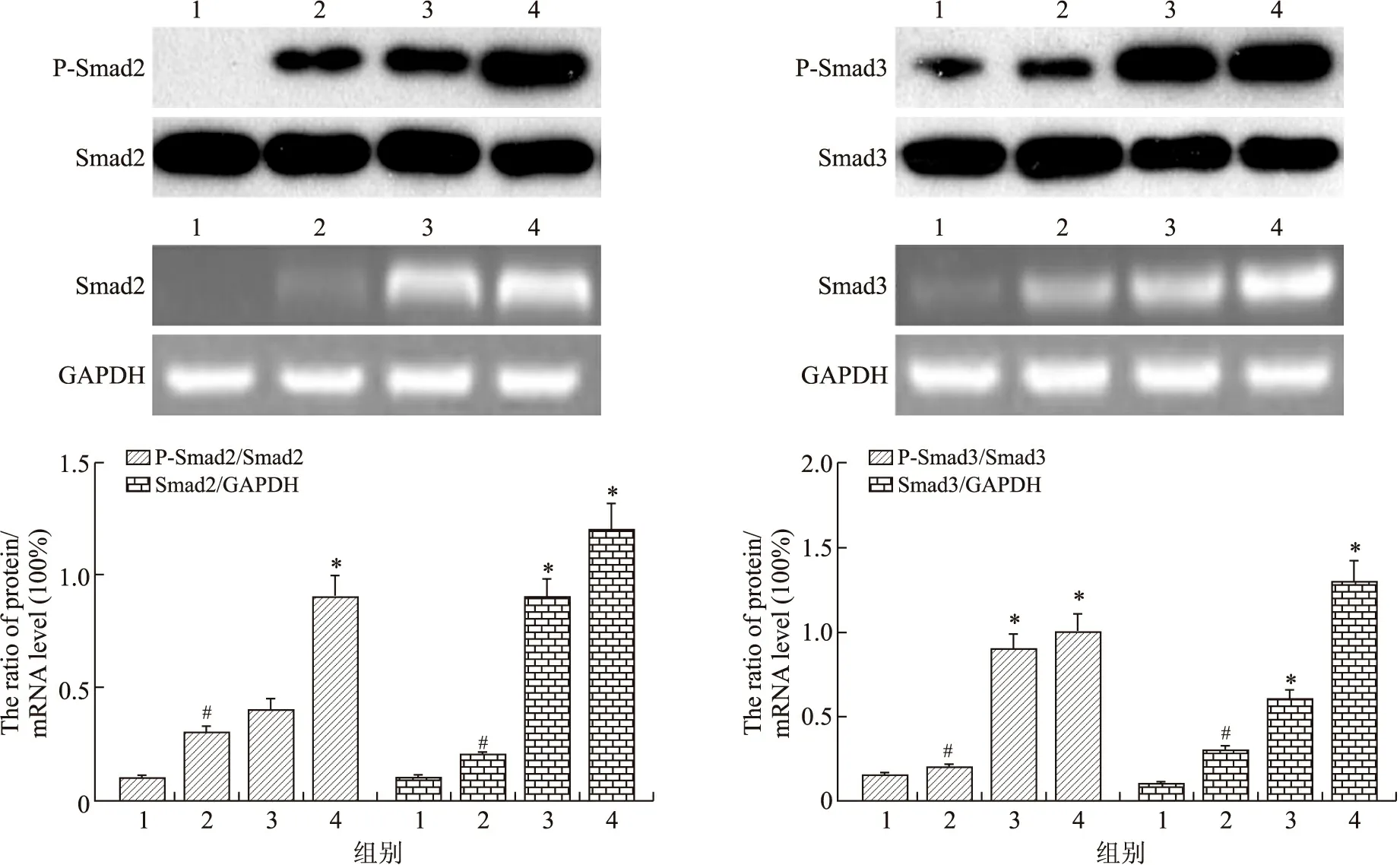
图1 CRPE对家兔骨折模型中骨膜组织P-Smad2和P-Smad3蛋白及mRNA的影响Fig.1 The effects of CRPE on P-Smad2 and P-Smad3 protein and mRNA levels in rabbit mucoperiosteal tissue
2.7 CRPE对家兔骨折模型中骨膜组织Smad7蛋白及mRNA的影响 与假手术组相比,模型组可以显著降低家兔骨组织中Smad7蛋白及mRNA的水平;与模型组相比,CRPE(1.2 g/kg)和CRPE(2.4 g/kg)组能显著升高家兔骨组织中Smad7蛋白及mRNA的水平,差异具有统计学意义(P<0.05,图2)。
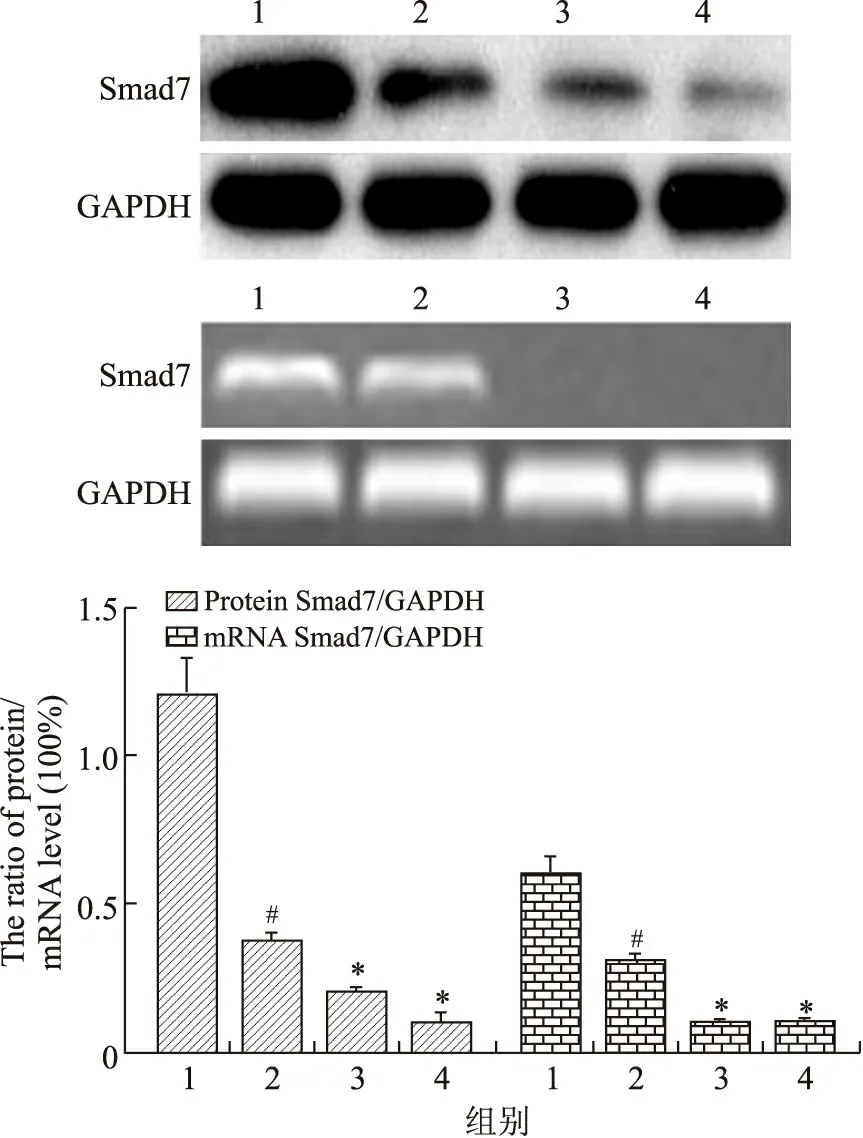
图2 CRPE对家兔骨折模型中骨膜组织Smad7蛋白及mRNA的影响Fig.2 The effects of CRPE on Smad7 protein and mRNA levels in rabbit mucoperiosteal tissue
2.8 CRPE对家兔骨折模型中骨膜组织PAI-1蛋白及mRNA的影响 与假手术组相比,模型组可以显著升高家兔骨组织中PAI-1蛋白及mRNA的水平;与模型组相比CRPE(1.2 g/kg)和CRPE(2.4 g/kg)组能更显著升高家兔骨组织中Smad7蛋白水平,CRPE(2.4 g/kg)组能显著升高PAI-1 mRNA的水平,差异具有统计学意义(P<0.05,图3)。
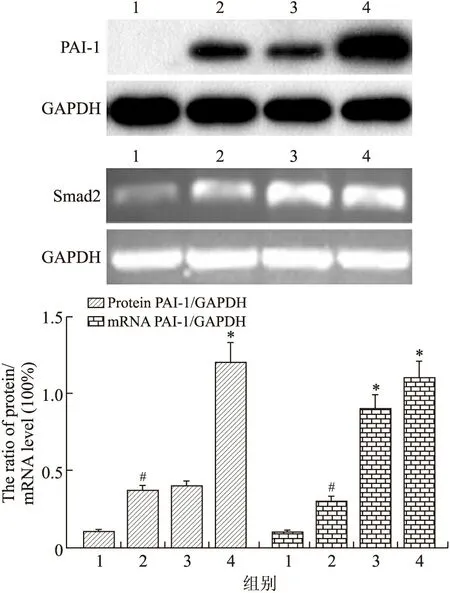
图3 CRPE对家兔骨折模型中骨膜组织PAI-1蛋白及mRNA的影响Fig.3 The effects of CRPE on PAI-1 protein and mRNA levels in rabbit mucoperiosteal tissue
3 讨 论
对于骨折愈合的进程,在临床上将骨折愈合分为四期:血肿机化期、骨痂形成期、骨性愈合期及骨痂塑性期。在整个骨折愈合的过程中,血肿机化期和骨痂形成期尤为重要[4]。在此期许多内源性生长因子,如胰岛素样生长因子(insulin-like growth factor, IGF)、血小板衍生生长因子(platelet-derived growth factor, PDGF)、内皮细胞生长因子(vascular endothelial growth factor, VEGF)、转化生长因子(transforming growth factor β, TGF-β)等,间充质细胞在炎症刺激下聚集、增殖、继而引起血管增生,并且向成骨细胞转化;随后机化组织中成纤维细胞合成和分泌大量胶原纤维,转化为纤维结缔组织,使骨骼连接。其中,TGF-β1在骨折愈合过程中的作用最突出。有研究表明,TGF-β1基因表达广泛存在于骨折愈合过程中,在调控血管平滑肌细胞的分化、参与血管形成、加快间充质细胞和成骨细胞的增殖速度、产生新骨基质方面均具有重要的作用[5]。 在本实验中,CRPE(1.2 g/kg)组和CRPE(2.4 g/kg)组可降低骨痂形成时间,缩小骨折愈合时间,在血肿机化期和骨痂形成期,相比模型组能更显著升高TGF-β1的含量,提示CRPE(1.2 g/kg)和CRPE(2.4 g/kg)对骨折愈合有促进作用。
在骨折愈合过程中,血清钙、磷及微量元素也发挥着不可或缺的作用。众多实验证明,血清钙磷含量可直接影响骨的钙化与溶解,其水平的升高在骨折愈合过程中有助于骨盐的沉积。不仅如此,在愈合过程中形成的骨痂钙磷含量与骨痂灰度以及骨的生物力学参数之间也有明显相关性。然而,骨痂中钙、磷和其他离子矿化速度主要是由成骨细胞调节,其分泌的基质能够促进这些离子的晶核形成,有利于骨盐矿化进行[6]。碱性磷酸酶(alkaline phosphatase, AKP/ALP)富含于成骨细胞胞质中,它作为成骨细胞功能标记物及分化程度指标。血清中AKP的浓度可以作为代表成骨细胞活动性增加或骨重建活跃性的指证[7]。在本实验中,骨痂形成期的血钙浓度及血清碱性磷酸酶的含量在CRPE(1.2 g/kg)组和CRPE(2.4 g/kg)组明显升高,提示CRPE可以通过增强骨盐的矿化和钙盐沉积促进骨折的愈合。
微量元素广泛参与体内的物质代谢,在骨折愈合过程中同样发挥了重要的作用。铜是赖氨酰氧化酶活性的必备条件,与其活性密切相关。锌则能增强碱性磷酸酶活性,使核酸和蛋白质合成增加。锌、铜含量的升高可以促进成骨细胞活性,有助于基质的形成和钙磷的沉积,促进骨折愈合;也促进弹性蛋白与胶原纤维的共价交联,使胶原蛋白纤维韧性增强[8]。在骨骼愈合过程中提高微量元素在血清中的浓度,能够补充酶系统缺少的辅酶从而有助于成骨细胞的功能,促进骨盐沉积;同时可以加强骨折端胶原纤维的交联,促进骨痂组织生长,促进骨折愈合。在本实验中,骨痂形成期的血清中锌、铜的浓度在CRPE(2.4 g/kg)组明显增加,提示CRPE可以通过提高血清中微量元素从而促进骨折的愈合。
虽然在已经发现的5种不同结构的TGF-β中,有64%~82%的氨基酸序列相同,但是在骨折愈合过程中TGF-β不同的结构作用各不相同,其中TGF-β1表达时间最久,作用最重要,它表达的高低影响骨折愈合的快慢[9]。其信号主要是通过TGF-β跨膜受体受体(TGF-β receptor R, TGF-βR,主要为TGF-β receptor Ⅰ, TGF-βRⅠ;TGF-β receptor Ⅱ, TGF-βRⅡ)以及胞内Smad信号通路介导。当外界有TGF-β1作用时,TGF-β1先与胞膜上TGF-βRⅡ结合,继而磷酸化TGF-βRⅠ并使其激活。激活的TGF-βRⅠ可磷酸化胞内的Smad2和Smad3蛋白,磷酸化的Smad2和Smad3蛋白与Co-Smad(Smad4)结合形成复合物(P-Smad2/3/4),继而转位入核与特定DNA序列结合,调节相应靶基因的表达[10]。Smad7可与TGF-βRⅡ胞内端磷酸区结合,抑制TGF-βRⅠ激活,从而起到对TGF-β/Smad通路负反馈调节的作用[11]。此外,TGF-β1也可以在不同细胞中激活非Smad通路,这些通路包括丝裂原活化蛋白酶(mitogen-activated protein kinase, MAPK)通路、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)通路等[12]。PAI-1是TGF-β1重要的靶基因,作为纤溶酶原激活物的抑制剂,能通过抑制纤溶酶的生成,增加细胞外基质的沉积,在创伤修复、凝血、肿瘤转移和炎症中都有非常重要的作用[13]。在本实验中,CRPE(1.2 g/kg)和CRPE(2.4 g/kg)组能更显著升高家兔骨组织中P-Smad2和P-Smad3蛋白及mRNA的水平,降低Smad7蛋白及mRNA的水平;而且CRPE(2.4 g/kg)组可以降低PAI-1蛋白及mRNA的水平。以上结果提示,CRPE可以通过激活TGF-β1/Smad信号通路中P-Smad2、P-Smad3和PAI-1,抑制Smad7来促进骨折愈合。
综上所述,CRPE可以促进实验家兔骨折愈合,其机制可能与刺激TGF-β1分泌,促进血钙释放,调节微量元素,增加Smad磷酸化,上调PAI-1的表达,抑制Smad7表达等有关。
[1] 周燕,张纲,卓贤露,等. TGF-β在骨折愈合中的调控[J]. 免疫学杂志, 2012, 28(4):353-362.
[2] 余志平,余高瞻,洪江. 骨折延迟愈合与血浆TGF-β1浓度的相关性分析[J]. 放射免疫学杂志, 2013, 26(6):850-851.
[3] 李鹏飞,刘春莹,郭俊莹,等. 不同种类人参茎叶中皂苷成分的比较[J]. 安徽农业科学, 2010, 38(24):13077-13079.
[4] 肖明锋. 对不同时期的骨折患者使用不同中药方剂进行治疗的效果探析[J]. 当代医药论丛, 2015, 13(6):33-34.
[5] 王磊,孙俊英. 血清TGF-β1和EGF检测对创伤性骨折愈合的影响[J]. 辽宁医学院学报, 2014, 35(4):28.
[6] 董华,胡乃武,董清平. 骨痛仙胶囊对家兔骨折血清碱性磷酸酶、钙、磷影响的实验研究[J]. 中医药学报, 2003, 31(2):51-52.
[7] 王伟卓,程一钊,郭雄,等. 大骨节病差异表达基因PAPSS2对成骨细胞矿化及碱性磷酸酶活性的影响[J]. 西安交通大学学报(医学版), 2014, 35(2):175-181.
[8] 张奋耿,凌秋英,叶泽亮. 伤科接骨片对实验性家兔骨折模型血清微量元素含量的影响[J]. 中医正骨, 2008, 20(5):329-330.
[9] 吴兴明,邹永根,石睿. 伴有颅脑损伤对骨折患者血清中VEGF和TGF-β1水平影响研究[J]. 中国实验诊断学, 2015, 19(1):32-34.
[10] SHI YG, MASSAGUE J. Mechanism of TGF-beta signaling from cell membrane to the nucleus[J]. Cell, 2003, 113(6):685-700.
[11] HAYASHI H, ABDOLLAH S, QIU Y, et al. The MAD-related protein Smad7 associates with the TGF-beta receptor and functions as an antagonist of TGFbeta signaling[J]. Cell, 1997, 89(7):1165-1173.
[12] STIPURSKY J, FRANCIS D, GOMES FC. Activation of MAPK/PI3K/SMAD pathways by TGF-β(1) controls differentiation of radial glia into astrocytesinvitro[J]. Dev Neurosci, 2012, 34(1):68-81.
[13] MAO L, KAWAO N, TAMURA Y, et al. Plasminigen activator inhibitor-1 is involved in impaired bone repair associated with diabetes in female mice[J]. PLoS One, 2014, 9(3):e92686.
(编辑 卓选鹏)
Effect and mechanism of the compound of radix dipsaci and pseudo-ginseng extract on bone fracture in rabbits
NING Tao1,2, HU Yong1
(1. Department of Orthopedics, the First Affiliated Hospital of Anhui Medical University, Hefei 230032; 2. Department of Orthopedics,
Objective To evaluate the effect and mechanism of the compound of radix dipsaci and pseudo-ginseng extract (CRPE) on bone fracture in rabbits. Methods The model of rabbit tibia fracture was used to detect the effects of CRPE on callus formation time and healing time. TGF-β1, collagen type Ⅰ, collagen type Ⅱ, alkaline phosphatase, Ca, P, Zn, Cu in rabbit serum were also measured. The protein and mRNA of P-Smad2, P-Smad3, Smad7 and PAI-1 were detected by RT-PCR and Western blot to evaluate the protective effect of CRPE. Results CRPE (1.2 g/kg and 2.4 g/kg) could significantly shorten callus formation time and healing time; and increase TGF-β1, collagen type Ⅰ, collagen type Ⅱ, alkaline phosphatase, Ca, P, Zn, Cu levels in rabbit serum. In addition, CRPE(1.2 g/kg and 2.4 g/kg) could increase P-Smad2, P-Smad3 and PAI-1 expressions and reduce the expression of Smad7 (P<0.05). Conclusion CRPE can improve the prognosis of bone fracture in rabbits and its mechanism might be related to TGF-β/Smad pathway.
compound of radix dipsaci and pseudo-ginseng extract; bone fracture; TGF-β1; Smad; PAI-1
2016-01-23
2016-04-26
校科研基金资助项目(No.2015xkj088)
Supported by the Research Foundation of Anhui Medical University (No.2015xkj088)
胡勇. E-mail: hyong8277@163.com
R966
A
10.7652/jdyxb201606023
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20161013.1039.014.html(2016-10-13)
