自制固相萃取柱-超高效液相色谱-串联质谱法同时测定果蔬中的8 种真菌毒素
2016-12-07韦迪哲冯晓元
王 蒙,姜 楠,韦迪哲,冯晓元
(北京农业质量标准与检 测技术研究中心,农业部农产品质量安全风险评估实验室(北京),北京 100097)
自制固相萃取柱-超高效液相色谱-串联质谱法同时测定果蔬中的8 种真菌毒素
王 蒙,姜 楠,韦迪哲,冯晓元*
(北京农业质量标准与检 测技术研究中心,农业部农产品质量安全风险评估实验室(北京),北京 100097)
建立基于自制固相萃取柱的样品净化-超高效液相色谱-串联质谱同时测定果蔬中8 种主要真菌毒素的方法,包括链格孢毒素、展青霉素、赭曲霉毒素A及橘青霉素。样品经80%乙腈溶液提取、离心后,通过自制固相萃取柱(HLB+MCX)排除杂质干扰,流出液经氮吹至近干后,直接用超高效液相色谱-串联质谱进行测定,基质外标法定量。在较宽的线性范围内,8 种毒素的线性相关系数(r2)均不小于0.99,定量限为1~5 μg/kg,在3 个不同添加水平下的加标回收率为76.0%~102.7%,相对标准偏差为0.8%~4.7%。该法灵敏度高,操作简单、快速,适用于苹果、樱桃和番茄等果蔬中痕量真菌毒素的测定。
真菌毒素;自制固相萃取柱;超高效液相色谱-串联质谱;果蔬
果蔬在生长、采收、贮藏、运输、销售等各个过程,易受到病原微生物污染,特别是在贮藏期间,由病原菌侵染引起的果蔬采后腐烂较重,产生并积累各种真菌毒素,对人和动物的健康造成了极大的危害。其中,最主要的污染果蔬的真菌毒素包括链格孢毒素(Alternaria toxin)、展青霉素(patulin,PAT)、赭曲霉毒素A(ochratoxin A,OTA)及橘青霉素(citrinin,CIT)[1-2]。链格孢毒素是由链格孢霉产生的一系列代谢产物,主要包括5 种:交链孢酚(alternariol,AOH)、交链孢酚单甲醚(alternariol monamethyl ether,AME)、细交链格孢酮酸(tenuazonic acid,TeA)、交链孢烯(altenuene,ALT)、腾毒素(tentoxin,TEN)。已有研究[3]表明:进食受链格孢毒素污染的粮食与人类食管癌高发病率密切相关。最近欧洲食品安全局对食品中链格孢毒素的潜在风险进行评估[4],研究结果表明,随膳食摄入的链格孢毒素对公众健康存在潜在风险,目前已开始着手制定链格孢毒素的最大残留限量标准。OTA是由曲霉菌属和青霉菌属等产生的次生代谢产物,广泛地分布于农产品及饲料中。OTA被证明具有较强的肝毒性和肾毒性,并有致畸、致癌和致突变作用[5]。PAT是由曲霉菌、青霉菌和丝衣霉产生的次级代谢产物,是水果中常见真菌毒素。PAT具有急性毒性,包括对动物的肺、脑水肿、肝脏、脾脏、肾的损害和免疫系统的毒害作用;也具有慢性毒性,表现在对动物的细胞毒性,基因毒性和免疫毒性[6]。CIT是一类醌甲基化合物,它对动物和人类具有肾毒性、基因毒性、致癌性、胚胎毒性,它是一种肾毒素,会破坏动物肾小管,毒害胚胎期动物的肾脏,是巴尔干肾病的潜在的病原体[7]。
长期以来,由于鲜食的果蔬在食用过程中会去除腐烂部位,果蔬中的真菌毒素污染未引起足够的重视。但已有研究结果表明,未腐烂部位也有不同程度的真菌毒素检出[8]。此外,在果汁、果酱、果酒等工业生产过程中,主要是通过剔除腐烂部分降低毒素及病菌污染的风险,但是这并不能完全消除风险。特别是有的病原菌,如链格孢菌属(Alternaria spp.)可使果实内部腐烂而表皮无明显变化,不能通过冲洗,分拣操作去除毒素,进而增加了果汁类产品的安全隐患。近年来,皮渣的回收利用成为果蔬加工和副产品综合利用的一大重点,特别是作为新型动物饲料应用广泛。这些产品极大增加了毒素污染食品和通过污染饲料继而污染畜禽等动物源性食品的风险,间接威胁人类饮食安全[9]。因此,建立果蔬中真菌毒素的检测技术研究已势在必行。
目前果蔬中真菌毒素的检测方法主要有薄层色谱法[10]、高效液相色谱法[11]、液相色谱-质谱法[12-15]、毛细管电泳[16]和免疫学检测方法[17-18]等,液相色谱-质谱法是应用最广泛的方法,也是我国果品中真菌毒素检测的标准方法之一。然而,上述方法前处理操作繁琐,如利用常规的固相萃取柱需经过淋洗、洗脱等步骤,难以满足大批量样品的快速检测;免疫亲和柱有较强的特异性,具有准确度高、灵敏度好等有点[19],但其检测成本高,仍未能满足同时测定果蔬中的主要真菌毒素。QuEChERS(quick, easy, cheap, effective, rugged, safe)技术作为一项新兴的前处理技术,已广泛用于真菌毒素的分析检测中[14,20-21]。但QuEChERS法净化样品需精确称量不同分散固相萃取剂的含量,如硫酸镁、N-丙基乙二胺(N-propyl ethylenediamine,PSA)、C18等,进而增加了前处理时间,不适于大批量样品同时操作。而利用本研究自制的固相萃取柱,直接将样品提取液自然通过固相萃取柱,并收集、浓缩,实现了一步净化,且批处理样品间重复性好,操作简便。因此,利用本实验自制的固相萃取柱,结合超高效液相色谱-串联质谱法,可适用于同时检测果蔬中8 种真菌毒素的定量分析。
1 材料与方法
1.1 材料、试剂与仪器
本实验所用的苹果、樱桃和番茄果实都购买于水果超市。挑选大小适中、色泽均匀、无病虫害、无机械损伤的果实。
链格孢毒素(AOH、AME、TeA、ALT、TEN)标准品 美国Sigma公司;OTA和PAT 美国Romer公司;CIT 以色列Fermenteck公司;乙腈、甲酸、乙酸铵(均为色谱纯) 美国Fisher公司。
固相萃取空柱管、亲水亲脂固相萃取填料(hydrophilic-lipophilic balanced,HLB,粒度40~60 μm)、阳离子交换色谱填料(mixed-mode cationic exchange,MCX,粒度40~60 μm) 北京广普达公司;AcquityTM超高效液相色谱仪-TQS串联质谱仪、电喷雾电离(electron spray ionization,ESI)接口 美国Waters公司;台式高速离心机 德国Sigma公司;氮吹仪美国Organomation公司;涡旋混合器 德国IKA公司;Milli-Q A10超纯水器 美国Millipore公司。
1.2 方法
1.2.1 标准溶液的配制
标准贮备液:用乙腈准确定容1 mg标准品于10 mL容量瓶,配成100 μg/mL质量浓度的标准储备液,密封冷冻储存于-20 ℃冰箱中。
标准工作液:分别配制1、2、5、10、50、100、200 μg/L的8 种真菌毒素的混合溶液,密封保存于-20 ℃冰箱中。
基质空白标准工作溶液:以不含真菌毒素的苹果、樱桃和番茄果实为材料,利用本实验前处理方法分别制
备苹果、樱桃和番茄的基质空白溶液。用基质空白溶液将标准工作液按相同比例稀释至1、2、5、10、50、100、200 μg/L,分别得到苹果、樱桃和番茄基质空白标准工作溶液。
1.2.2 样品处理
1.2.2.1 装柱及活化
取6 mL固相萃取空柱管,在底部铺上筛板,装入200 mg MCX填料,轻轻敲打使填料均匀填充,用筛板压平,再加入200 mg HLB填料,轻轻敲打,压好筛板,即得自制固相萃取柱。使用前用10 mL乙腈活化。
1.2.2.2 样品提取
称取水果样品5 g(精确至0.01 g),置于50 mL具塞离心管中;加入含1%乙酸的乙腈-水(80∶20,V/V)提取液25 mL,涡旋混匀,150 r/min常温振荡提取30 min后,以10 000 r/min离心10 min,吸取5 mL上清液转移至固相萃取柱,自然通过固相萃取柱,流出液于60 ℃条件下氮吹至近干,残渣用乙腈-5mmol/L的醋酸铵溶液(40∶60,V/V)溶解,混匀后过0.22 μm微孔滤膜,供超高效液相色谱-串联质谱测定。
按照1.2.2.2节方法测试后的样品,如果未检测到8 种真菌毒素将作为空白样品用于回收率实验和制备基质校正溶液。在进行加标实验时,取适量稀释后的标准溶液加入到空白样品中,充分混合后进行后续处理。
1.2.3 仪器条件
色谱柱为Acquity CORTECS UPLC C18(100 mm×2.1 mm,1.6 μm);柱温为40 ℃;进样体积为5 μL;流动相A为5 mmol/L乙酸铵,流动相B为乙腈;梯度洗脱条件为A在100%保持1 min后,3 min内降至5%,保持0.5 min后在0.1 min 内升至100%,保持1.4 min;流速0.3 mL/min;总运行时间6 min。
质谱条件:离子源模式:正负离子模式(ESI+和ESI-);毛细管电压:2.5 kV(ESI+)和-1.5 kV(ESI-);气化温度:400 ℃;去溶剂气流速:700 L/h;其余参数通过仪器自动调谐至最优。多反应监测(multi reaction monitor,MRM);8 种真菌毒素的MRM参数见表1。

表1 8 种真菌毒素的串联质谱检测参数Table 1 Optimized MRM parameters for 8 mycotoxins
2 结果与分析
2.1 色谱条件
本实验比较了水-甲醇、水-乙腈、乙酸铵溶液-甲醇、乙酸铵溶液-乙腈4 种流动相体系,结果表明以乙酸铵溶液-乙腈作为流动相体系,8 种真菌毒素的离子信号值增强,且峰形得到明显改善。确定流动相体系为乙酸铵溶液-乙腈后,进一步优化了乙酸铵的用量,结果表明水相加入5 mmol/L的乙酸铵时,8 种真菌毒素的出峰效果最佳。
采用流动注射泵连续进样方式进行质谱条件的优化,分别在ESI+模式和ESI-模式下进行全扫描,确定AME和PAT在负离子模式下的响应值高,ALT、TeA、OTA和CIT在正离子模式下的响应值显著高于负离子模式。而TEN和AOH在正离子模式下的灵敏度略高于负离子模式,考虑到负离子模式有利于降低基质效应[22],确定TEN和AOH的母离子分别是m/z 413.2,m/z 257.0。并通过对气化温度、锥孔电压、碰撞电压等质谱参数的优化,最终确定8种真菌毒素的MRM参数(表1),图1为10 μg/L标准溶液中8 种真菌毒素的定量离子质谱图。在色谱柱的选择上,通过比较BEH C18Column(100 mm×2.1 mm,1.7 μm)和CORTECS C18(100 mm×2.1 mm,1.6 μm)色谱柱的分离效果,发现两种色谱柱都能使8 种真菌毒素得到很好地分离。但从色谱行为看,CORTECS C18更加适合于分析这8 种真菌毒素,该柱内径和填料粒径均较小,能够获得良好的分离度。
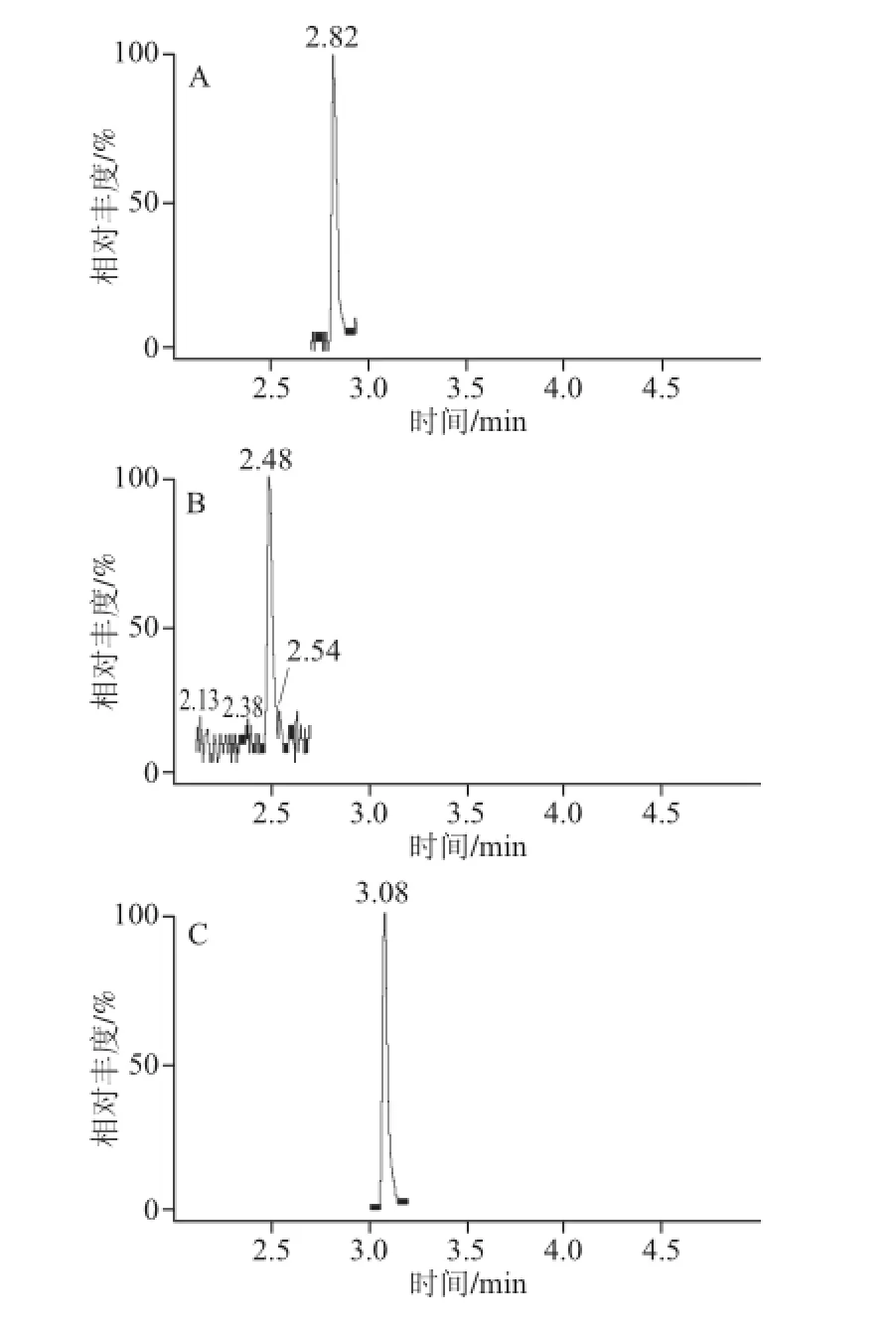

图1 8 种真菌毒素的混合标准溶液(100 μgg/L)定量离子质谱图Fig. 1 Mass spectra of 8 mycotoxins (10 μg/L)
2.2 样品净化条件的优化
2.2.1 固相萃取柱的选择
样品中含有蛋白质、色素、糖和有机酸等组分,这些杂质会严重干扰目标分析物的测定,同时也会大大缩短色谱柱的使用寿命,因此需要对样品进行净化前处理。而常规的固相萃取柱需经过淋洗、洗脱等步骤,处理操作繁琐,难以满足大批量样品的快速检测。因此开发了一种适用于快速前处理的固相萃取柱,即将含毒素的提取液直接加入固相萃取柱,收集过柱后的提取液,同时提取液中的杂质被固相萃取柱吸附(穿漏法)。
本实验考察了4 种常用固相萃取柱填料(PSA、C18、HLB、MCX)对净化效果的影响。结果发现,自制C18柱显著降低TeA的回收率;PSA柱可显著降低基质效应,但CIT添加回收率低,这可能是由于PSA含有2 个氨基,与CIT中的羧基发生化学反应,进而降低了CIT的回收率。自制HLB柱和MCX柱对8 种真菌毒素的回收率无显著影响,但由于HLB柱是通用型吸附剂,选择性较低,对样品的净化不够理想。但使用自制混合型固相萃取柱(HLB+MCX)进行前处理后,由于该柱使用了可在广泛的pH值范围内保持稳定的反相和离子交换吸附剂,其中MCX为混合型阳离子固相萃取柱,具有反相分离和离子交换双重作用,可有效去除样品中色素等碱性杂质和蛋白质等两性杂质[23],而HLB是亲水-亲脂平衡的吸附剂,其保留机理为反相,可有效去除脂肪等非极性杂质;从而能够保证方法的最优化和高选择性,获得很好的净化效果,因此确定采用HLB+MCX作为固相萃取柱的吸附填料。
2.2.2 自制固相萃取柱净化效果
已发表研究[11-13,15,24]中果蔬真菌毒素的净化多采用Waters HLB柱进行。实验分别考察了自制固相萃取柱与Waters Oasis HLB 固相萃取的净化效果,通过加标回收来考察两种固相萃取柱的净化效果。其中采用HLB柱净化需将含毒素的提取液转换成水相溶液,加入HLB柱,真菌毒素被吸附,采用10%甲醇溶液淋洗,最后通过甲醇-乙腈(含1%甲酸)洗脱(吸附法)。
如表2所示,自制固相萃取柱的净化效果要好于Waters Oasis HLB固相萃取柱。HLB固相萃取柱是通过一个“特殊的极性捕获基团”提供很好的水浸润性来增加对极性物质的保留[25],能对8 种毒素有效吸附,但HLB柱吸附法不利于3 种真菌毒素(AOH、AME和CIT)的回收,加标回收率仅为70.6%~74.3%(表2),而为了提高样品的净化效果,利用本实验自制复合体系对样品进行处理。经自制固相萃取柱净化后的8 种真菌毒素的回收率均在83.5%以上。此外,还对自制固相萃取的使用方式进行优化,通过对比穿漏法和吸附法对8 种真菌毒素的影响,结果发现,大部分真菌毒素采用2 种方式的回收率无显著差异,而PAT仅适用于穿漏法,吸附法的回收率低于30%;最终确定简便、快速的前处理方式(穿漏法)为果蔬真菌毒素的最适净化方式。

表2 2 种不同固相萃取净化过程对8 种真菌毒素回收率的影响Table 2 Effects of 2 different SPEs on the recoveries of 8 mycotoxins
图2 2 种不同固相萃取柱净化效果图Fig. 2 The purifi cation effi ciency by 2 different SPEs
2.3 一次性滤膜的选择
本实验研究了不同滤膜对真菌毒素的影响,通过使用尼龙膜、聚醚砜膜、聚偏二氟乙烯膜和聚四氟乙烯膜,分别对同一质量浓度标准样品进行过滤,经仪器测定发现尼龙膜和聚醚砜膜会对待测组分产生明显吸附作用,使得测定结果明显偏低,而聚四氟乙烯膜的回收率略高于聚偏二氟乙烯膜的,故本实验采用聚四氟乙烯膜进行过滤。
2.4 方法的线性方程与定量限(limit of quantity,LOQ)

表3 苹果、樱桃和番茄中8 种真菌毒素的线性范围、相关系数(r2)和LLOOQQTable 3 Linear ranges, correlation coeffi cients (r2) and limits off quantitation (LOQs) for 8 mycotoxins
据调研,苹果、樱桃和番茄是最易感染上述8 种真菌毒素;用乙腈配制质量浓度均为1、2、5、10、50、100、200 μg/L的8 种真菌毒素不同基质的混合标准溶液。在优化条件下进行测定,分别以峰面积(Y)对质量浓度(X)作工作曲线,结果显示,真菌毒素在1~200 μg/L(7 种)和5~200 μg/L PAT范围内有良好的线性关系,相关系数为0.992 1~0.999 8。以10 倍信噪比计,8 种真菌毒素的LOQ为1~5 μg/kg(表3)。方法的精密度良好、定量限低,能满足样品中真菌毒素检测的需要。
2.5 加标回收率和精密度实验结果
取空白苹果、樱桃和番茄样品,添加LOQ、10、50 μg/kg 3 个水平的8 种真菌毒素,每个添加水平重复测定5 次。8 种目标物质在3 个加标水平的平均回收率为76.0%~102.7%,相对标准偏差为0.8%~4.7%(表4),具有较高的回收率和精密度。

表4 苹果、樱桃和番茄中8 种真菌毒素的添加回收率和精密度(n==55)Table 4 Recovery rates and precision for 8 mycotoxins spiked in apples, sweet cherries and tomatoes (n == 55))
3 结 论
本实验采用自制混合型固相萃取柱结合超高效液相色谱-质谱技术,建立了测定苹果、樱桃和番茄等果蔬样品中8 种主要真菌毒素的分析方法。方法的加标回收率为76.0%~102.7%,相对标准偏差为0.8%~4.7%,LOQ为1~5 μg/kg,能满足果蔬样品中真菌毒素痕量分析的要
求。与目前测定真菌毒素使用最为普遍的固相萃取柱相比,在保持分析准确度、灵敏度的前提下,使用自制混合固相萃取柱,大幅度地降低了使用成本,方法值得推广应用于果蔬及其制品中真菌毒素的检测分析。
[1] DRUSH S, RAGAB W. Mycotoxins in fruits, fruit juice, and dried fruits[J]. Journal of Food Protection, 2003, 66: 1514-1527.
[2] BARKAI GOLAN R, PASTER N. Mouldy fruits and vegetables as a source of mycotoxins: part 1[J]. World Mycotoxin Journal, 2008, 1: 147-159. DOI:10.3920/WMJ2008.x018.
[3] 安玉会, 卢荣华, 冯文舟, 等. 林县交链孢霉毒素-交链孢醇单甲醚和交链孢烯的协同毒性和致畸作用研究[J]. 癌症, 1988(7): 54-55.
[4] EFSA on Contaminants in the Food Chain (CONTAM). Scientific opinion on the risks for animal and public health related to the presence of Alternaria toxins in feed and food[J]. EFSA Journal, 2011, 9(10): 2407.
[5] 赵志辉. 农产品和饲料中常见真菌毒素的种类和危害[J]. 北京工商大学学报(自然科学版), 2012, 30(4): 8-11.
[6] de MELO F T, de OLIVEIRA I M, GREGGIO S, et al. DNA damage in organs of mice treated acutely with patulin, a known mycotoxin[J]. Food and Chemical Toxicology, 2012, 50(10): 3548-3555. DOI:10.1016/j.fct.2011.12.022.
[7] WU T S, YANG J J, YU F Y, et al. Evaluation of nephrotoxic effects of mycotoxins, citrinin and patulin, on zebrafish (Danio rerio) embryos[J]. Food and Chemical Toxicology, 2012, 50(12): 4398-4404. DOI:10.1016/j.fct.2012.07.040.
[8] ROBIGLIO A L, LOPEZ S E. Mycotoxin production by Alternaria alternata strains isolated from red delicious apples in Argentina[J]. International Journal of Food Microbiology, 1995, 24: 413-417. DOI:10.1016/0168-1605(94)00035-5.
[9] 胡媛媛, 马良, 张宇昊. 柑橘果实中主要的真菌毒素及其检测技术[J].食品工业科技, 2013, 34(24): 385-391.
[10] 江涛, 张靖, 刘红蕾, 等. 大米中桔青霉素的薄层色谱分析[J]. 卫生研究, 2002, 31(6): 470-472.
[11] 陈月萌, 李建华, 张静, 等. 高效液相色谱-荧光检测法同时测定水果中的3 种链格孢霉毒素[J]. 分析试验室, 2012, 31(6): 70-73.
[12] 何强, 李建华, 孔祥虹, 等. 超高效液相色谱-串联质谱法同时测定浓缩苹果汁中的4 种链格孢霉毒素[J]. 色谱, 2010, 28(12): 1128-1131.
[13] 李建华, 何强, 孔祥虹, 等. 凝胶渗透净化-超高效液相色谱-串联质谱法测定橙汁中链格孢霉毒素[J]. 化学计量分析, 2012, 21(3):20-23.
[14] 史文景, 赵其阳, 焦必宁. UPLC-ESI-MS-MS结合QuEChERS同时测定柑橘中的4 种真菌毒素[J]. 食品科学, 2014, 35(20): 170-174. DOI:10.7506/spkx1002-6630-201420034.
[15] JURG N, PATRICK S, MARTIN R, et al. Determination of six Alternaria toxins with UPLC-MS/MS and their occurrence in tomatoes and tomato products from the Swiss market[J]. Mycotoxin Research, 2011, 27(5): 265-271. DOI:10.1007/s12550-011-0103-x.
[16] 杜建中, 陈海莉, 吴金媚, 等. 毛细管电泳分析测定霉变食品中桔青霉素的研究[J]. 食品科学, 2009, 30(6): 203-206.
[17] DUAN Zhaohui, LIN Zhuangsen, YAO Herui, et al. Preparation of artificial antigen and egg yolk-derived immunoglobulin (IgY) of citrinin for enzyme-linked immunosorbent assay[J]. Biomedical and Environmental Sciences, 2009, 22(3): 237-243.
[18] ACKERMANN Y, CURTUI V, DIETRICH R, et al. Widespread occurrence of low levels of alternariol in apple and tomato products, as determined by comparative immunochemical assessment using monoclonal and polyclonal antibodies[J]. Journal of Agricultural and Food Chemistry, 2011, 59: 6360-6368. DOI:10.1021/jf201516f.
[19] 范素芳, 李培武, 王秀嫔, 等. 高效液相色谱和高效液相色谱-离子阱质谱测定花生、玉米和大米中黄曲霉毒素方法比较[J]. 食品科学, 2011, 32(12): 254-258.
[20] MYRESIOTIS C K, TESTEMPASIS S, VRYZAS Z, et al. Determination of mycotoxins in pomegranate fruits and juices using a QuEChERS-based method[J]. Food Chemistry, 2015, 182: 81-88. DOI:10.1016/j.foodchem.2015.02.141.
[21] HAJNAL-JANIC E P, ORCIC D Z, MASTILOVIC J S, et al. The choice of preparation method for the determination of Alternaria toxins from wheat samples by LC-MS/MS[J]. Food and Feed Research, 2014, 41(2): 131-138.
[22] WALRAVENSA J, MIKULA H, RYCHLIK M, et al. Development and validation of an ultra-high-performance liquid chromatography tandem mass spectrometric method for the simultaneous determination of free and conjugated Alternaria toxins in cereal-based foodstuffs[J]. Journal of Chromatography A, 2014, 1372: 91-101. DOI:10.1016/ j.chroma.2014.10.083.
[23] PARK Y, CHOE S, LEE H, et al. Advanced analytical method of nereistoxin using mixed-mode cationic exchange solid-phase extraction and GC/MS[J]. Forensic Science International, 2015, 252:143-149. DOI:10.1016/j.forsciint.2015.04.01.
[24] ZHAO K, SHAO B, YANG D J, et al. Natural occurrence of four Alternaria mycotoxins in tomato- and citrus-based foods in China[J]. Journal of Agricultural and Food Chemistry, 2015, 63: 343-348. DOI:10.1021/jf5052738.
[25] CAPRIOTTI A L, CAVALIERE C, FOGLIA P, et al. Multiclass analysis of mycotoxins in biscuits by high performance liquid chromatography-tandem mass spectrometry. comparison of different extraction procedures[J]. Journal of Chromatography A, 2014, 1343: 69-78. DOI:10.1016/j.chroma.2014.04.009.
A Solid Phase Extraction-Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry Method for the Determination of 8 Mycotoxins in Fruits and Vegetables
WANG Meng, JIANG Nan, WEI Dizhe, FENG Xiaoyuan*
(Risk Assessment Laboratory for Agro-Products (Beijing), Ministry of Agriculture, Beijing Research Center for Agricultural Standards and Testing, Beijing 100097, China)
A novel method for the determination of 8 mycotoxins, including alternariol (AOH), alternariol monamethyl ether (AME), tenuazonic acid (TeA), alte nuene (ALT), tentoxin (TEN), patulin (PAT), ochratoxin A (OTA) and citrinin (CIT) in fruits and vegetables was developed using a laboratory-prepared solid phase extraction (SPE) column coupled with ultra performance liquid chromatography tandem mass spectrometry (UPLC-MS/MS). The sample was extracted with 80% acetonitrile solution, and cleaned up on the SPE column. The separation of the analytes was carried out on an Acquity CORTECS UPLC C18column (100 mm × 2.1 mm, 1.6 μm) using a mobile phase composed of a mixture of acetonitrile and 5 mmol/L ammonium acetate aqueous solution with gradient elution. The extract was determined by UPLC-MS/MS. Matrixmatched calibration was used for the quantifi cation. The proposed method showed a good linear correlation with correlation coeffi cients all above 0.99. The recoveries for blank samples fortifi ed at three levels ranged from 76.0% to 102.7% with RSDs from 0.8% to 4.7%. The limits of detection (LODs) ranged from 1 to 5 μg/kg. The method possessed the advantages of sensitivity, simplicity and fastness, and was successfully applied in the determination of low levels of mycotoxins residues in apple, sweet cherry and tomato samples.
mycotoxins; laboratory-prepared solid phase extraction column; ultra performance liquid chromatography tandem mass spectrometry (UPLC-MS/MS); fruits and vegetables
10.7506/spkx1002-6630-201610037
TS207.3
A
1002-6630(2016)10-0213-06
王蒙, 姜楠, 韦迪哲, 等. 自制固相萃取柱-超高效液相色谱-串联质谱法同时测定果蔬中的8 种真菌毒素[J]. 食品科学, 2016, 37(10): 213-218. DOI:10.7506/spkx1002-6630-201610037. http://www.spkx.net.cn
WANG Meng, JIANG Nan, WEI Dizhe, et al. A solid phase extraction ultra performance liquid chromatography-tandem mass spectrometry method for the determination of 8 mycotoxins in fruits and vegetables[J]. Food Science, 2016, 37(10): 213-218. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201610037. http://www.spkx.net.cn
2015-11-10
北京市自然科学基金项目(6154023);北京市农林科学院青年基金 项目(QNJJ201518)
王蒙(1980—),女,副研究员,博士,研究方向为农产品质量安全与标准。E-mail:ameng-001@163.com
*通信作者:冯晓元(1965—),女,研究员,博士,研究方向为果品质量与安全。E-mail:fengxiaoyuan2014@126.com
