褐飞虱NlTgo基因的克隆及功能研究
2016-12-07陈龙飞万品俊王渭霞傅强朱廷恒
陈龙飞 万品俊 王渭霞,* 傅强 朱廷恒,*
(1浙江工业大学 生物与环境工程学院, 杭州310014; 2中国水稻研究所 水稻生物学国家重点实验室, 杭州 310006;*通讯联系人, E-mail: weixwang74@126.com;thzhu@zjut.edu.cn)
褐飞虱NlTgo基因的克隆及功能研究
陈龙飞1万品俊2王渭霞2,*傅强2朱廷恒1,*
(1浙江工业大学 生物与环境工程学院, 杭州310014;2中国水稻研究所 水稻生物学国家重点实验室, 杭州 310006;*通讯联系人, E-mail: weixwang74@126.com;thzhu@zjut.edu.cn)
CHEN Longfei, WAN Pinjun, WANG Weixia,et al. Molecular cloning and functional analysis ofNlTgoin the rice brown planthopper,Nilaparvatalugens(Hemiptera: Delphacidae). Chin J Rice Sci, 2016, 30(6): 653-660.
转录因子Tango(Tgo)在昆虫神经元发生、血细胞生成、性别决定、肠道发育等过程中发挥重要作用。克隆了褐飞虱Tango基因(NlTgo),应用荧光定量PCR和RNAi探索了NlTgo在褐飞虱中的表达动态和生物学功能。结果表明,NlTgo的开放阅读框为2007 bp,推测编码669个氨基酸残基。多序列比对表明NlTgo与已知的Tgo高度同源,其中与人体虱(Pediculushumanuscorporis) Tgo的一致性达68%。系统进化分析表明,NlTgo与豌豆长管蚜(Acyrthosiphonpisum)、始红蝽(Pyrrhocorisapterus)和臭虫(Cimexlectularius)的Tgo在系统发育树中形成一个类群。时空表达谱表明NlTgo在褐飞虱1龄、2龄时期高表达,在卵期表达量较低;在卵巢中表达量最高,在体壁的表达量较低。RNAi结果表明,注射dsNlTgo后4 d,NlTgo的表达量较空白对照组显著降低了77%,并导致若虫不能正常蜕皮而死亡。其中,处理5 d后褐飞虱的存活率仅为23%,显著低于注射dsGFP的对照组(98%)。结果显示,NlTgo与褐飞虱的生长发育有关,可作为防治褐飞虱的潜在靶标。
褐飞虱; Tango; RNA干涉; 蜕皮; 害虫防治
Tango属于碱性/螺旋-环-螺旋(basic/helix-loop-helix, bHLH)家族中bHLH-PAS亚家族蛋白,其广泛存在于黑腹果蝇(Drosophilamelanogaster)等真核生物中[1]。Tango包含一个典型的bHLH功能域和两个PAS功能域,其中bHLH功能域由大约60个氨基酸残基组成[2]。bHLH功能域进一步划分为碱性区(basic region, BR)和α螺旋-环-α螺旋区(helix-loop-helix, HLH),其中碱性区与DNA结合,HLH则促进不同bHLH蛋白之间形成同源二聚体或异源二聚体[3]。Tango及其所属的bHLH蛋白在进化过程中功能较为保守,黑腹果蝇Tango与其哺乳动物中同源物Arnt均与其他bHLH-PAS蛋白形成二聚体[4],参与神经元发生、肌细胞生成、血细胞生成、细胞分化和增殖、性别决定、环境毒素影响等一系列发育过程[5, 6]。其中,PAS亚家族主要参与中线与气管的发育、昼夜节律、毒素降解等生理过程[7]。在黑腹果蝇中,Tango与Sim、Sima或Trh等bHLH蛋白形成二聚体,然后通过中枢神经系统中线元件(CNS midline element, CME)调控靶基因的转录[8]。
褐飞虱[Nilaparvatalugens(Stål)]属半翅目飞虱科,通过取食水稻韧皮部汁液和传播水稻病毒侵害水稻[9, 10]。在中国,褐飞虱每年可导致水稻减产10~15万t,间接造成数十亿元的经济损失[11]。褐飞虱适应性强,繁殖量大。近年来以调控褐飞虱变态发育基因为靶标,应用RNA干扰技术控制褐飞虱的发生成为可能[12, 13]。由此可见,克隆褐飞虱重要功能基因,明确其生物学功能,对褐飞虱的防治具有重要的指导意义[14]。
Tango等bHLH-PAS家族成员作为调控中枢神经系统中线和气管发育的重要转录因子,其在黑腹果蝇等昆虫中的研究已取得了一系列的成果[15],而在褐飞虱中尚未见相关研究。此外,近年来,以调控褐飞虱变态发育的基因为靶标,借助于RNA干扰手段成为害虫控制的一种有效防控策略。因此,迫切需要发掘更多有效的靶标基因。本研究克隆了褐飞虱Tango基因,分析了其结构域特征及进化关系,明确了其在褐飞虱中的时空表达动态,并通过RNAi技术研究其在褐飞虱生长发育过程中的作用,以期为褐飞虱的防治提供新的靶标。
1 材料与方法
1.1 供试虫源
供试虫源为中国水稻研究所培育的褐飞虱TN1种群,在水稻TN1上连续饲养170代以上。饲养湿度为(27±1)℃,相对湿度为80%~85%,光周期为16 h 光照/8 h 黑暗。
1.2 总RNA的提取及第1链cDNA的合成
收集褐飞虱卵、1~5龄若虫和短翅型雌雄虫(初羽化后48 h内),各个处理样本量(卵质量或虫质量)8 mg。此外,选取初羽化(48 h内)的短翅型雌成虫,在解剖镜下分离体壁、头、卵巢、脂肪体、中肠和足等组织或器官(各组织或器官鲜质量约2 mg)。以上样品置于1.5 mL的Eppendorf管中经液氮冷冻后,-80℃冰箱保存备用。参照总RNA分离试剂盒(Total RNA Isolation Kit,Invitrogen, USA)说明书,用Trizol法提取总RNA。取1 μg总RNA,根据逆转录试剂盒(ReverTra Ace qPCR RT Master Mix with gDNA Remover,日本Toyobo) 说明书合成第1链cDNA。合成的cDNA贮存于-20℃冰箱中备用。每个处理均设置3个技术重复和3个生物学重复。
1.3 褐飞虱NlTgo的克隆
检索褐飞虱基因组和转录组数据库,得到一条编码Tgo的单拷贝基因NlTgo。用Primer Premier 5.0软件设计基因特异性引物(表1),利用PCR进行克隆验证,扩增体系共25 μL,包括rTaqDNA聚合酶(5 U/μL)0.125 μL,10×缓冲液 2.5 μL,dNTP( 2.5 mmol/L) 2.0 μL,引物(10 μmol /L)各1 μL,cDNA模板1 μL,双蒸水17.375 μL。将扩增产物连接于TOPO2.1载体(Invitrogen)上,转化至DH5α的大肠杆菌感受态细胞中,随机挑选4个阳性克隆提取质粒,质粒DNA在ABI3730测序仪上进行双端测序。
1.4 序列分析及进化树的构建
利用Lasergene软件推导目的核苷酸序列编码的氨基酸序列,根据NCBI的CDD(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析其保守结构域。利用ClustalW软件[16]进行多序列比对,MEGA 6.0软件构建系统发育树(Neighbor-Joining法),自展(bootstrap)值为1000[17]。
1.5 实时荧光定量PCR(qRT-PCR)
以提取的各样本的总RNA为模板,合成cDNA后用于qRT-PCR。反应体系如下:荧光定量PCR检测试剂(SYBR Green Real time PCR Master Mix, TOYOBO, Japan) 10 μL,上下游引物(10 μmol/L)(表1)各0.6 μL,cDNA模板2 μL,双蒸水6.8 μL。 qRT-PCR采用两步法:94℃下预变性1 min;94℃下变性15 s,58℃下退火40 s,40次循环。采用2-ΔΔCT法分析数据[18]。以褐飞虱核糖体蛋白S18基因(rps18)作为内参基因[19],3次技术重复和3次生物学重复。
1.6 dsRNA合成和生物测定
根据目的基因核苷酸序列设计合成双链RNA(double-stranded RNA, dsRNA)的引物(表1)。参考双链RNA合成试剂盒(MEGA script RNAi,Ambion, Austin, TX) 说明书完成dsRNA的体外转录。分别用琼脂糖凝胶电泳和Nanodrop 2000 (Thermo) 检测dsRNA的完整性和浓度。
表1 RT-PCR、qPCR和dsRNA合成引物
Table 1. Primers used for RT-PCR, qPCR and dsRNA synthesis.

引物名称Primername正向引物(5'-3')Forwardsequence(5'-3')反向引物(5'-3')Reversesequence(5'-3')基因克隆Genecloning NlTgoGGCTGTTGCGCATATGAAGGATGTCGGACAACTCCTGCTG双链RNA合成dsRNAsynthesis dsNlTgoT7-ACCGACGAGGTCGAGTACATT7-GTGTGTAGGTGGGTGACCTG dsGFPT7-AGATTTGTATAGTTCATCCATGCCATGTT7-AGAATGAGTAAAGGAGAAGAACTTTTCA定量PCRqPCR qNlTgoGGAGGAGGATGGTTCACACTGGTCCACAAACGTGAACTTG qNl18sCGCTACTACCGATTGAAGGAAACCTTGTTACGACTT
dsRNA的注射参考Wang等[20-21]的方法。选取4龄若虫作为试虫(约120头),在其胸部节间膜注射50 ng(约0.06 μL)的dsNlTai或dsGFP(对照组)。注射后的试虫饲养于TN1水稻苗上,第2天移除死虫(死亡率仅为1.67%),并将剩下的活虫分4个重复转移到新的水稻苗上,逐日观察试虫的存活数、若虫表型等发育情况。此外,根据以往实验室注射经验,在注射后第4天,每个处理组中选取20头试虫用于总RNA提取,每个处理4个重复,每个重复5头若虫,采用1.5中的qPCR测定基因的相对表达量。
1.7 数据分析及统计
本研究数据分析采用DPS数据处理系统(Data Processing System)[22]软件,单因素方差分析(One-way ANOVA)采用Duncan新复极差法进行显著性差异分析,文中所用数据皆为平均值±标准差,并用不同的小写字母代表不同组之间存在显著差异(P<0.05)。
2 结果与分析
2.1 NlTgo的克隆及序列分析
通过RT-PCR克隆得到褐飞虱Tango基因,并将其命名为NlTgo。NlTgo的ORF为2007 bp,推测编码668个氨基酸。NlTgo含有1个bHLH保守域和2个PAS结构域(图1)。多序列比对表明NlTgo与人体虱(Pediculushumanuscorporis)Tgo的一致性最高,达68%;其次是赤拟谷盗(Triboliumcastaneum),达67%;最低是热带切叶蚁(Attacephalotes),为58%。采用MEGA6.0软件选取来自其他14个物种中的Tgo序列与褐飞虱中Tgo构建系统发育树(图2),结果显示,褐飞虱属单独一支,与豌豆长管蚜(Acyrthosiphonpisum)、始红蝽(Pyrrhocorisapterus)、臭虫(Cimexlectularius)进化关系较近。
2.2 NlTgo的时空表达模式
qPCR结果表明,NlTgo在褐飞虱发育的各阶段均表达,并呈现出一定的波动性。其中,NlTgo在褐飞虱1龄、2龄表达较高,在3~5龄和成虫期的表达量次之,在卵期表达量最低(图3)。组织或器官表达谱表明NlTgo在褐飞虱卵巢中的表达量最高,在中肠、足、头中的表达量次之,在脂肪体、体壁中表达量最低(图4)。
2.3 dsNlTgo对褐飞虱目的基因及其生物学的影响
注射dsNlTgo后4 d,同对照组相比,处理组中试虫的NlTgo表达量显著下降了77%,且两组间存在极显著差异,表明dsNlTgo使NlTgo的表达量下降(图5-A)。
与对照组相比,注射dsNlTgo后3 d,10%的褐飞虱死亡。此外,注射后4、5 d,处理组分别有40%、77%的若虫死亡,存活率分别为60%、23%,均显著低于对照组(分别为98%、98%)(P<0.05)(图5-B)。注射后,若虫发育至成虫的历期(2.8 d)与对照组(3.0 d)无显著差异(P>0.05)。
注射dsNlTgo后5 d,若虫在进入5龄时发育受阻,中胸背板处旧表皮可以裂开但不能完全蜕去,依然粘附在虫体体表,不能完全蜕下而死亡(死亡若虫中98%表现蜕皮不正常),而对照组则正常进入5龄,可见蜕下的旧表皮(图6)。

昆虫名称及Tango的GenBank登录号:Ph-人体虱(XP_002430960.1); Cl-温带臭虫(XP_014259945.1); Cm-四纹豆象(AFL70632.1); Ld-马铃薯甲虫(AKG92750.1); Pa-始红蝽(AGI17574.1); Tc-赤拟谷盗(XP_008190739.1); Ac-豌豆长管蚜(XP_008180102.1)。
Insect species and GenBank accession numbers of Tango: Ph,Pediculushumanuscorporis(XP_002430960.1); Cl,Cimexlectularius(XP_014259945.1); Cm,Callosobruchusmaculatus(AFL70632.1); Ld,Leptinotarsadecemlineata(AKG92750.1); Pa,Pyrrhocorisapterus(AGI17574.1); Tc,Triboliumcastaneum(TC004710); Ac,Acyrthosiphonpisum(XP_008180102.1).
图1 褐飞虱与其他物种Tgo氨基酸序列比对
Fig. 1. Alignment of amino acid residues of Tgo in Nilaparvata lugens and other insects.

昆虫名称及Tango的GenBank登录号:Ph-人体虱(XP_002430960.1); Cl-温带臭虫(XP_014259945.1); Cm-四纹豆象(AFL70632.1); Ld-马铃薯甲虫(AKG92750.1); Pa-始红蝽(AGI17574.1); Tc-赤拟谷盗(XP_008190739.1); Ac-豌豆长管蚜(XP_008180102.1); Dm-果蝇(FBgn0264075); Nv-蝇蛹金小蜂(Nasvi2EG004242); Bm-家蚕(BGIBMGA003472); Hs-印度跳蚁(HSAL22140); Ag-冈比亚按蚊(AGAP009748); Am-西方蜜蜂(GB44259); Aa-埃及伊蚊(AAEL010343)。
Insect species and GenBank accession numbers of Tango: Ph,Pediculushumanuscorporis(XP_002430960.1); Cl,Cimexlectularius(XP_014259945.1); Cm,Callosobruchusmaculatus(AFL70632.1); Ld,Leptinotarsadecemlineata(AKG92750.1); Pa,Pyrrhocorisapterus(AGI17574.1); Tc,Triboliumcastaneum(TC004710); Ac,Acyrthosiphonpisum(XP_008180102.1); Dm,Drosophilamelanogaster(FBgn0264075); Nv,Nasoniavitripennis(Nasvi2EG004242); Bm,Bombyxmori(BGIBMGA003472); Hs,Harpegnathossaltator(HSAL22140); Ag,Anophelesgambiae(AGAP009748); Am,Apismellifera(GB44259); Aa,Aedesaegypti(AAEL010343).
图2 褐飞虱与其他昆虫的Tango的进化树
Fig. 2. Phylogenetic relationship of Nilaparvata lugens Tgo and insect homologues.

样本量n=3。不同小写字母代表不同组之间存在显著差异(P<0.05)。
Different lowercase letters indicate significant difference at the 0.05 level between different groups.n=3
图3 褐飞虱不同发育阶段NlTgo的相对表达量
Fig. 3. Relative expression level of NlTgo in different development stages of Nilaparvata lugens.
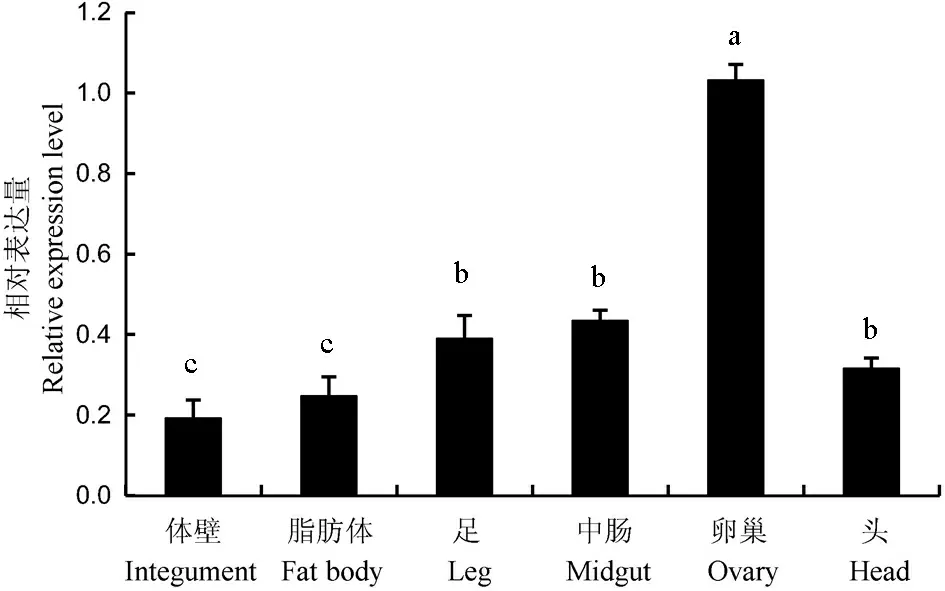
样本量n=3。不同小写字母代表不同组之间存在显著差异(P<0.05)。
Different lowercase letters indicate significant difference at the 0.05 level between different groups.n=3.
图4 褐飞虱不同组织间NlTgo的相对表达量
Fig. 4. Relative expression level of NlTgo in different tissues of Nilaparvata lugens.

样本量(n=3)。不同小写字母代表不同组之间存在显著差异(P<0.05)。
n=3. Different lowercase letters indicate significant difference at the 0.05 level between different groups.
图5 注射dsRNA后第4天NlTgo相对表达量的变化(A)和干扰NlTgo后对褐飞虱存活率的影响(B)
Fig. 5. Relative expression level of NlTgo at 4thday injection with dsRNA(A) and survival rate of Nilaparvata lugens after injection dsRNA of NlTgo(B).

红色箭头表示背板裂开的边缘。
Red arrow shows the edges of the split notum.
图6 干扰NlTgo后褐飞虱表型变化
Fig. 6. Phenotypic types of Nilaparvata lugens nymph after injection with dsNlTgo.
3 讨论
本研究克隆的褐飞虱NlTgo属于典型的bHLH-PAS亚家族[23],其包含1个bHLH保守结构域和2个PAS保守结构域,其中PAS结构域负责与其他PAS家族成员(如Sim和Trh)的结合,形成的二聚体共同调控生物体内一系列的生命活动[15]。NlTgo与已知的Tgo高度同源,表明Tgo在物种进化过程中高度保守,预示其可能有相同的功能,与Probst等[24]的研究结果相似。从系统进化关系来看,褐飞虱Tgo与始红蝽Tgo和臭虫Tgo进化关系较近。由此可见,本研究克隆的NlTgo所编码的bHLH和PAS保守结构域,可能作为功能蛋白参与二聚体形成等过程。
NlTgo在褐飞虱的生长发育过程中发挥重要作用。NlTgo在褐飞虱各发育阶段和各组织或器官中的表达模式表明,NlTgo在褐飞虱的各个生长阶段均表达,其中在第1、2龄表达量最高,在卵、第3~5龄和成虫中表达较低,且呈现出一定的波动性,表明该基因的表达可能与褐飞虱的发育相关。此外,NlTgo在褐飞虱的各个组织或器官中均表达,其中NlTgo在卵巢的表达量最高,在中肠、足、头、脂肪体、体壁等组织中表达量较低,这表明NlTgo也可能与雌虫的产卵有关。
RNAi是一种转录后水平的沉默机制,是通过内源或外源性双链RNA(double-strands RNA,dsRNA)介导的细胞内mRNA发生特异性降解,从而导致靶基因沉默,继而引起相应的功能缺失的现象[25]。Subba发现在赤拟谷盗中沉默Tango会导致显著的致死效应,赤拟谷盗幼虫在沉默后3 d开始有死虫出现,并在7 d后全部死亡。这些死虫体型变小,胸部褶皱,并变成深褐色[26]。在褐飞虱中,我们通过统计注射dsNlTgo后存活率、表型及转录水平的定量验证分析表明,NlTgo可以在褐飞虱中通过注射dsRNA的方法有效沉默。该基因沉默后5 d褐飞虱的存活率仅为23%,显著低于对照组98%的存活率。显微镜下观察死亡褐飞虱发现,注射dsNlTgo的若虫98%的褐飞虱表现为旧表皮裂开但不能完整的蜕下,并死亡。保幼激素、蜕皮激素、胰岛素等信号通路互相协调共同调控昆虫的变态发育,这些信号通路的紊乱会不同程度造成昆虫发育的受阻,我们推测NlTgo作为转录因子可能调控这些信号通路中某一基因的转录,从而影响褐飞虱的蜕皮发育。先前的研究表明,在果蝇中,Tango与一些组织特异性bHLH-PAS蛋白结合,随后通过CME位点调控靶基因的表达[27]并参与毒素代谢过程[28]。此外,Trh/Tgo bHLH-PAS蛋白还共同参与果蝇和人的后肠的发育[29]。
本研究初步表明NlTgo基因与褐飞虱的蜕皮过程相关。该基因在褐飞虱中的作用尚属首次报道,且在褐飞虱体内本身的作用机制还不是很明确,因此,对褐飞虱NlTgo可能参与的通路与调控机制的深入研究将有助于筛选新的靶标来防治褐飞虱。
[1] Atchley W R, Fitch W M. A natural classification of the basic helix-loop-helix class of transcription factors.ProcNatlAcadSciUSA, 1997, 94(10): 5172-5176.
[2] Massari M E, Murre C. Helix-loop-helix proteins: Regulators of transcription in eucaryotic organisms.MolCellBiol, 2000, 20(2): 429-440.
[3] Kadesch T. Consequences of heteromeric interactions among helix-loop-helix proteins.CellGrowthDiffer, 1993, 4(1): 49-55.
[4] Reyes H, Reisz-Porszasz S, Hankinson O. Identification of the Ah receptor nuclear translocator protein (Arnt) as a component of the DNA binding form of the Ah receptor.Science, 1992, 256(5060): 1193-1195.
[5] Jan Y N, Jan L Y. HLH proteins, fly neurogenesis, and vertebrate myogenesis.Cell, 1993, 75(5): 827-830.
[6] Weintraub H. The MyoD family and myogenesis: Redundancy, networks, and thresholds.Cell, 1993, 75(7): 1241-1244.
[7] Crews S. Control of cell lineage-specific development and transcription by bHLH-PAS proteins.Genes&Dev, 1998, 12(5): 607-620.
[8] Sonnenfeld M, Ward M, Nystrom G, et al. The Drosophila tango gene encodes a bHLH-PAS protein that is orthologous to mammalian Arnt and controls CNS midline and tracheal development.Development, 1997, 124(22): 4571-4582.
[9] Ghaffar M B, Pritchard J, Ford-Lloyd B. Brown planthopper (N.lugensStål) feeding behaviour on rice germplasm as an indicator of resistance.PLoSOne, 2011, 6(7): e22137.
[10]李进波, 万丙良, 夏明元, 等. 抗褐飞虱水稻品种的培育及其抗性表现. 应用昆虫学报, 2011, 48(5): 1348-1353.
Li J B, Wan B L, Xia M Y, et al. Breeding of the brown planthopper resistant rice varieties.ChinBullEntomol, 2011, 48(5): 1348-1353. (in Chinese with English abstract)
[11]Cheng X, Zhu L, He G. Towards understanding of molecular interactions between rice and the brown planthopper.MolPlant, 2013, 6(3): 621-634.
[12]Yu R, Xu X, Liang Y, et al. The insect ecdysone receptor is a good potential target for RNAi-based pest control.IntJBiolSci, 2014, 10(10): 1171-1180.
[13]Li K L, Wan P J, Wang W X, et al. Ran involved in the development and reproduction is a potential target for RNA-interference-based pest management inNilaparvatalugens.PlosOne, 2015, 10(11): e0142142.
[14]王彦华, 王鸣华. 近年来我国水稻褐飞虱暴发原因及治理对策. 农药科学与管理, 2007, 25(2): 49-54.
Wang Y H, Wang M H. Factors affecting the outbreak and management tactics of brownplanthopper in China recent years.PestSci&Admin, 2007, 25(2): 49-54. (in Chinese)
[15]Long S K, Fulkerson E, Breese R, et al. A comparison of midline and tracheal gene regulation during drosophila development.PLoSOne, 2014, 9(1): e85518.
[16]Larkin M A, Blackshields G, Brown N P, et al. Clustal W and Clustal X version 2.0.Bioinformatics, 2007, 23(21): 2947-2948.
[17]Tamura K, Peterson D, Peterson N, et al. MEGA5: Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods.MolBiolEvol, 2011, 28(10): 2731-2739.
[18]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method.RNA, 2001, 9(3): 299-308.
[19]Yuan M , Lu Y , Zhu X, et al. Selection and evaluation of potential reference genes for gene expression analysis in the brown planthopper,Nilaparvatalugens(Hemiptera: Delphacidae) using reverse-transcription quantitative PCR.PLoSOne, 2014, 9(1): e86503.
[20]Wang W X, Li K L, Chen Y, et al. Identification and function analysis of enolase geneNlEno1 fromNilaparvatalugens(Stal) (Hemiptera:Delphacidae).JInsectSci, 2015, 15(1): 66.
[21]Li K L, Wan P J, Wang W X, et al. Ran involved in the development and reproduction is a potential target for RNA-interference-based pest management inNilaparvatalugens.PLoSOne, 2015, 10(11): e0142142.
[22]Tang Q Y, Zhang C X. Data Processing System (DPS) software with experimental design, statistical analysis and data mining developed for use in entomological research.InsectSci, 2013, 20(2): 254-260.
[23] Peyrefitte S, Kahn D, Haenlin M. New members of the Drosophila Myc transcription factor subfamily revealed by a genome-wide examination for basic helix-loop-helix genes.MechDev, 2001, 104(1/2): 99-104.
[24]Probst M R, Fan C M, Tessier-Lavigne M. Two murine homologs of the Drosophila single-minded protein that interact with the mouse aryl hydrocarbon receptor nuclear translocator protein.JBiolChem, 1997, 272(7): 4451-4457.
[25]Fire A, Xu S, Montgomery M K, et al. Potent and specific genetic interference by double-stranded RNA inCaenorhabditiselegans.Nature, 1998, 391(6669): 806-811.
[26]Bitra K, Tan A, Dowling A, et al. Functional characterization of PAS and HES family bHLH transcription factors during the metamorphosis of the red flour beetle,Triboliumcastaneum.Gene, 2009, 448(1): 74-87.
[27]Ohshiro T, Saigo K. Transcriptional regulation of breathless FGF receptor gene by binding of TRACHEALESS/dARNT heterodimers to three central midline elements in Drosophila developing trachea.Development, 1997, 124(20): 3975-3986.
[28]Crews S T, Fan C M. Remembrance of things PAS: regulation of development by bHLH-PAS proteins.CurrOpinGenetDev, 1999, 9(5): 580-587.
[29]Choi Y J, Kwon E J, Park J S, et al. Transcriptional regulation of theDrosophilacaudalhomeobox gene by bHLH-PAS proteins.BiochimBiophysActa, 2007, 1769(1): 41-48.
Molecular Cloning and Functional Analysis ofNlTgoin the Rice Brown Planthopper,Nilaparvatalugens(Hemiptera: Delphacidae)
CHEN Long-fei1, WAN Pin-jun2, WANG Wei-xia2,*, FU Qiang2, ZHU Ting-heng1,*
(1College of Biological and Environmental Engineering, Zhejiang University of Technology, Hangzhou 310014, China;2China Rice Research Institute, Hangzhou 310006, China;*Corresponding author, E-mail: thzhu@zjut.edu.cn)
Transcriptional regulator Tango (Tgo) plays crucial roles in insect development, including neurogenesis, hematopoiesis, sex determination and gut development. In this study, a full-length cDNA ofTangowas cloned inNilaparvatalugens. qRT-PCR and RNA interference (RNAi) were further used to analyze the expression pattern and function role, respectively. Our results showed thatNlTgocontained a 2007-bp open reading frame (ORF), encoding 669 amino acid residues. Sequence alignment showed that NlTgo shared an identity of 68% withPediculushumanus. Phylogenetic analysis suggested that NlTgo was closely related to the Tango proteins fromAcyrthosiphonpisum,PyrrhocorisapterusandCimexlectularius. Expression profile revealed thatNlTgoexpression was higher in the first- and second-instar larvae than that in eggs. Furthermore, the expression level ofNlTgowas higher in ovary than that in integument. Knocking down ofNlTgo, in the 4th-instar nymph, was performed by double-stranded RNA (dsRNA) targetingNlTgo. It was found that the expression level ofNlTgo, 4 days after injection, was significantly decreased by 77%, compared with control. Furthermore, nymphs died due to the abnormal molting, and the survival rate was only 23%, significantly lower than control group (98%). The results suggest thatNlTgois involved in the development ofN.lugensand can serve as a potential target for controlling the brown planthopper.
Nilaparvatalugens; Tango; RNAi; molting; pest control
2016-03-01; 修改稿收到日期: 2016-04-21。
现代农业产业技术体系专项(CARS-1-18); 国家自然科学基金资助项目(31201512)。
Q785; S435.112+.3
A
1001-7216(2016)06-0653-08
陈龙飞, 万品俊, 王渭霞, 等. 褐飞虱NlTgo基因的克隆及功能研究. 中国水稻科学, 2016, 30(6): 653-660.
