NtMYC1a转录因子的克隆与功能初步分析
2016-12-07郭红祥李富欣刘巧真李素敏郭爱芳
郭红祥,李富欣,刘巧真,李素敏,郭爱芳,李 斐,丁 超
(1.河南农业大学 生命科学学院,河南 郑州 450002;2.河南省烟草公司 济源市公司,河南 济源 454650;3.河南省农业科学院 烟草研究中心,河南 许昌 461000;4.河南省获嘉县种子公司,河南 获嘉 453822)
NtMYC1a转录因子的克隆与功能初步分析
郭红祥1,李富欣2*,刘巧真3**,李素敏1,郭爱芳4,李 斐1,丁 超1
(1.河南农业大学 生命科学学院,河南 郑州 450002;2.河南省烟草公司 济源市公司,河南 济源 454650;3.河南省农业科学院 烟草研究中心,河南 许昌 461000;4.河南省获嘉县种子公司,河南 获嘉 453822)
从烟草根系中克隆NtMYC1a基因,构建表达载体并在烟草中瞬时表达,探讨了NtMYC1a转录因子在烟碱生物合成中的作用。转基因烟草中的NtMYC1a表达显著升高,表明成功构建了NtMYC1a表达载体并转化了烟草;转基因烟草中的PMT表达量显著升高,表明NtMYC1a能够正调控烟碱的合成;茉莉酸与干旱处理烟草后,检测到NtMYC1a和PMT的表达量显著升高,表明在茉莉酸、干旱促进烟碱合成的生物学过程中,NtMYC1a具有正调控的功能。
转录因子;NtMYC1a;烟碱;茉莉酸;干旱
MYC类转录因子是bHLH转录因子超家族中的一员[1],编码植物中髓细胞组织增生蛋白(Myelocytomatosis proteins, MYCs)。MYC的识别序列多为G-box CACGTG[2]。MYC转录因子具有多种调节功能,参与许多生理与发育过程,如光信号、开花结实、根的发育,以及虫咬、干旱、低温等各种胁迫应答。茉莉酸(jasmonic acid,简称JA;茉莉酸甲酯,简称MeJA_)在植物体内调控众多的基因,其中调控烟碱合成的路径已基本被研究清楚,MYC是茉莉酸类激素响应途径中的核心转录因子,已有文献报道MYC2参与JA调控活化的烟草生物碱合成[3-4]。
MYC家族与烟碱的合成密切相关。2004年Bingfang X等已证实烟碱合成关键酶PMT启动子的G-box元件对其表达极其重要[5]。2010年Andrea T等报道bHLH家族转录因子NbbHLH1 和NbbHLH2能与PMT的启动子元件G-box相结合激活启动子,正向调控烟碱的合成。敲除基因后,N.benthamiana的烟碱合成基因下调,叶片烟碱含量降低[6]。另外,Shoji T等2011年的EMSA实验显示NtMYC2b能与PMT的G-box互作。实验已经证明NtMYC2基因参与了打顶、伤害诱导、茉莉酸对烟碱合成的调控过程[7]。MYC1a和MYC2a/2b同属MYC转录因子家族,那么MYC1a是否参与对烟碱合成的调控呢?因此,本文从烟草中克隆MYC1a基因,构建过表达载体,探讨了NtMYC1a转录因子在烟碱生物合成中的作用,旨在为阐明烟草中烟碱生物合成的调控机制奠定基础。
1 材料与方法
1.1 实验材料
从大田取栽培烟草品种K326的根系,经液氮冷冻处理后,在-80 ℃下保存。取3月龄、长势一致的烟苗,用100 μmol/L MeJA进行处理,在处理24 h后取样,用液氮冷冻,-80 ℃保存。取3月龄、长势一致的烟苗,经干旱处理20 d后取样,用液氮冷冻,-80 ℃保存。
1.2 烟草根系RNA提取及cDNA合成
用TRIzol法从烟草根中获得总RNA,用One Step PrimeScript RT-PCR Kit (TaKaRa公司) 反转录生成cDNA。
1.3 克隆烟草的NtMYC1a基因
根据MYC1a(GenBank登录号GQ859158)设计引物,从烟草K326的cDNA中克隆到完整的CDS序列。F:TCTAGAAAGCTTCTGCAGGGGCCCGGGATGACTGATTACAGCTTACCCAC;R:TCGCCCTTGCTCACCATGGTACCTTAGCGTGTTTCAGCAACTCT(下划线处分别为SmaⅠ和KpnⅠ酶切位点)。
1.4 构建表达载体pS1300-NtMYC1a
将NtMYC1a PCR产物切胶回收。利用SmaⅠ、KpnⅠ内切酶对PS1300载体进行双酶切,之后切胶回收线性载体。利用无缝克隆试剂盒进行连接。
1.5 烟草过表达载体的瞬时表达及检测
选取8~10叶期、生长良好的烟株,将农杆菌GV3101菌株(pS1300- NtMYC1a)注射入烟草;3~4 d后取样,取样时剪取注射部位,用液氮速冻后置于-80 ℃冰箱保存。烟草总RNA的提取采用TRIzon法。以总RNA的反转录产物cDNA为模板,利用烟草的Actin(GenBank: AF126810)作为内参基因,进行实时荧光定量RT-PCR检测,所用各引物序列见表1。

表1 RT-PCR检测所用引物名称及其序列
qPCR检测分析使用SYBR_Premix Ex TaqTMII (TaKaRa)试剂盒进行。反应体系如下:2 μL cDNA,0.5 μL正、反引物,12.5 μL 2×SYBR_Premix Ex TaqTMII和9.5 μL水。按照以下程序进行:95 ℃ 30 s;95 ℃ 5 s,57 ℃ 30 s,72 ℃ 30 s,共40个循环。每个样品重复测定3次。
2 结果与分析
2.1NtMYC1a基因的克隆与过表达载体的构建
以烟草的cDNA为模板克隆NtMYC1a基因,得到2046 bp的条带(图1),测序分析表明与NtMYC1a基因序列一致。回收PCR产物连接ps1300载体,转化大肠杆菌DH5α,筛选阳性克隆。图2为双酶切分析结果,目的条带分别与ps1300载体的大小和NtMYC1a的大小一致。
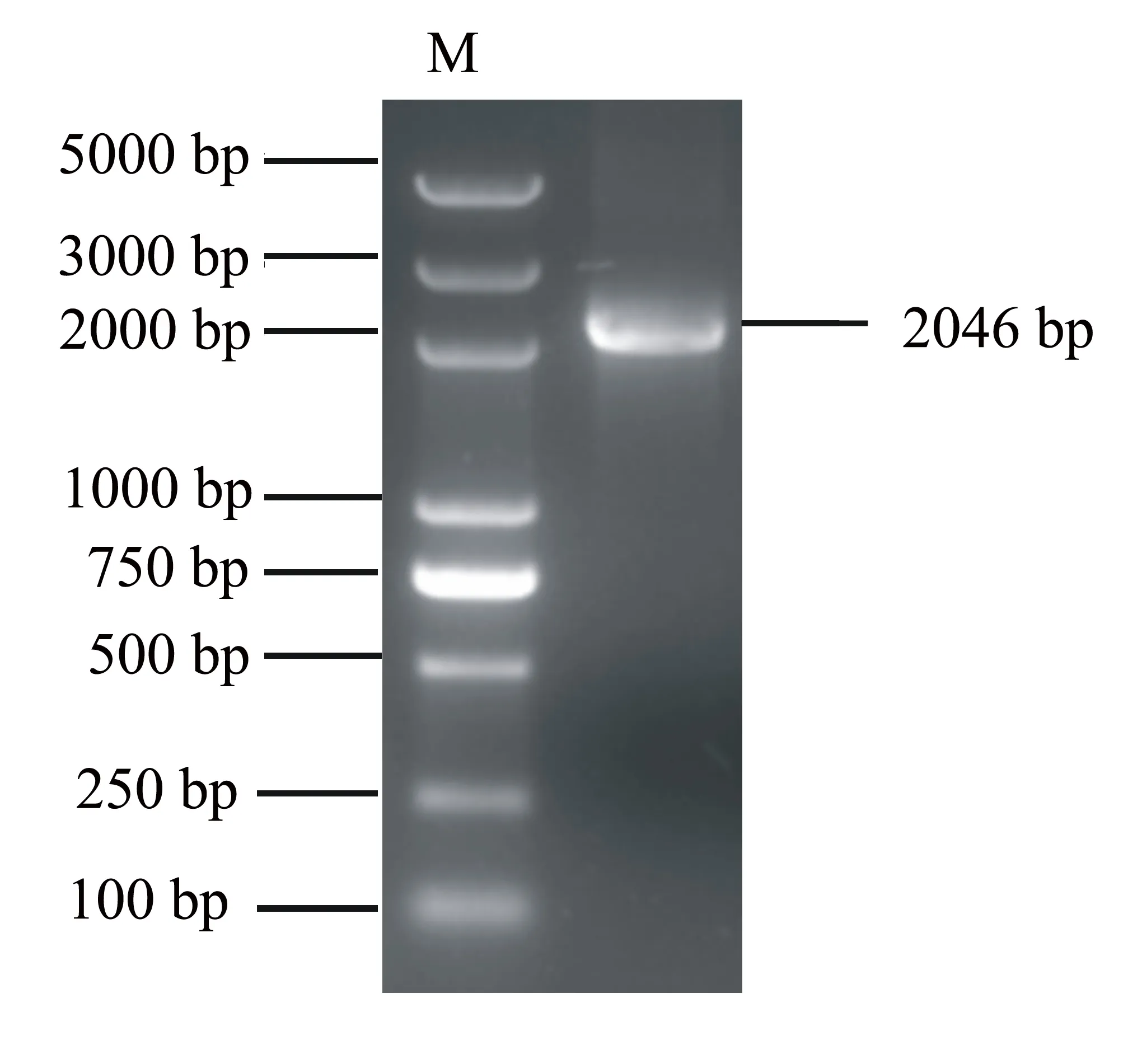
图1 PCR扩增NtMYC1a结果
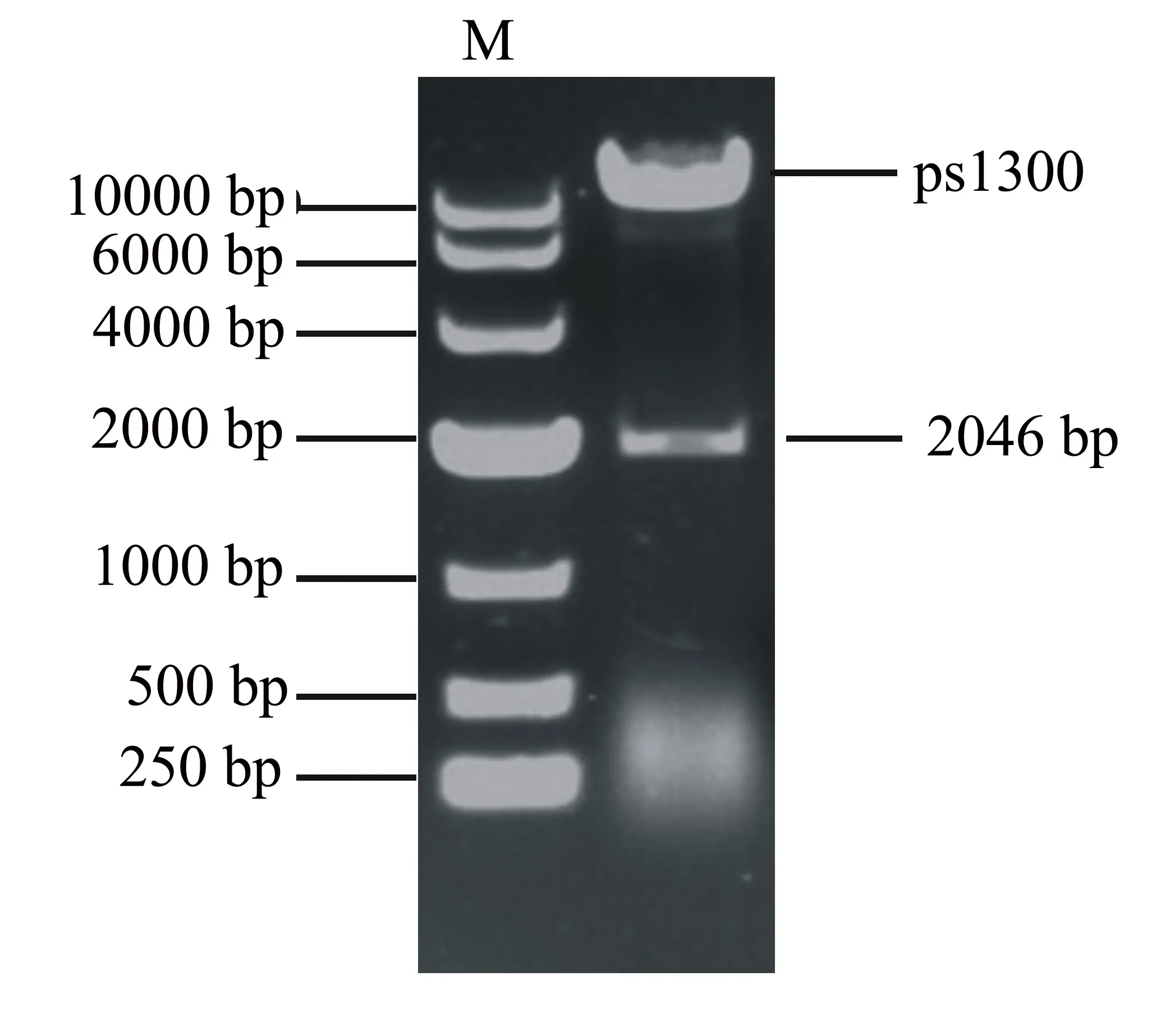
图2 ps300-NtMYC1a双酶切鉴定结果
2.2NtMYC1a的瞬时表达分析
从图3可以看出:与对照叶片相比,转化过表达载体ps300-NtMYC1a叶片中的NtMYC1a表达量上升显著,增加了2.9倍,表明转基因能够增加NtMYC1a的表达;过表达载体ps300-NtMYC1a与对照ps300ck瞬时表达叶片相比,PMT表达量上升显著,增加了4.6倍,表明NtMYC1a对烟碱合成有正调控作用。
2.3 茉莉酸对烟碱合成相关基因表达的影响
茉莉酸是调控烟碱合成的一种重要植物激素。PMT是烟碱合成过程中的重要限速酶。从图4中可以看出,茉莉酸处理烟草后,PMT的表达量升高近5倍,表明烟碱合成能力显著增加。同时也检测到NtMYC1a、NtMYC1b、NtMYC2a、NtMYC2b基因的表达量有不同幅度的升高,其中以NtMYC1a基因的表达量升高幅度最小,说明NtMYC1a在茉莉酸调控烟碱合成中的作用相对较小。
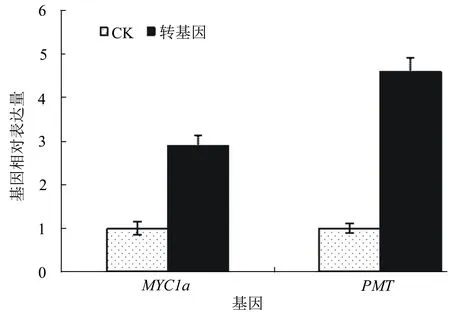
图3 MYC1a和PMT在转基因烟草中的表达分析
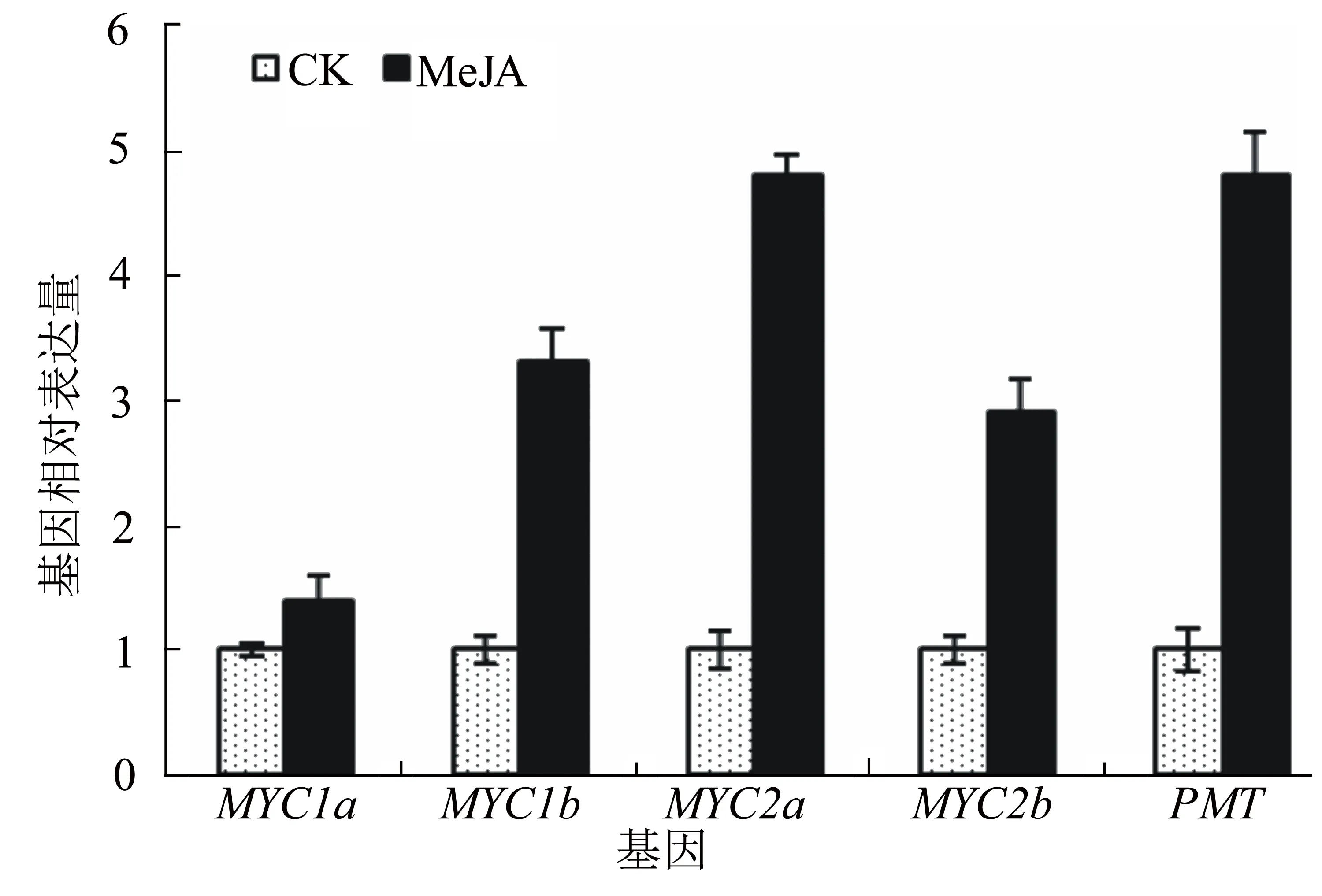
图4 茉莉酸对烟碱合成相关基因表达的影响
2.4 干旱对烟碱合成相关基因表达的影响
干旱是调控烟碱合成的一种非生物胁迫因素。从图5中可以看出,干旱胁迫能使PMT的表达量升高2.3倍,同时NtMYC1a、NtMYC1b、NtMYC2a、NtMYC2b基因的表达量分别升高4.9、3.1、1.2、1.3倍,表明NtMYC1a在干旱调控烟碱合成中起重要作用。

图5 干旱对烟碱合成相关基因表达的影响
3 讨论
烟碱的合成受到众多因素的影响且调控机制极其复杂,生物胁迫与非生物胁迫都影响烟碱的合成。如打顶、抹杈、虫咬会导致烟碱含量增加[6-8],干旱、低温等不利环境因素也会影响到烟碱的合成。另外,植物激素也是烟碱合成的重要调控因素,如茉莉酸、脱落酸、生长素等。在烟草的栽培中,为了提高烟叶质量,往往对烟株进行打顶,去除烟草的顶端生长优势。打顶会引起烟株发生一系列的生理变化,例如根系的二次生长、植物激素源改变、烟碱含量迅速增加等[9-11]。烟株打顶是一种伤害诱导,能引起JA含量的升高,JA能促进根系合成烟碱,MYC2转录因子家族参与这一烟碱合成的调控过程[12-14]。本文结果显示茉莉酸能够大幅度促进MYC2a/2b转录因子的表达,而MYC1a的表达量变化较小,说明打顶主要通过MYC2a/2b转录因子调控烟碱的合成。
干旱也是影响烟碱合成的一个非生物胁迫因素。本文结果显示干旱能够提高MYC1a/1b和MYC2a/2b转录因子的表达,但MYC1a/1b的表达增加幅度明显大于MYC2a/2b的,说明干旱主要通过MYC1a/1b转录因子调控烟碱的合成。
[1] Boter M, Ruiz-Rivero O. Conserved MYC transcription factors play a key role in jasmonate signaling both in tomato andArabidopsis[J]. Genes Dev, 2004, 18(13): 1577-1591.
[2] Toledo-Ortiz G, Huq E, Quail P H. TheArabidopsisbasic/helix-loop-helix transcription factor family [J]. Plant Cell, 2003, 15: 1749-1770.
[3] Dombrecht B, Xue G P. MYC2 differentially modulates diverse jasmonate-dependent functions inArabidopsis[J]. Plant Cell, 2007, 19: 2225-2245.
[4] Chini A, Fonseca S. The JAZ family of repressors is the missing link in jasmonate signaling [J]. Nature, 2007, 448: 666-671.
[5] Bingfang X, Michael P T. Methyl jasmonate induced expression of the tobacco putrescine N-methyltransferase genes requires both G-box and GCC-motif elements [J]. Plant Molecular Biology, 2004, 55(5): 743-761.
[6] Andrea T T, Enwu L, Sandra L, et al. A functional genomics screen identifies diverse transcription factors that regulate alkaloid biosynthesis inNicotianabenthamiana[J]. Plant, 2010, 62(4): 589-600.
[7] Kato K, Shoji T, Hashimoto T. Tobacco nicotine uptake permease regulates the expression of a key transcription factor gene in the nicotine biosynthesis pathway [J]. Plant Physiol, 2014, 166(4): 2195-2204.
[8] Baldwin I T. The alkaloidal response of wild tobacco to real and simulated herbivory [J]. Oecologia, 1988, 77: 378-381.[9] 林中麟,石健林,周益.烟草打顶研究进展[J].江西农业学报,2009,21(6):32-36.
[10] Ellilot J M. The effects of stage of topping flue-cured tobacco on certain properties of flue-cured leaves and smoke characteristics of cigarettes [J]. Tob Sci, 1975, 19: 7-9.
[11] 易建华,贾志红,孙在军.打顶时间对烤烟根系形态及烟碱含量的影响[J].安徽农业科学,2006(12):2762-2777.
[12] Blechert S, Brodschelm W, et al. The octadecanoic pathway: signal molecules for the regulation of secondary path ways [J]. Proc Natl Acad Sci USA, 1995, 92: 4099-4105.
[13] Mano Y, Ohkawa H, Yamada Y. Production of tropane alkaloids by hairy root cultures ofDuboisialeichhardtiitransformed byAgrobacteriumrhizo genes [J]. Plant Science, 1989, 59(89): 191-201.
[14] Riechers D E, Timko M P. Structure and expression of the gene family encoding putrescine N-methyltransferase inNicotianatabacum: new clues to the evolutionary origin of cultivated tobacco [J]. Plant Mol Biol, 1999, 41: 387-401.
[15] 陈发波,方平,姚启伦,等.玉米地方品种Glb1基因克隆及其遗传多样性分析[J].南方农业学报,2014,45(8):1347-1352.
(责任编辑:黄荣华)
Cloning and Function Analysis of Transcription Factor NtMYC1a from Tobacco
GUO Hong-xiang1, LI Fu-xin2*, LIU Qiao-zhen3**, LI Su-min1, GUO Ai-fang4, LI Fei1, DING Chao1
(1. College of Life Science, Henan Agricultural University, Zhengzhou 450002, China; 2. Jiyuan Tobacco Company of Henan Province, Jiyuan 454650, China; 3. Tobacco Research Center, Henan Academy of Agricultural Sciences, Xuchang 461000, China; 4. Seed Company of Huojia County in Henan Province, Huojia 453822, China)
The geneNtMYC1ain the roots of tobacco was cloned, its expression vector was constructed and transiently expressed in tobacco, and the role of transcription factor NtMYC1a in the biosynthesis of nicotine was investigated. The expression level ofNtMYC1ain transgenic tobacco plants was notably increased, suggesting that the constructed expression vector with NtMYC1a had been successfully transformed into tobacco plants. The expression level ofPMTin transgenic tobacco plants was remarkably enhanced, indicating that NtMYC1a could positively regulate the biosynthesis of nicotine. After tobacco plants were treated with jasmonic acid or drought, the expression levels of bothNtMYC1aandPMTin them were significantly increased, showing that NtMYC1a played a positive regulatory role in nicotine biosynthesis promoted by jasmonic acid or drought.
Transcription factor; NtMYC1a; Nicotine; Jasmonic acid; Drought
2016-01-30
河南省烟草公司科技重点项目(HYKJ201308)。
郭红祥(1974─),男,河南获嘉人,教授,博士,主要从事烟草生理生化研究工作。*并列第一作者:李富欣(1970─),男,河南宜阳人,高级农艺师,博士,主要从事烟叶生产工作。**通讯作者:刘巧真。
Q785
A
1001-8581(2016)12-0080-03
