差速离心结合脉冲电泳分离枣疯病植原体DNA
2016-12-07郑先波李继东冯建灿
傅 强,付 冰,叶 霞,谭 彬,郑先波,李继东,冯建灿
(河南农业大学 园艺学院,河南 郑州 450002)
差速离心结合脉冲电泳分离枣疯病植原体DNA
傅 强,付 冰,叶 霞,谭 彬,郑先波,李继东,冯建灿*
(河南农业大学 园艺学院,河南 郑州 450002)
为了解枣疯病植原体的分子特征,明确植原体的致病机理及其与寄主的互作关系,以枣疯病组培苗为材料,利用差速离心结合脉冲电泳分离枣疯病植原体DNA。结果表明:感病组培苗在1600~2200 kb之间出现一条明亮的条带,而健康组培苗没有,回收后经PCR检测,证明该目的条带是植原体DNA,实时定量PCR的分离结果表明:该实验方法能有效地将植原体基因组和植物基因组分离。
枣疯病;植原体;脉冲电泳;PCR;RT-PCR
植原体(phytoplasma)是一类没有细胞壁,不能离体培养的植物病原原核生物。植原体病害遍布全球,给许多重要粮食作物、蔬菜、果树、观赏植物、林木树和林荫树造成了巨大损失[1]。枣疯病是一种由植原体引起的病害,在田间由昆虫介体传播,一旦发病,通常小树1~2年,大树3~6年即逐渐枯死,给枣树生产带来了巨大损失[2]。植原体的代谢途径、与寄主的互作关系一直受到广大农业和基础科学研究者的关注。但由于植原体不能离体培养的特性,限制了对其分子特征、致病因子和控制及治愈其病害的研究[3]。因此,分离得到植原体基因组对植原体的研究非常重要。目前,已经有4种植原体完成了分离测序、基因组信息分析,分别是洋葱黄化植原体M株系[3]、翠菊黄化植原体[4]、澳大利亚金黄化葡萄植原体[5]、苹果簇生植原体AT株系[6]。近几年来,我国也开展了对植原体基因组的分离,如西北农林科技大学的陈旺等[7]分离得到650 kb大小的小麦蓝矮植原体染色体DNA;中国农业大学杨毅等[8]分离得到1100 kb的泡桐丛枝植原体染色体全长;北京农学院陈昱圻等[9]采用氯化铯双苯酰亚胺密度梯度超速离心法从感病枣树中提取富集植原体DNA,此方法未能确定枣疯病植原体基因组大小。本实验以枣疯病组培苗为材料,利用差速离心和脉冲电泳相结合,分离植原体染色体DNA,建立了一套完整的枣疯病植原体染色体DNA的分离、纯化及检测体系。
1 材料与方法
1.1 材料
枣疯病植原体保存于携带枣疯病植原体的灰枣组培苗上,实验的阴性对照为健康的灰枣组培苗。组培苗均在MS培养基上继代保存。取整株组培苗作为提取材料。
1.2 枣疯病染色体DNA的提取
参考Neimark等[10]的方法,枣疯病植原体DNA提取方法如下:取约2~3 g组培苗,加冷冻研磨液(0.125 mol/L K2HPO4,10%W/V蔗糖,50 mmol/L抗坏血酸,2% PVP-10,0.15% BSA,pH 7.6)研磨成匀浆。4 ℃,1500 r/min下离心5 min。取上清液,在4 ℃,18000 r/min下离心25 min。倒掉上清液,加10 mL重悬液(20 mmol/L Tris-HCl,10% sucrose,50 mmol/L EDTA,pH 8.0)重悬沉淀。将重悬液重复上述2次离心,沉淀在100~200 μL重悬液中重悬。将重悬液在37 ℃下温育5~10 min,然后加入等体积1%的低熔点琼脂糖混匀,并迅速将混合液倒入遇冷的模具中,室温放置使胶块完全凝固,凝固后的胶块在裂解缓冲液(0.5 mol/L EDTA、1% SDS、1.0 mg/mL蛋白酶K,pH 8.0)中,52 ℃水浴4 d,凝胶块完全消化至透明状后取出胶块,用TE buffer(10 mmol/L Tris-HCl,1 mmol/L EDTA)冲洗3次,然后,加入10倍体积的TE于4 ℃下保存备用。
1.3 脉冲场电泳
凝胶块在TE中平衡过夜后,不经过酶切或物理打断,直接用于脉冲电泳,实验对电泳过程中的电压、脉冲转换时间及电泳时间进行了调整,找到了最佳电泳条件。电泳结束,将凝胶放入加有绿如蓝的TBE溶液中染色30 min,蒸馏水脱色10 min,紫外灯下成像保存。
1.4 植原体DNA的回收
用GELase和透析膜回收DNA,切下含DNA样品的胶条,溶胶后加入2 μL GELase消化,43 ℃下温浴45 min,5000 r/min离心1min收集DNA,将收集到的DNA转移到透析膜上,静置2.5 h,转移DNA到离心管中,室温下平衡过夜。
1.5 植原体DNA的PCR检测
用植原体通用引物[11]R16F2n(5’-GAAACGACTGCTAAGACTGG-3’)和R16F2(5’-TGACGGGCGGTGTGTACAAACCCCG-3’)及根据枣疯病植原体16SrDNA序列设计的特异引物JWB-F(5’-CGCTAAAGTCCCCACCATTA-3’)和JWB-R(5’-CACATTGGGACTGAGACACG-3’),检测回收植原体DNA。PCR条件:94 ℃,4 min;94 ℃,45 s,60 ℃/56 ℃,45 s,72 ℃,1 min;72 ℃,10 min,35个循环。
1.6 荧光定量PCR分析
用美国应用生物系统公司7300/7500实时定量PCR仪,分别以感病枣总DNA、回收纯化DNA为模板,根据疯病植原体16SrDNA序列和枣树26SrDNA序列,设计用于定量PCR的引物F1:5’-CGGCTTGCTGGGTCTTTACTG-3’、R1:5’-CATGATCCACCGCTTGTGC-3’和F2:5’-GAACAGCCCAGGTTGAGAATC-3’、R2:5’-TCCCAAACAACCCGACT-3’,采用2-ΔΔCt对植原体的16SrDNA基因和枣树26SrDNA基因进行相对定量分析,确定植原体纯化效果。实时定量PCR的条件:50 ℃,2 min;95 ℃,10 min;95 ℃,15 s;60 ℃,1 min,共35个循环。
2 结果与分析
2.1 枣疯病植原体的提取及脉冲电泳纯化
用2~3 g感病组培苗,经差速离心得到200 μL重悬液,包埋于等体积的1%低熔点琼脂糖中,52 ℃水浴锅中裂解4 d后,呈透明状,在TE中平衡过夜后直接用于脉冲电泳。实验电泳条件为:14 ℃,电压6 V/cm,脉冲转换时间60~120 s,电泳夹角120°,电泳时间为21 h或24 h时样品均在最下方出现一条明亮的条带,同时酵母染色体PFGmarker条带模糊且不完整(图1-a)。经调整发现当电泳条件为:14 ℃,电压6 V/cm,脉冲转换时间40~90 s,电泳夹角120 ℃,电泳时间为21 h时,酵母染色体PFGmarker条带清晰完整,感病枣组培苗泳道中出现一条明亮的条带,而健康对照无此条带,通过与酵母染色体PFGmarker进行比较发现此条带在1600~2200 kb之间(图1-b)。
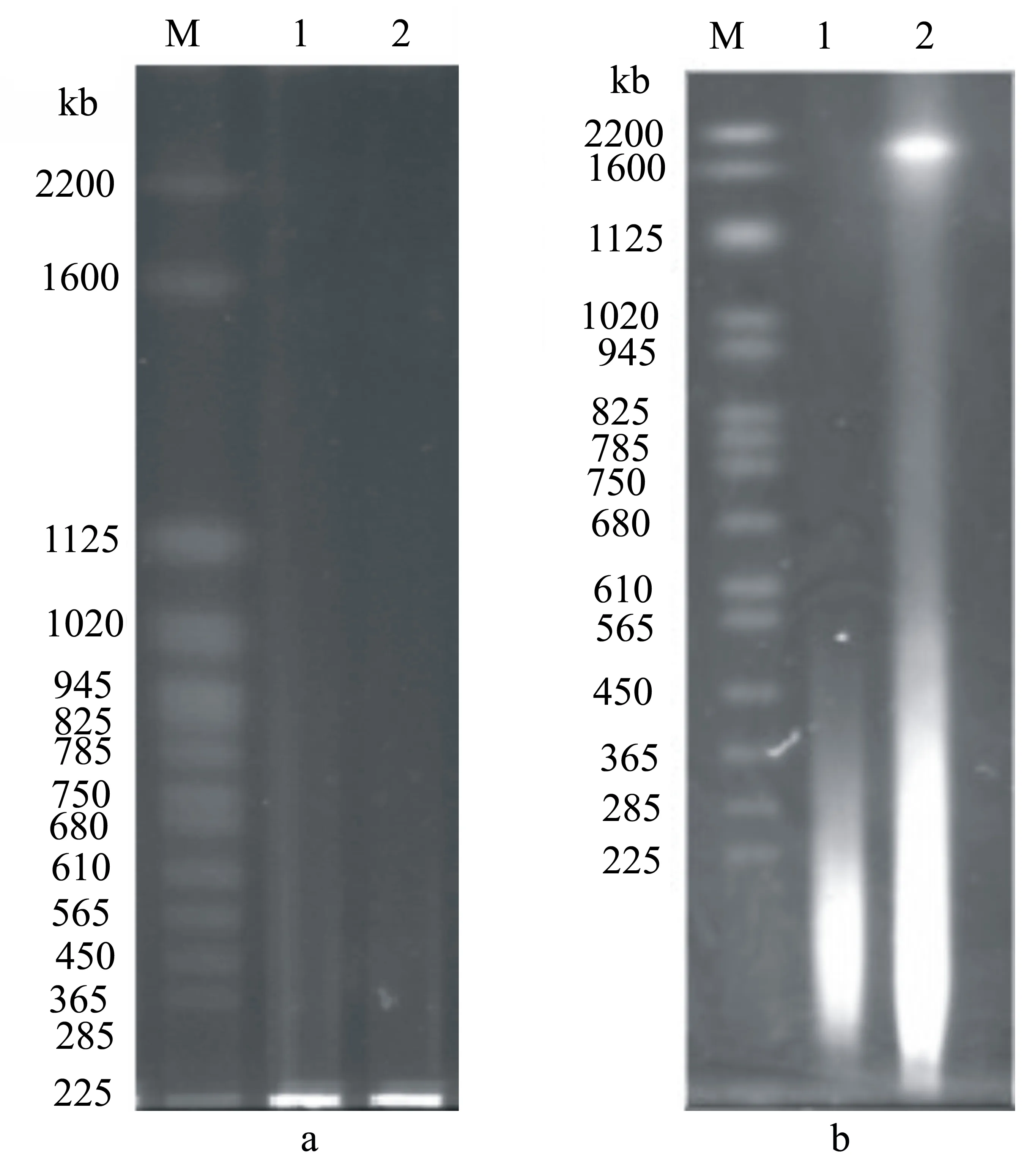
1.健康灰枣组培苗;2.感病灰枣组培苗图1 脉冲电泳
2.2 PCR检测
实验回收到25 μL浓度为1208.5 ng/μL的DNA,分别以感病枣总DNA和回收纯化DNA为模板,用植原体通用引物(1200 bp)和枣疯病特异引物(800 bp)均检测到明亮的目的条带,而健康对照没有(图2),说明纯化的目的条带是枣疯病植原体DNA。
2.3 植原体DNA纯化效果检测
荧光定量PCR通过荧光燃料对PCR产物进行标记,结合相应软件对产物进行分析,计算样品中目标DNA的浓度。实验用枣疯病植原体定量引物和植物基因组定量引物,对植原体和枣基因组进行定量分析,结果表明:回收纯化DNA中几乎没有植物基因组,分析植原体基因组和枣基因组相对量的变化,结果见图3,由此表明经差速离心及脉冲电泳可以将枣疯病植原体基因组和植物基因组分开,且分离得到的DNA中植原体浓度高于感病枣总DNA。
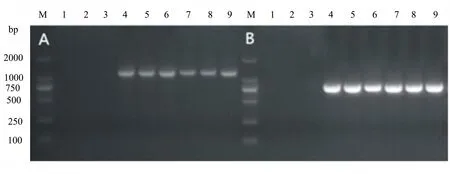
A.16SrDNA基因;B.JWB特异引物;1~3.健康枣DNA;4~6.感病枣总DNA;7~9.回收纯化DNA图2 枣疯病植原体PCR检测

1.回收纯化DNA;2.感病枣总DNA图3 荧光定量PCR分析
3 结论与讨论
目前,分离植原体基因组DNA有2种方法:一种是氯化铯梯度离心法,此方法操作复杂,获得的植原体染色体DNA不完整,但是效率较高[12-14]。1990年Kollar等[15]采用氯化铯浓度梯度离心法,从感染苹果簇生植原体的长春花中分离到含有0.1%~3.0%植物总DNA的苹果簇生植原体;2007年Tran-Nguyen等[16]采用氯化铯浓度梯度离心法分离到90%澳大利亚暂定属植原体染色体DNA。另一种方法是差速离心结合脉冲电泳分离,脉冲电泳(PFGE)是一种分离大分子DNA的方法,可以分离大小从10 kb到10 Mb的DNA分子[11]。此方法中采用低熔点琼脂糖包埋样品,再进行原位裂解和去蛋白处理从而释放DNA,细胞裂解所释放的DNA大片段包埋在胶栓中,这个过程中阻止了机械力对DNA大片段的剪切作用,能够获得完整的植原体DNA,操作简单,但是效率较低。
本实验采用差速离心提取植原体DNA,结合脉冲电泳分离纯化,与Neimark[10,13]、杨毅[8]等的实验相比,未经酶切和微辐射过程,希望获得完整的环状植原体DNA。脉冲电泳中的转换时间可以改变DNA分子的电场,每次电场转变,DNA分子就会改变移动方向,大分子DNA转变的慢,所以移动速率慢,因此通过调整脉冲转换时间找到目的DNA分子的最适转换时间是脉冲电泳关键的一步[19],实验参考脉冲电泳使用和应用指南[17],对脉冲电泳条件进行了探索,最终感病样品在1600~2200 kb之间出现了一条明亮条带,而健康对照没有,经回收检测此条带是枣疯病植原体DNA。但是目前已报道测序完成的植原体基因组大小都在530~1350 kb之间[14],而本实验中,获得的枣疯病植原体DNA远大于已知植原体基因组大小,可能原因还有待进一步测序验证。
对感病枣总DNA和回收纯化DNA中植原体基因组和枣基因组的相对定量分析表明:本实验分离的枣疯病植原体基因组DNA中有极少量枣基因组污染,说明本实验的方法可以将植原体基因组和枣基因组有效的分离,但是由于大片段DNA回收过程困难,导致DNA的降解,损失严重,使得回收纯化DNA和感病枣总DNA中植原体浓度相差不大。
根据植原体16SrRNA基因序列分类,植原体可以分为三大支,包括16SrⅠ、16SrⅫ、16SrⅩ、16SrⅤ等分组及其亚组[18]。枣疯病植原体属于16SrⅤ-B亚组,枣疯病植原体所在的分支中包含最多的植原体分组,但是目前该分支中的植原体没有完成基因组分离测序的,本实验首次用脉冲电泳分离了枣疯病植原体,经回收检测可以用于测序。进一步优化实验,获得枣疯病植原体完整的基因组DNA序列,将为进一步研究植原体的致病机理,与寄主的互作关系等提供科学依据。
[1] Hogenhout S A, Oshima K, Ammar E, et al. Phytoplasmas: bacteria that manipulate plants and insects[J]. Mol Plant Pathol, 2008, 9(4): 403-423.
[2] 赵锦,代丽,刘孟军,等.枣疯病研究现状及其防治[C]//中国园艺学会干果分会.第四届全国干果生产、科研进展研讨会论文集.北京:中国农业科学技术出版社,2005:280-284.
[3] Oshima K, Kakizawa, Nishigawa H, et al. Reductive evolution suggested from the complete genome sequence of a plant-pathogenicphytoplasma[J]. Nature Genetics, 2004, 36(1): 27-29.
[4] Bai X D, Zhang J H, Ewing A, et al. Living with genome instability: the adaptation of phytoplasmas to diverse environments of their insect and plant hosts[J]. J Bacteriol, 2006, 188(10): 3682-3696.
[5] Tran-Nguyen L T T, Kube M, Schneider B, et al. Comparative genome analysis of “CandidatusPhytoplasma australiense” (Subgrouptuf-Australia I;rp-A) and “Ca. Phytoplasma asteris” strains OY-M and AY-WB[J]. Journal of Bacteriology, 2008, 190(11):3979-3991.
[6] Kube M, Schneider B, Kuhl H, et al. The linear chromosome of the plant-pathogenicmycoplasma‘CandidatusPhytoplasma mali’[J]. BMC Genomics, 2008, 9: 306.
[7] 陈旺,李艳,吴云锋.小麦蓝矮植原体染色体DNA的分离[J].微生物学通报,2013,40(4):706-710.
[8] 杨毅,杨旭光,林彩丽,等.泡桐丛枝植原体染色体全长及两个rRNA操纵子定位研究[J].植物检疫,2011,25(4):5-9.
[9] 陈昱圻,郝少东,王合,等.超速离心结合Real-timePCR分离纯化枣疯病植原体DNA[J].北京农学院学报,2015,30(2):5-9.
[10] Neimark H, Kirkpatrick B C. Isolation and characterization of full-length chromosomes from non-culturable plant-pathogenicMyciplasma-like organisms[J]. Molecular Microbiology, 1993, 7(1): 21-28.
[11] 侯立华,黄新,朱水芳.枣疯病植原体实时荧光定量PCR检测方法的研究[J].生物技术通讯,2010,21(1):70-72.
[12] Herschleb J, Ananiev G, Schwartz D C. Pulsed-field gel electrophoresis[J]. Molecular Biotechnology, 2007, 2(3): 677-84.
[13] Marcone C, Neimark H, Ragozzino A, et al. Chromosome sizes of phytoplasmas composing major phylogenetic groups and subgroups[J]. Phytopathology, 1999, 89(9): 805-810.
[14] 杨毅,车海彦,曹学仁,等.植原体基因组学研究进展[J].植物保护,2014,40(6):1-6.
[15] Kollar A, Seemüller E, Bonnet F, et al. Isolation of the DNA of various plant pathogenic mycoplasmalike organisms from infected plants[J]. Phytopathology, 1990, 80(3): 233-237.
[16] Tran-Nguyen L T T, Gibb K S. Optimizing phytoplasma DNA purification for genome analysis[J]. Journal of Biomolecular Techniques Jbt, 2007, 18(2):104-12.
[17] P Field. CHEF-DR©II pulsed field electrophoresis systems instruction manual and applications guide[Z]. Bio-Rad Laboratories, 1992.
[18] Maejima K, Oshima K, Namba S. Exploring the phytoplasmas, plant pathogenic bacteria[J]. J Gen Plant Pathol, 2014, 80(3): 210-221.
[19] Han H, Zhou H J, Li H S, et al. Optimization of pulse-field gel electrophoresis for subtyping ofKlebsiellapneumoniae[J]. International Journal of Environmental Research & Public Health, 2013, 10(7): 2720-2731.
(责任编辑:曾小军)
Isolation of Phytoplasma Genomic DNA from Jujube Witches Broom by Differential Centrifugation Combined with PFGE
FU Qiang, FU Bing, YE Xia, TAN Bin, ZHENG Xian-bo, LI Ji-dong, FENG Jian-can*
(College of Horticulture, Henan Agricultural University, Zhengzhou 450002, China)
In order to know the molecular characteristics and pathogenic mechanism of jujube witches broom (JWB) phytoplasma, as well as its interaction with the host, the author isolated the phytoplasma genomic DNA from JWB in tissue-culture jujube seedlings by using differential centrifugation combined with pulsed field gel electrophoresis (PFGE). The results indicated that the infected tissue-culture seedlings had a bright stripe in 1600~2200 kb, but the healthy tissue-culture seedlings had not. After recycling, PCR detection proved that this target stripe was the phytoplasma genomic DNA of JWB. The separation results of real-time quantitative PCR showed that this experimental method could effectively separate the phytoplasma genome and plant genome.
JWB; Phytoplasma; PFGE; PCR; RT-PCR
2016-06-16
河南省现代农业产业技术体系大宗水果产业技术创新团队项目(S2014-11-G02);河南省高校科技创新团队支持计划项目(14IRTSTHN011)。
傅强(1991─),女,河南南阳人,硕士研究生,研究方向:果树分子育种。*通讯作者:冯建灿。
S665.1
A
1001-8581(2016)12-0066-04
