转基因大豆质粒DNA标准物质的研制
2016-12-06李兰英闻艳丽任淑贞
梁 文, 许 丽, 李兰英, 李 妍, 闻艳丽, 徐 勤, 任淑贞, 刘 刚
(上海市计量测试技术研究院 化学与电离辐射所,上海 201203)
转基因大豆质粒DNA标准物质的研制
梁 文, 许 丽, 李兰英, 李 妍, 闻艳丽, 徐 勤, 任淑贞, 刘 刚
(上海市计量测试技术研究院 化学与电离辐射所,上海 201203)

为了方便、快速地检测大豆及其加工食品中的转基因成分,准确定量转基因大豆的转基因含量,构建含常用转基因插入元件花椰菜花叶病毒CaMV35S启动子、NOS终止子、新霉素磷酸转移酶基因NPTⅡ、玄参花叶病毒FMV35S启动子和大豆内源基因Lectin-1的质粒DNA标准物质,质粒DNA中靶基因元件均为单拷贝。开展了质粒DNA标准物质的均匀性、稳定性、检测适用性、定值及不确定度评价。结果表明,在实时荧光定量PCR(qPCR)检测中,质粒DNA的4种转基因插入元件分别与大豆内源基因Lectin-1的比值为0.98±0.06(CaMV35S:L-1),0.95±0.06(FMV35S:L-1),1.05±0.08(NOS:L-1),1.11±0.08(NPTII:L-1)(k=2),靶基因扩增的标准曲线R2>0.99,可用于转基因检测实验室的结果质量控制,能力验证等活动。
转基因大豆; 质粒标准物质; 不确定度评定
0 引 言
转基因技术将基因在不同物种之间转移,改造生物的遗传物质,使其在性状、营养品质、消费品质等方面向人类所需要的目标转变,满足人类的各种需求,例如提高产量、表达特殊营养成分甚至获得抗除草剂抗病毒或抗虫害的能力[1-3]。但是,随着转基因作物在全世界范围内的广泛种植,其食用安全和环境安全问题也引起了广大消费者和各国政府及相关机构人员的重视[4-5]。转基因成分检测已成为各国转基因产品监管的重要部分。qPCR是转基因核酸检测的主要方法[6-7]。转基因作物中常用的插入元件CaMV35S、NOS、NPTⅡ、FMV35S常作为靶标基因,用于鉴定转基因成分和含量[8-10],而转基因大豆内源基因Lectin-1由于保守性强,常作为大豆内标准靶标基因[11]。
本文首先构建的质粒DNA标准物质含有4个转基因插入元件和一个大豆内源基因,测序验证各转基因元件和内源基因的比例均为1∶1;然后优化了qPCR法检测靶标基因的引物探针和PCR体系,并用该体系研究了质粒DNA的均匀性、稳定性、检测适用性、量值及不确定度评价,为其作为转基因检测阳性标准物质提供数据支持。
1 实验材料与实验方法
1.1 试剂及仪器
基因组提取试剂盒(OMEGA);质粒提取试剂盒(OMEGA);限制性内切酶、λ-Hind III DNA Marker(宝生物工程有限公司);质粒载体pcDNA3.1(+)(Invitrogen),全基因人工合成、引物合成(宝生物工程有限公司);转基因大豆粉末标准物质(ERM-410gk);其他生化试剂均为进口分装或国产分析纯。
快速梯度PCR仪(Bio-rad);实时荧光定量PCR仪(Life technologies);微量核酸蛋白定量仪(Nanodrop 2000);电泳仪、电泳槽(BioRad);凝胶成像仪(BioRad)。
1.2 实验方法
(1) 质粒DNA分子的构建和提取。在数据库中检索转基因通用元件的保守序列:花椰菜花叶病毒CaMV 35S启动子(269 bp)、NOS终止子(256 bp)、新霉素磷酸转移酶基因NPT Ⅱ(831 bp)、玄参花叶病毒FMV 35S启动子(564 bp),人工合成并插入到质粒载体pcDNA3.1(+)中,得到质粒pLW09,设计引物序列,提取大豆的基因组DNA,克隆大豆内源基因Lectin-1,并插入到质粒载体pLW09,得到转基因大豆检测质粒pLW12。将构建的质粒转入大肠杆菌中,大量提取质粒DNA。
(2) 质粒DNA纯度的验证。用紫外分光光度法测定DNA在A230,A260,A280处的吸光值。纯DNA的A260/A280应为1.8~2.0[12],而A260/A230应达到2.0。用凝胶电泳图像分析法鉴定单酶切前后的质粒分子。
(3) 实时荧光定量PCR引物探针和程序。参考已报道的检测4种转基因元件和大豆内标准基因Lectin-1的引物探针[13],并根据PCR的扩增效率对引物探针进行优化,序列详见表1。PCR扩增程序为:95 ℃,10 min;95 ℃,15 s;60 ℃,1 min;40个循环。

表1 转基因插入基因及植物内标准基因的引物及探针序列
(4) 适用性考察。梯度稀释质粒DNA标准物质,浓度从(106~100)copies/μL,以梯度稀释的质粒DNA标准物质为模板进行qPCR扩增。每个反应重复3次,根据不同浓度模板扩增的Ct值与浓度之间的关系,建立标准曲线。
(5) 均匀性分析。方差分析法是用来统计检验均匀性的最常用方法,是通过组间、组内方差的比较来判断各组测量值之间有无系统性差异,如果两者的比小于统计检验的临界值,则认为样品是均匀的[14]。
具体方法:从质粒DNA标准物质中随机抽取15瓶;对所取每个样品取样3次,每次取样量为5 μL。每个取样量用qPCR法进行重复测定,将外源转基因元件CaMV35S和大豆内标准基因扩增得到的Ct值相比后,对测定结果用方差分析法(F-检验法)进行统计,判断均匀性检验结果。
(6) 稳定性考察。稳定性考察包括短期稳定性考察与长期稳定性考察[14]。将制备的质粒DNA标准物质放置在室温20 ℃和4 ℃下,以转基因元件和内标准基因在PCR扩增中的Ct比值为特性量值,进行15 d的短期稳定性考察。同样,分别在样品制备完成后0~4、6个月对制备的质粒DNA标准物质进行长期稳定性考察。
2 结果与分析
2.1 质粒DNA的分子构建
质粒分子在载体pcDNA3.1(+)上首先连续插入4种转基因元件CaMV35S(269 bp)、NOS(256 bp)、NPTⅡ(831 bp)、FMV35S(564 bp),然后再克隆大豆内标准基因Lectin-1(789 bp),得到总长为8 149 bp的质粒分子(见图1)。
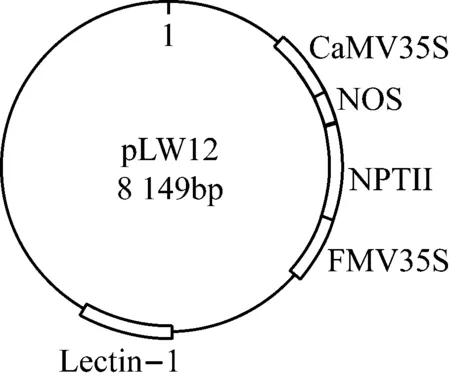
图1 质粒分子的结构示意图
2.2 质粒DNA的纯度鉴定
质粒DNA用紫外分光光度计Nanodrop2000检测,A260/A280=1.89,A260/A230=2.02,均满足紫外分光光度法鉴定核酸的标准。电泳分析DNA纯度,质粒DNA经内切酶Kpn I单酶切处理(37 ℃水浴酶解2 h),用0.8%琼脂糖电泳凝胶成像分析DNA条带(见图2)。
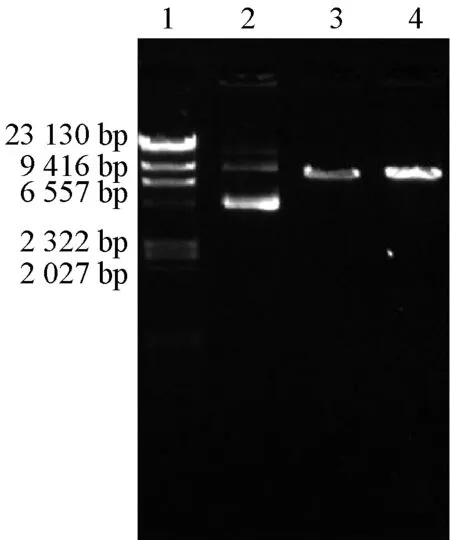
图2 酶切前后质粒DNA电泳图
电泳上样顺序:1-Marker,2-环状质粒,3-酶切后线状质粒(50 ng),4-酶切后线状质粒(100 ng)
2.3 质粒测序验证
通过测序验证质粒DNA的序列与设计序列的一致性和拷贝数的单一性。6家单位的测序结果均表明,转基因元件和大豆内标准基因的序列和设计序列的正确性为100%,参与测序的6家单位分别是:英潍捷基(上海)贸易有限公司,生工生物工程(上海)股份有限公司、上海美吉生物医药科技有限公司,铂尚生物技术(上海)有限公司,苏州金唯智生物科技有限公司,上海杰李生物技术有限公司。最终结果显示转基因插入元件和内标准基因的比例均为1∶1。
2.4 适用性考察结果
以质粒DNA标准物质建立的标准曲线见图3,相关线性系数均达到0.99,各梯度之间无交叉,每个靶基因拷贝数检测的最低检出限(LOD)均小于100 copies/μL,表明质粒DNA标准物质适合应用于qPCR检测,可作为qPCR法检测转基因作物常用靶基因序列的阳性标准物质。
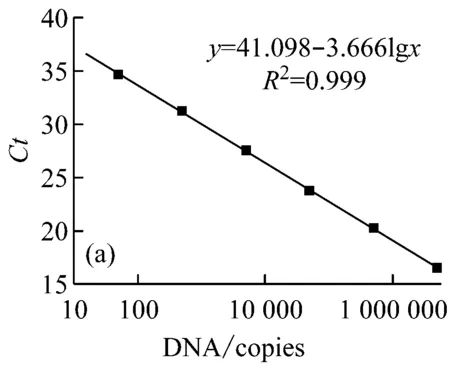


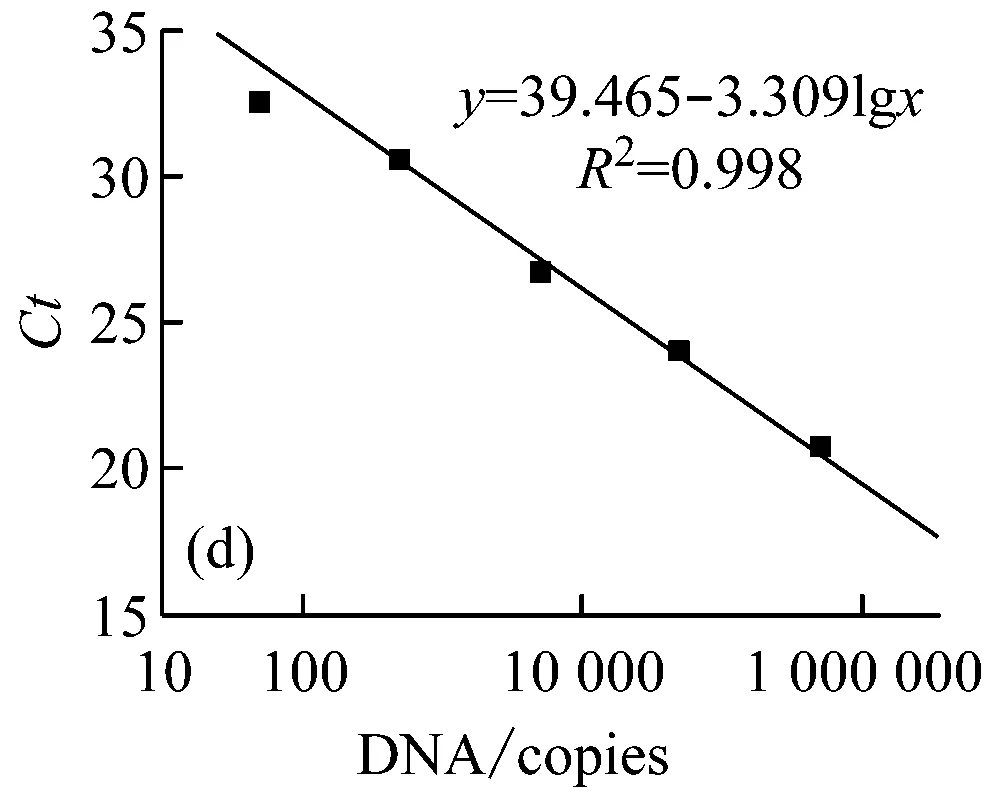
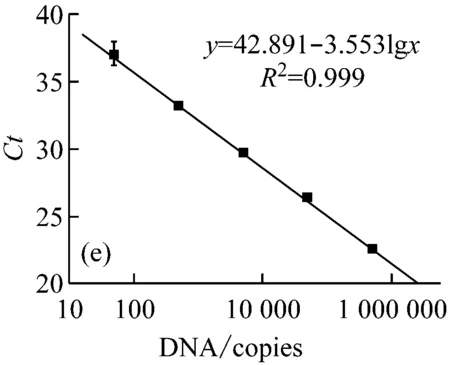
图3 质粒DNA靶基因的PCR扩增标准曲线
(图(a)~(e)的靶基因分别为大豆内标基因Lectin-1,转基因元件CaMV35S、NOS、NPTⅡ、FMV35S)
2.5 均匀性分析结果
将质粒DNA作为模板,qPCR扩增得到转基因元件与内标准基因的Ct比值为特性量值,用F检测对数据进行分析。质粒DNA标准物质的瓶间均匀性统计结果表明,在95%置信水平下,F值均小于F0.05(14,30),证明各质粒DNA标准物质的瓶间均匀性良好,符合《JJG1006-94 一级标准物质技术规范》瓶间均匀性检验合格要求。
2.6 稳定性检测结果
实验采用同步稳定性研究,利用qPCR法,将质粒标准物质各转基因元件基因和植物内标准基因扩增的Ct相比,将比值采用线性模型进行分析。质粒DNA标准物质在20 ℃和4 ℃下的短期稳定性统计结果表明,斜率不显著(P>0.05),质粒DNA标准物质在20℃和4℃下保存15 d是稳定的。质粒DNA标准物质在-20 ℃条件下进行6个月的长期稳定性统计结果显示,斜率不显著,因此质粒DNA标准物质在-20 ℃条件下保存6个月内是稳定的,见表2。

表2 质粒DNA标准物质pLW12在-20 ℃保存的长期稳定性检测数据
2.7 定值结果
用qPCR测定转基因元件和植物内标准基因在PCR反应中的Ct值,以转基因元件和内标准基因的Ct比值为特性量值给标准物质定值,共得到6组数据,每组平行测定3次取平均值,进行定值分析。汇总全部原始数据,经检测,全部原始数据符合正态分布,且各组数据等精度。以t-检验法和狄克逊(Dixon)法检验数据,证明每组数据的平均值不存在显著性差异;将6个平均值再次计算平均值,求出质粒DNA标准物质的Ct比值的平均值,即为质粒DNA标准物质的特性量值(单位:1),数据见表3。
2.8 不确定度评定
质粒DNA标准物质的不确定度来源由三部分组成:①标准物质的不均匀性引起的不确定度;②标准物质在有效期内的变动性引起的不确定度;③标准物质的定值过程带来的不确定度,包括数据统计引入的不确定度和通过对定值方法中测量影响因素进行分析评定的不确定度[15]。

表3 质粒DNA标准物质pLW12的定值结果
(1) 均匀性引入的不确定度。均匀性分析结果表明,质粒DNA标准物质的瓶间差异极小。瓶间均匀性引入的不确定度(具体数据见表4):
(2) 稳定性引入的不确定度。在6个月稳定性检测中,有效期t=6月长期稳定性引起的不确定度为:
其中:s(β1)为长期稳定性检验部分求出的与斜率相关的不确定度因素。
(3) 定值和数据统计引入的不确定度。标准物质定值过程带来的不确定度包括:数据统计引入的不确定度和通过对定值方法中测量影响因素进行分析评定的不确定度。
质粒DNA标准物质由数据统计引入的不确定度为由6组测量结果计算的A类不确定度。合成标准不确定度为下式所示:
通过对测量影响因素的分析,得出B类不确定度的分量(uB)。该分量与标准物质研制的整个过程有关,本研究主要考虑移液器的加样过程,移液器带来的不确定度主要为质粒核酸溶液取用的重复性偏差。根据10 μL移液器的检定结果,最大相对标准偏差为0.38%,按照均匀分布转化,则
(4) 扩展不确定度。标准物质的合成不确定度:
标准物质的扩展不确定度u(c)计算,取扩展因子k=2,结果见表4。
3 结 语
本研究通过调研国内外转基因作物PCR相关检测方法,构建了一个包含4种转基因常用插入元件靶基因序列CaMV35S启动子、NOS终止子、新霉素磷酸
表4 质粒DNA标准物质的不确定度分量
不确定度分量CaMV35SFMV35SNOSNPTIIurel(bb)0.0080.0080.0080.007urel(s)0.0240.0320.0400.032urel(A)0.0100.0090.0080.011urel(B)0.0020.0020.0020.002u(c)0.0600.0600.0800.080
转移酶基因NPTⅡ、FMV35S启动子和大豆内标准基因Lectin-1的质粒DNA标准物质,使转基因检测质粒DNA标准物质中的转基因元件和作物内标准基因的比例为1∶1,即转基因含量为100%,利于转基因成分含量的计算。对质粒DNA标准物质的定值方法进行了探索,应用基因测序法和qPCR两种方法对质粒DNA标准物质进行了定值;依照标准物质研制技术要求对质粒DNA标准物质的均匀性和稳定性进行了考察,证明其具有良好的均匀性和稳定性。用优化后的qPCR检测方法,以研制的质粒DNA标准物质为模板,针对5种转基因检测靶标基因均能建立线性良好的标准曲线,证明其适用于转基因大豆的qPCR法检测。
[1] Nuti M,Felici C, Agnolucci M. The use of GMOs (genetically modified organisms):agricultural biotechnology or agricultural biopolitics?[J]. Riv Biol, 2007, 100(7):189-202.
[2] Jones R. Genetically modified organisms crops in agriculture? Food for thought[J]. Mo Med,2015,112(1):28-29.
[3] Acharya S,Ranjan R, Pattanaik S,etal. Efficient chimeric plant promoters derived from plant infecting viral promoter sequences[J]. Planta,2014,239(2):381-396.
[4] Sweet J. The 10th International Symposium on the Biosafety of Genetically Modified Organisms [J]. Environ Biosafety Res, 2009, 8(3):161-181.
[5] Holst-Jensen A,Bertheau Y, de Loose M,etal. Detecting un-authorized genetically modified organisms (GMOs) and derived materials[J]. Biotechnol Adv, 2012, 30(6):1318-1335.
[6] Peano C, Bordoni R, Gulli M,etal. Multiplex polymerase chain reaction and ligation detection reaction/universal array technology for the traceability of genetically modified organisms in foods[J].Anal Biochem,2005, 346(1):90-100.
[7] Meric S,Cakir O, Turgut-Kara N,etal. Detection of genetically modified maize and soybean in feed samples[J].Genet Mol Res, 2014, 13(1):1160-1168.
[8] Wang X M, Teng D, Yang Y,etal. Construction of a reference plasmid molecule containing eight targets for the detection of genetically modified crops[J]. Appl Microbiol Biotechnol, 2014, 90:721-731.
[9] 朱元招,尹靖东. 抗草甘膦转基因大豆定量检测研究[J]. 中国农业大学学报, 2005,10(3):25-29.
[10] 金荣愉,崔海峰. 含多个基因元件的质粒标准分子的构建与分析[J]. 农业生物技术学报, 2013, 21(10):1249-1260.
[11] Huang C,Pan T, Event-specific real-time detection and quantification of genetically modified Roundup Ready soybean[J]. Agric Food Chem, 2005, 53(10):3833-3839.
[12] Lin C H, Chen Y C, Pan T M. Quantification bias caused by plasmid DNA conformation in quantitative real-time PCR assay[J]. PLoS One, 2011, 6(12):e29101.
[13] SN/T 1204-2003 植物及其加工产品中转基因成分实时荧光PCR定性检验方法[S].
[14] ISO Guide 35:2006 Reference materials General and statistical principles for certification.Geneva:International Organization for Standardization[S].
[15] 黄文胜,邓婷婷. 转基因定量检测的不确定度研究[J].中国生物工程杂志, 2012, 32(1):49-55.
Development of a Plasmid DNA Reference Material for PCR Analysis of Genetically Modified Roundup Ready Soybean
LIANGWen,XULi,LILan-ying,LIYan,WENYan-li,XUQin,RENShu-zhen,LIUGang
(Chemical and Ionizing Radiation Metrolology Institute, Shanghai Institute of Measurement and Testing Technology, Shanghai 201203, China)
In order to find a simplified and accurate detection of the genetically modified soybean and its processed food, we developed an unique plasmid molecule for genetically modified soybean PCR analysis, it contained four exogenous target DNA element of genetically modified organisms (CaMV35S, NOS, NPTII and FMV35S), and one element of soybean endogenous (Lectin-1 gene, L-1). All the target genes were inserted into the plasmid with single copy. We quantified the ratios of the exogenous target DNAs and the L-1 as the certified valued of the reference material, and we evaluated the uniformity, stability, and the uncertainty, and examined the applicability of our plasmid. The certified values and expanded uncertainties (k=2) for the candidate reference material in the real time PCR were 0.98±0.06 (CaMV35S:L-1), 0.95±0.06 (FMV35S:L-1), 1.05±0.08 (NOS:L-1), 1.11±0.08 (NPTII:L-1), respectively. TheR2values of the standard curve for target genes were all higher than 0.99. The plasmid reference material can be used in quality control and proficiency testing for GMOs analysis. It is innovative that plasmid DNA standard material containing multiple transgenic testing element and the ratio of gene copy number for each element and soybean is 1∶1.
genetically modified roundup ready soybean; plasmid reference material; uncertainty evaluation
2015-08-06
国家质检公益性行业科研专项(201310016);上海市计量测试技术研究院项目(HOORY1406)
梁 文 (1986-),女,四川德阳人,硕士,工程师,主要研究方向为生物计量。
Tel.:021-38839800*35350;E-mail:liangw@simt.com.cn
Q 819
A
1006-7167(2016)05-0018-04
